腹腔镜下肾部分切除术后急性肾损伤的危险因素及其预测价值
范春玲,刘永哲,*山西医科大学麻醉学院,太原 030000;解放军总医院第三医学中心麻醉科,北京 00039
腹腔镜下肾切除手术包括肾部分切除术(laparoscopic partial nephrectomy,LPN)和根治性肾切除术(laparoscopic radical nephrectomy,LRN),是肾细胞癌(renal cell carcinoma,RCC)治疗的首选方式,也是改善患者肾功能和提高生活质量的有效方法。由于患侧肾脏切除、健侧肾脏储备功能不足、缺血再灌注损伤、围术期大量输血、术后感染及使用肾损害药物等原因,术后患者容易并发急性肾损伤(acute kidney injury,AKI),严重时发展为慢性肾病的风险增高[1]。即使在出院时肾功能明显恢复的情况下,估算肾小球滤过率(estimated glomerular filtration rate,eGFR)相较术前也会呈持续下降的趋势[2]。AKI是外科术后常见的并发症,发生于20%~40%的高危患者中[3-4]。LPN术后AKI发生率达20.3%,而LRN术后AKI发生率高达61.6%[5]。AKI可导致住院时间延长、医疗费用增加、慢性肾脏病及心血管意外等术后并发症发生率及病死率升高[6-10]。因此,早期识别RCC术后AKI高风险的患者并及时实施肾保护策略尤为重要,可显著减少中/重度AKI的发生,缩短ICU滞留时间和住院时间,从而显著改善患者预后[11-12]。研究发现,围术期发生AKI的独立危险因素包括高龄、术前合并高血压、活动性充血性心力衰竭、慢性肾病、肺病、胰岛素依赖型糖尿病、外周血管疾病、存在腹水及高体重指数(body mass index,BMI)等[13-14]。本研究旨在探讨全麻下接受LPN的RCC患者术后发生AKI的危险因素及其预测价值。
1 资料与方法
1.1 研究对象 回顾性分析2020年11月-2021年6月解放军总医院第三医学中心泌尿外科收治的60例接受LPN的RCC患者的临床资料,其中男45例,女15例。纳入标准:经腹部彩超确诊为单侧RCC;取血清前未接受过放、化疗及相关免疫治疗;术后病理证实为单侧RCC;肿瘤分期为T1a期(肿瘤直径<4 cm)和T1b期(肿瘤直径4~7 cm)[15-17]。排除标准:年龄<18岁;孤立肾者;术前使用肾毒性药物;术前合并肾功能不全;既往有肾脏手术史;急诊手术。本研究获得解放军总医院第三医学中心医学伦理委员会批准(KY2021-004)。
1.2 麻醉方法 所有患者术前常规禁食8 h、禁饮4 h,无术前用药,入室后建立静脉通路,连接监护仪,常规监测心电图、血压、心率、经皮脉搏血氧饱和度(pulse oxygen saturation,SpO2)。麻醉诱导:静脉注射咪达唑仑0.1 mg/kg、丙泊酚2 mg/kg、舒芬太尼0.3 μg/kg、顺式阿曲库铵0.2 mg/kg。诱导后行气管插管,采用容量控制呼吸,调节呼吸机参数:新鲜气体流量2 L/min,潮气量6~8 ml/kg,呼吸频率10~12次/min,吸呼比1:2,吸入氧浓度50%~70%。麻醉后行桡动脉或股动脉穿刺动脉测压,维持动脉血二氧化碳分压(arterial partial pressure of carbon dioxide,PaCO2)在35~45 mmHg。麻醉维持:采用静吸复合麻醉,吸入1%~2%七氟醚,微量泵持续泵注丙泊酚20~30 ml/h、血浆靶浓度2~4 ng/ml靶控输注瑞芬太尼,根据手术需要间断静脉注射舒芬太尼、顺式阿曲库铵,维持脑电双频指数(bispectral index,BIS)在40~50。当动脉压低于基础值的20%或术中平均动脉压(mean arterial pressure,MAP)<65 mmHg时,适当加快补液(如快速输入适量羟乙基淀粉),同时给予去氧肾上腺素或麻黄碱调整血压至正常范围;当动脉压高于基础值的20%时,追加阿片类药物镇痛,或加深麻醉深度,或采用地尔硫 、乌拉地尔降低血压至正常范围。术中补液首先以6 ml/(kg.h)输注乳酸钠林格液,按照晶胶比2:1输注羟乙基淀粉。所有患者术中血红蛋白(hemoglobin,Hb)均未低于90 g/L,故未输注浓缩红细胞。术毕观察患者意识清醒、BIS达到90以上、吸入空气5 min SpO2维持在96%以上时,拔除气管导管并清理气管内及口腔分泌物,待生命体征平稳后返回病房。
1.3 AKI诊断标准及分期 根据KDIGO指南诊断标准[18]:术后48 h内血清肌酐(serum creatinine,Scr)上升≥0.3 mg/dl (26.5 μmoL/L)或7 d内Scr上升至基线值的1.5倍,或尿量<0.5 ml/(kg.h)持续6 h及以上即诊断为AKI。根据术后是否发生AKI分为AKI组(n=26)与非AKI组(n=34)。
AKI分为Ⅰ-Ⅲ期[1]。Ⅰ期:48 h内Scr上升≥0.3 mg/dl (26.5 μmol/L),和(或)Scr≥基线值的1.5倍,7 d内尿量<0.5 ml/(kg.h)持续6~12 h;Ⅱ期:Scr≥基线值的2倍,尿量<0.5 ml/(kg.h)持续≥12 h;Ⅲ期:Scr≥基线值的3倍或上升至≥4.0 mg/dl (353.6 μmol/L)或开始肾脏替代治疗,尿量<0.3 ml/(kg.h)持续≥24 h或无尿≥12 h。
1.4 临床资料收集 收集患者的年龄、性别、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级、BMI、术前Hb、合并疾病(如高血压、糖尿病、心血管疾病等)、糖尿病患者术前糖化血红蛋白(hemoglobin A1c,HbA1c)、高血压患者服用血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)和血管紧张素受体Ⅱ抑制剂(angiotensin receptor blockers,ARB)类降压药、术中情况(包括出血量、尿量、晶体液入量、胶体液入量、血管活性药物应用、肾动脉阻断时间、手术时间)、住院时间,以及术前及术后48 h的Scr、eGFR、β2微球蛋白(β2-microglobulin,β2-MG)、胱抑素(cystatin C,CysC)、空腹血糖(FPG)水平等临床资料。
1.5 术后发生AKI的危险因素及其预测价值分析采用单因素和多因素logistic回归分析术后发生AKI的危险因素。采用受试者工作特征(ROC)曲线分析相关危险因素对术后AKI的预测价值。
1.6 统计学处理 应用SPSS 25.0软件进行统计分析。计数资料以例(%)表示,两组间比较采用Pearsonχ2检验或Fisher确切概率法;符合正态分布的计量资料以±s表示,两组间比较采用两独立样本t检验,非正态分布的计量资料以M(Q1,Q3)表示,两组间比较采用两独立样本秩和检验。采用MedCalc 19.5.6软件绘制ROC曲线。P<0.05为差异有统计学意义。
2 结 果
2.1 两组基线资料比较 60例RCC患者术后发生AKI 26例,AKI发生率为43.3%(26/60),其中Ⅰ期22例(84.6%,22/26),Ⅱ期4例(15.4%,4/26)。两组性别、BMI、术前合并高血压、术前合并糖尿病、术中胶体液入量、肾动脉阻断时间、手术时间比较差异有统计学意义(P<0.05),其余变量差异均无统计学意义(P>0.05,表1)。
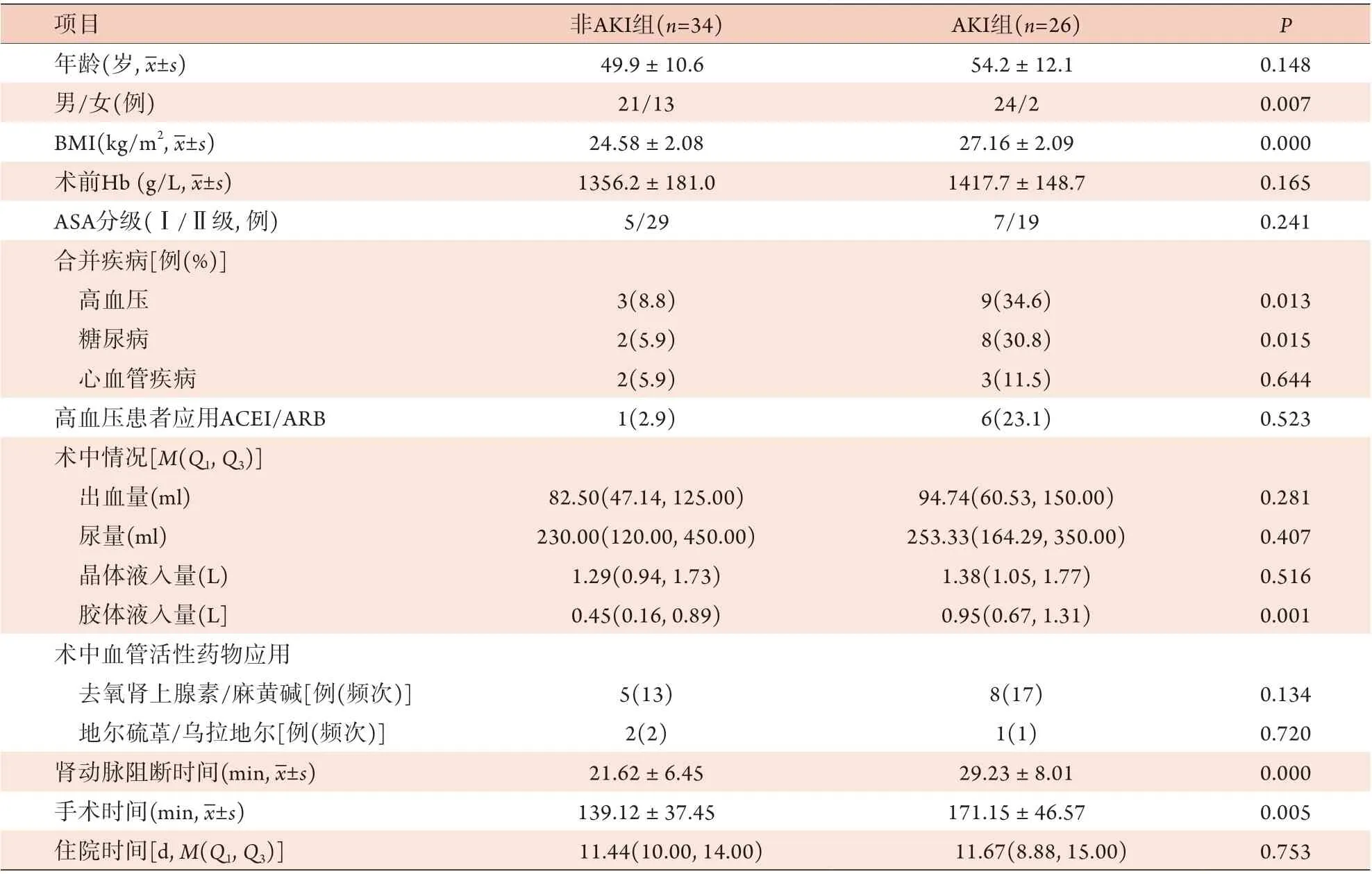
表1 AKI组与非AKI组肾细胞癌患者基线资料比较Tab.1 Comparison of the baseline data between AKI group and non-AKI group patients with renal cell carcinoma
2.2 两组Scr、eGFR、β2-MG、CysC、FPG、HbA1c比较 与术前比较,术后48 h两组eGFR明显降低(P<0.01),FPG水平明显升高(P<0.05或P<0.01);AKI组Scr、β2-MG、CysC水平明显升高(P<0.05或P<0.01)。与非AKI组比较,AKI组术前与术后48 h时eGFR均明显降低(P<0.05或P<0.01),β2-MG水平均明显升高(P<0.05或P<0.01)。与非AKI组比较,AKI组术后48 h时Scr、CysC、FPG水平均明显升高(P<0.01或P<0.05)。术前两组HbA1c比较差异无统计学意义(P>0.05) (表2)。
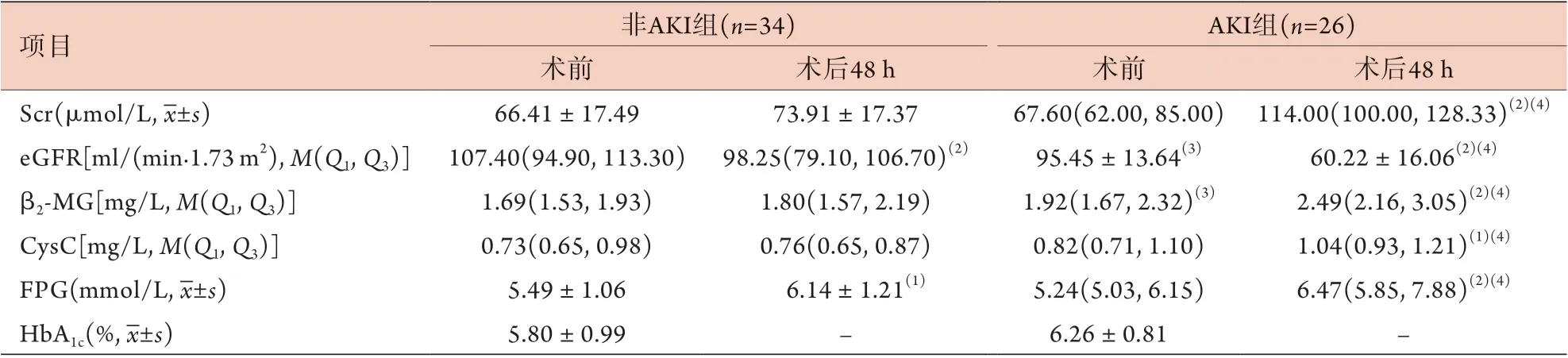
表2 AKI组与非AKI组肾细胞癌患者Scr、eGFR、β2-MG、CysC、FPG、HbA1c比较Tab.2 Comparison of Scr, eGFR, β2-MG, CysC, FPG and HbA1c between AKI group and non-AKI group patients with renal cell carcinoma
2.3 LPN术后AKI影响因素的单因素logistic回归分析 单因素logistic回归分析结果显示,性别是术后AKI发生的危险因素(P=0.014),男性患者LPN术后发生AKI的风险是女性的7.429倍;BMI可显著影响术后AKI的发生(P<0.05),BMI每提升1个单位,术后发生AKI的风险即可提升87.9%;术前合并高血压患者术后发生AKI的风险是非高血压患者的5.471倍(P=0.020);术前合并糖尿病的患者术后发生AKI的风险是非糖尿病患者的7.111倍(P=0.020);术中胶体液入量、肾动脉阻断时间、手术时间及术前eGFR、β2-MG也是LPN术后发生AKI的危险因素(P<0.05) (表3)。
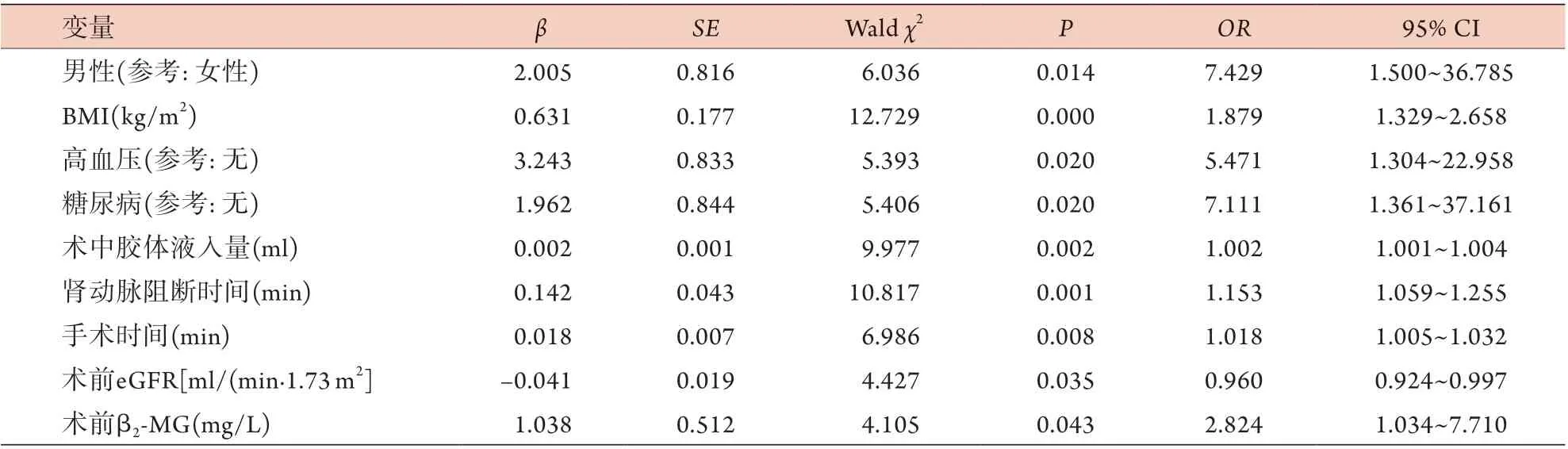
表3 LPN术后AKI影响因素的单因素logistic回归分析Tab.3 Univariate logistic regression analysis of risk factors for acute kidney injury after laparoscopic partial nephrectomy
2.4 LPN术后AKI影响因素的多因素logistic回归分析 以性别(男性)、BMI、术中胶体液入量、肾动脉阻断时间为自变量,以术后是否发生AKI作为因变量进行多因素logistic回归分析,结果显示,性别(男性)、BMI、术中胶体液入量及肾动脉阻断时间是LPN术后AKI的独立危险因素(P<0.05,表4)。男性患者LPN术后发生AKI的风险是女性的23.788倍(表4)。
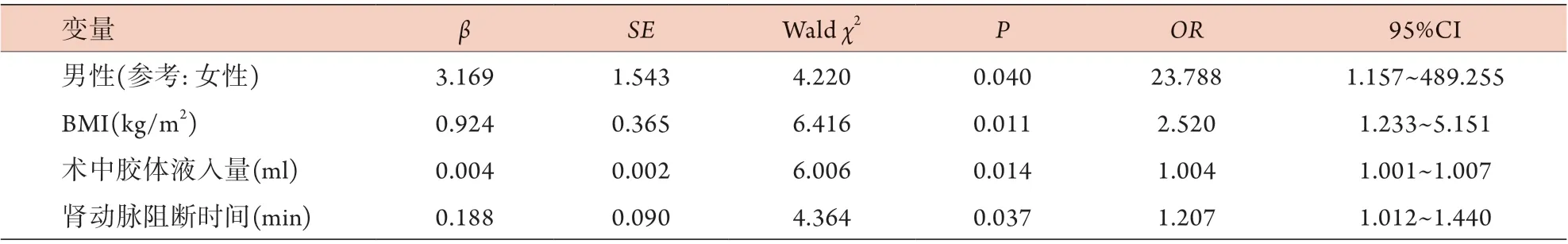
表4 LPN术后AKI影响因素的多因素logistic回归分析Tab.4 Multivariate logistic regression analysis of risk factors for acute kidney injury after laparoscopic partial nephrectomy
2.5 危险因素对LPN术后AKI的预测价值 ROC曲线分析结果显示,BMI、术中胶体液入量、肾动脉阻断时间的截断值依次为24.9 kg/m2、500 ml、24 min,敏感度为88.5%、73.1%、73.1%,特异度为64.7%、70.6%、73.5%,曲线下面积(AUC)为0.811、0.755、0.764(表5、图1)。
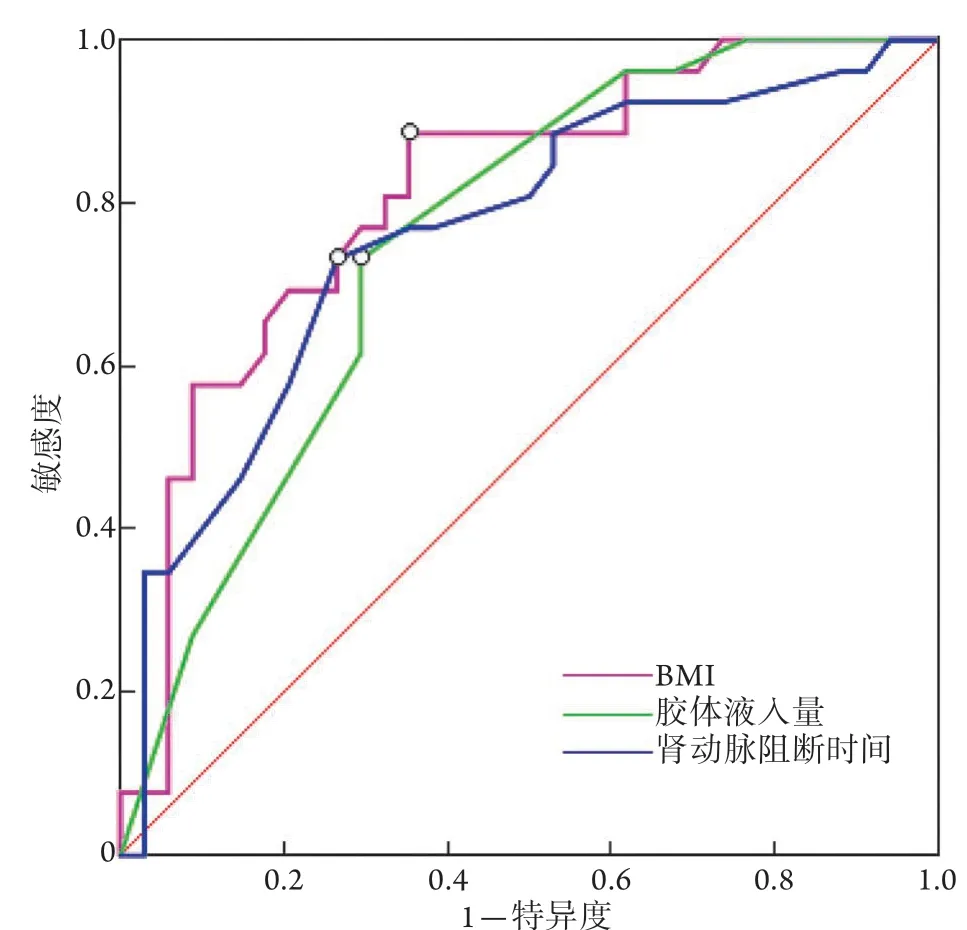
图1 ROC曲线分析BMI、胶体液入量、肾动脉阻断时间对LPN术后AKI的预测价值Fig.1 The predictive value of BMI, colloid fluid intake and renal artery occlusion time for AKI after LPN (ROC curve)
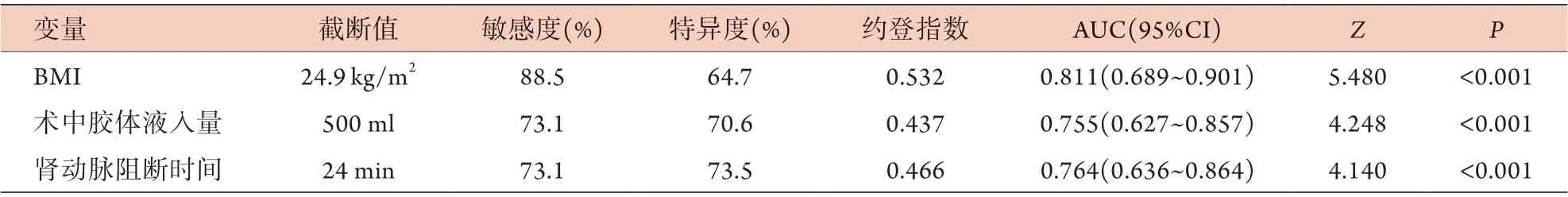
表5 ROC曲线分析危险因素对LPN术后AKI发生的预测价值Tab.5 The predictive value of risk factors for occurrence of AKI after LPN (ROC curve)
3 讨 论
本研究发现,BMI、术中胶体液入量和肾动脉阻断时间均是LPN术后AKI发生的独立危险因素并具有一定的预测价值,性别(尤其男性)也是LPN术后AKI发生的独立危险因素。近20年来,实体肾脏肿瘤发病率逐年上升,而RCC是泌尿系统中最常见的恶性肿瘤,约占全球所有恶性肿瘤的3%[19],且男女患者比例约2:1[20]。随着腹腔镜技术的应用和发展,LPN或LRN已成为RCC治疗的首选方法,但根据肿瘤大小的不同,术式的选择须谨慎。如LPN为T1a期(肿瘤直径<4 cm) RCC手术治疗的首选方法[15];有研究显示,对于T1b期(肿瘤直径4~7 cm)的RCC患者,LPN的远期预后与LRN几乎无异,由于LPN能更好地保护肾功能而逐渐取代LRN[16];但当肿瘤直径>7 cm (T2期)时,仍需行LRN[17]。LPN与LRN术后发生AKI一直是临床关注的重点,因此术前评估肾功能并早期识别导致术后AKI发生的危险因素(如年龄、性别、高血压、肥胖、糖尿病、化验指标等)至关重要。
有研究发现,LPN和LRN术后AKI的发生率分别为20.3%、61.6%[5];也有研究发现,部分肾切除术后AKI的发生率为16.5%~42.0%[21]。本研究中RCC患者LPN术后AKI的发生率为43.3%(26/60),其中AKI Ⅰ期占84.6%(22/26),Ⅱ期占15.4%(4/26),未发生Ⅲ期AKI。该结果与既往研究类似,但术后AKIⅠ期发生率颇高,因此LPN术后AKI不容忽视。
高血压是术后AKI发生的危险因素,围术期适当控制血压可预防或缓解AKI[9]。高血压所致肾损伤是指由于血压长期升高而引起肾小动脉及细小动脉发生病变,进而导致肾脏出现缺血性改变,具体表现为肾小动脉管壁增厚、管腔狭窄、肾小球滤过率下降,以及肾小球缺血性损伤等[22]。有研究发现,围术期应用ACEI/ARB类药物可引起术中持续低血压[23],甚至增高术后AKI的发生率及病死率[24]。另有研究在术前接受肾素-血管紧张素系统(renin-angiotensin system,RAS)抑制剂治疗的患者中观察到AKI发生率降低,分析原因可能与RAS抑制剂对术中肾灌注的保护作用有关,或是由于RAS抑制剂可通过阻断RAS活性来舒张出球小动脉并改善肾灌注[25]。本研究发现,RCC患者术前应用ACEI/ARB类药物并未导致术后AKI的发生,可能原因是术中血压维持正常,并未出现持续低血压。
糖尿病是心脏手术和原位肝移植术后AKI的独立危险因素[26-27],也被证实为肾部分切除术后AKI的危险因素,尤其是术前HbA1c>7%时[5]。糖尿病可通过以下机制导致术后AKI[28]:(1)高血糖可增加氧化应激并加重肾脏缺血/再灌注(ischemical/reperfusion,I/R)损伤。(2)细胞葡萄糖超载引起线粒体功能障碍和肾脏损伤。(3)炎症是导致肾脏损伤的重要因素,而高血糖会增高炎性细胞因子如白细胞介素-6(IL-6)、肿瘤坏死因子-α和IL-18的水平。(4)高血糖引起的内皮功能障碍可导致肾脏损伤。此外,糖尿病肾脏在I/R损伤后功能受损,原因可能是由于内皮素-1增加、有害诱导型一氧化氮合酶上调、肾脏自噬反应功能受损及应激反应基因p53的诱导[5]。HbA1c检测是评估糖尿病患者血糖管理的标准方法,可反映患者过去2~3个月的平均血糖水平;HbA1c为7%或更高的患者在进行冠状动脉搭桥手术后出现肾衰竭、脑血管意外、伤口感染甚至死亡的风险显著增加[29],但尚无研究确定术前HbA1c水平升高是否会增加肾切除术后的AKI。本研究发现,术前HbA1c水平升高与患者术后AKI发生无关,可能是由于患者HbA1c水平均未超过7%,术前血糖控制尚可,以及样本量过少所致。
本研究单因素logistic回归分析结果显示,高血压、糖尿病均是LPN术后发生AKI的危险因素,但多因素logistic回归分析并未得到相关内容的阳性结果,后续需要扩大样本量进行深入研究。
本研究发现,性别是LPN术后AKI的独立危险因素,男性患者较女性更容易受到术后AKI的影响,与既往研究一致[5,30]。在大鼠动物模型中,睾酮可抑制缺血诱导的一氧化氮合酶和促生存激酶的激活,从而导致大鼠炎症加重及功能性肾损伤[30],而雌激素可通过激活一氧化氮合酶,抑制内皮素-1的产生(从而抑制肾血管收缩),以及抑制肾交感神经系统造成的肾脏I/R损伤而发挥肾保护作用[5],这可能是女性患者LPN术后AKI发生率较低的原因,但仍需进一步研究加以验证。因此,男性患者可能需要更深入的术前咨询并应用肾脏保护策略。
BMI是重症患者AKI发生的独立危险因素,心脏和腹部手术后,BMI较高的患者AKI发生率明显增高[31]。高BMI与AKI发生风险的关系可通过以下机制解释:(1)由于RAS激活受损,肥胖可引起肾小球的血流动力学变化,如肾小球高灌注和高滤过可导致肾小球损伤;(2)肥胖可增加每个肾小球的血流动力学和代谢负荷,从而导致肥胖患者的功能性肾单位数量减少,即低数量的功能性肾单位与肾小球肥大和肾小球硬化有关,这是由于剩余的功能性肾单位毛细血管压力增加所致;(3)肥胖患者的脂肪细胞可能是炎性细胞因子激活和氧化应激的发生部位,氧化应激增强可导致肾小球损伤[32];(4)与肥胖相关的氧化应激、促炎细胞因子及内皮功能障碍可增加围术期AKI的发生风险[13]。本研究发现,BMI是LPN术后AKI的危险因素,且患者BMI>24.9 kg/m2时,需更加关注患者围术期肾功能的变化。
补液是预防低血容量和改善肾脏灌注的主要方法。研究发现,电解质组成与血浆相当的平衡晶体溶液是容量复苏的首选,可最大限度地减少不良肾脏事件和死亡事件[13]。胶体由于其大分子的存在,在体内停留的时间较晶体长,扩容效果较晶体好,如羟乙基淀粉、明胶或白蛋白通常用于血管内容积复苏[33]。但最近的临床试验发现,胶体尤其是羟乙基淀粉可引起AKI[34]。此外,临床上广泛使用的明胶可增加死亡、肾衰竭、过敏反应和凝血障碍的风险[14]。但胶体引起AKI的机制尚不明确。本研究发现,胶体液是LPN术后发生AKI的独立危险因素,且当术中胶体液入量>500 ml时,术后更易发生AKI。该结果可为临床补液提供参考,今后行LPN时术中补液应慎重。
本研究发现,肾动脉阻断时间是LPN术后AKI的独立危险因素。肾脏I/R可促进某些急性炎性细胞因子的形成,还可诱导肾小管坏死、炎症和细胞凋亡,从而导致肾小管上皮细胞死亡,最终造成肾功能障碍[1]。在血液再灌注过程中,缺血组织中会产生大量的氧化应激损伤产物,进一步加重缺血损伤和肾功能不全[35]。有研究发现,缺血时间每增加5 min,AKI的发生风险即上升16%,并提示25 min是一个临界值,术中控制缺血时间<25 min或能最大限度地减少术后AKI[5]。本研究发现,肾动脉阻断时间≥24 min时,术后更容易发生AKI。因此LPN术中肾动脉阻断时间最好控制在24 min以内。
综上所述,本研究结果表明,男性患者LPN术后更易发生AKI,BMI>24.9 kg/m2的患者围术期需关注肾功能的变化,术中补液时慎用羟乙基淀粉,并应考虑将肾动脉阻断时间尽量控制在24 min以内。但本研究仍存在一定的局限性:为单中心、小样本量研究;未评估长期肾功能的变化;仅采取统一的麻醉用药,未对不同麻醉药物对AKI的影响进行研究;仅观察常见的指标,未来需进一步纳入更多指标探讨LPN术后AKI的影响因素。

