镉对小鼠胚胎肝细胞BNL CL.2氧化损伤作用的研究
王 艳, 刘 畅,*, 靳二辉, 赵 磊,胡倩倩, 路振香, 李 磊
(1.安徽科技学院 动物科学学院,安徽 凤阳 233100; 2.农业农村部猪肉质量安全控制重点实验室,安徽 凤阳 233100; 3.动物营养调控与健康安徽省重点实验室,安徽 凤阳 233100)
随着我国工业化进程的快速发展,环境镉污染日益严重。目前,我国多地均存在着不同程度的镉污染问题[1]。土壤镉污染直接导致地下水、粮食、牧草及农作物中的镉含量超标,从而导致饲料及其原料中镉严重超标[2]。农业部饲料工业中心实验室承检的饲料添加剂样品中镉含量大幅超标,最高达8.4%;在贵州某污染区,饲料中镉含量达我国《饲料卫生标准》限量的13.16倍;徐喆[3]研究发现,黑龙江省某市鸡配合饲料中镉的总体超标率达7.1%。动物采食被污染饲料可造成急、慢性中毒,严重影响畜禽养殖业健康发展,更令人担忧的是镉还可以通过食物链进入人体,严重危害人畜健康。
镉为人和动物非必需元素[4],可经皮肤、呼吸道及消化道吸收进入体内[5],消除半衰期可长达10~30年之久,一经进入机体,几乎无法被释放出体外[6]。进入体内的镉可对肝、肾、肺、骨骼和脑等主要器官形成损害[7-8],也可导致免疫、神经、生殖等系统的损伤[9]。肝脏具有分泌胆汁、参与物质与能量代谢、吞噬、解毒和防御等多重生理功能。肝功能的复杂性和多样性增加了肝脏与各种毒性因子接触的机会,因此,肝脏最易受到各种致病因素的侵害而造成损伤。研究发现,肝脏是镉的主要靶器官之一,镉吸收进入血液循环后快速到达肝脏,在肝脏中进行蓄积,人体内大约1/6的镉蓄积于肝脏[10],急性或高剂量镉中毒主要表现为急性肝损伤[11]。镉暴露还与多种癌症的发生相关,特别是与肝癌的发生密切相关[12]。通常认为,镉诱导的急性肝损伤与氧化应激、炎症反应密切相关。然而,目前关于镉诱导肝损伤的确切机制尚未完全阐明,这对镉暴露肝损伤的防治工作带来巨大挑战,因此,深入揭示镉诱导肝损伤作用机制具有重要理论意义与临床应用价值。本研究通过建立体外镉诱导肝损伤模型并分析镉诱导肝脏氧化应激损伤作用,为进一步深入揭示镉诱导的肝损伤作用机制提供研究基础。
1 材料与方法
1.1 材料
正常小鼠胚胎肝细胞(BNL CL.2)由中国科学院细胞库/干细胞库提供;CdCl2、胎牛血清均购自美国Sigma公司;DMEM高糖培养液、磷酸盐缓冲液(pH7.4,PBS)与0.25%胰蛋白酶均购于美国Gibco公司;总超氧化物歧化酶(Superoxide Dismutase,SOD)活性检测试剂盒(WST-8法)、丙二醛(Malondialdehyde,MDA)检测试剂盒、CCK-8细胞活力检测试剂盒与Hoechst 33342染液等购于上海碧云天生物技术公司。
1.2 方法
1.2.1 细胞培养 正常小鼠胚胎肝细胞(BNL CL.2)培养于含10%胎牛血清的DMEM高糖的培养基当中,在37 ℃、含5% CO2细胞培养箱中培养,隔日换液,待细胞长满后,再经0.25%胰蛋白酶消化,加入新鲜的DMEM高糖细胞培养液,反复吹打成单细胞悬液后,按照1∶3进行传代培养。
1.2.2 CCK-8法测定镉对BNL CL.2细胞的毒性作用 收集处于对数生长期的BNL CL.2细胞,以2×104个/孔接种至96孔板,置37 ℃、5% CO2培养箱中培养过夜,浓度为0~80 μmol/L的CdCl2处理0~24 h,每个处理设6个复孔,于试验结束前3 h在每孔加入CCK-8试剂10 μL,试验结束时采用酶标仪(Multiskan GO1510,Thermo Fisher公司)于450 nm 处测定吸光度,并计算各处理组细胞存活率。
1.2.3 HE染色 使用40 μmol/L CdCl2分别处理细胞0、3、6、12、18、24 h后,用PBS轻轻洗涤3次,使用95%酒精固定13 min,然后用PBS洗2次,每次1 min,接着使用苏木素染液染色10 min,自来水洗3遍后,浸入1%盐酸-酒精溶液分色数秒,然后再用自来水浸洗3遍,随后用伊红染液复染12 min,自来水浸洗后进行拍照分析。
1.2.4 Hoechst 33342染色 取对数生长期的BNL CL.2细胞接种至培养皿中,经40 μmol/L CdCl2分别处理0、3、6、12、18、24 h后,每个培养皿加入1.5 mL Hoechst 33342细胞染液,37 ℃避光条件下孵育10 min;然后弃掉染液,加入少量PBS缓冲液轻轻洗涤2次后,使用倒置荧光显微镜(T12-U+Q12,尼康)观察细胞形态并拍照。
1.2.5 CdCl2对BNL CL.2细胞SOD活力的影响 BNL CL.2细胞经40 μmol/L CdCl2分别处理0、3、6、12、18、24 h后,按照SOD检测试剂盒说明书测定各组样品中SOD的活力,以BCA法测定各组样本的蛋白浓度,并根据样品蛋白浓度校正各组SOD测定结果。
1.2.6 CdCl2对BNL CL.2细胞MDA含量的影响 BNL CL.2细胞经40 μmol/L CdCl2作用不同时间后,按照试剂盒说明书测定各组样品中MDA的含量,并根据各组样品蛋白浓度校正测定结果。
2 结果与分析
2.1 不同浓度的CdCl2对小鼠肝细胞活力的影响
采用CCK-8细胞毒性试验测定不同浓度CdCl2对BNL CL.2细胞活力的影响。结果如图1所示,与空白对照组相比,40 μmol/L和80 μmol/L CdCl2处理12 h可极显著抑制BNL CL.2细胞活力(P<0.01),而10 μmol/L和20 μmol/L对BNL CL.2细胞活力无显著影响(P>0.05),因此,在后续研究中选择40 μmol/L CdCl2作为处理因素。
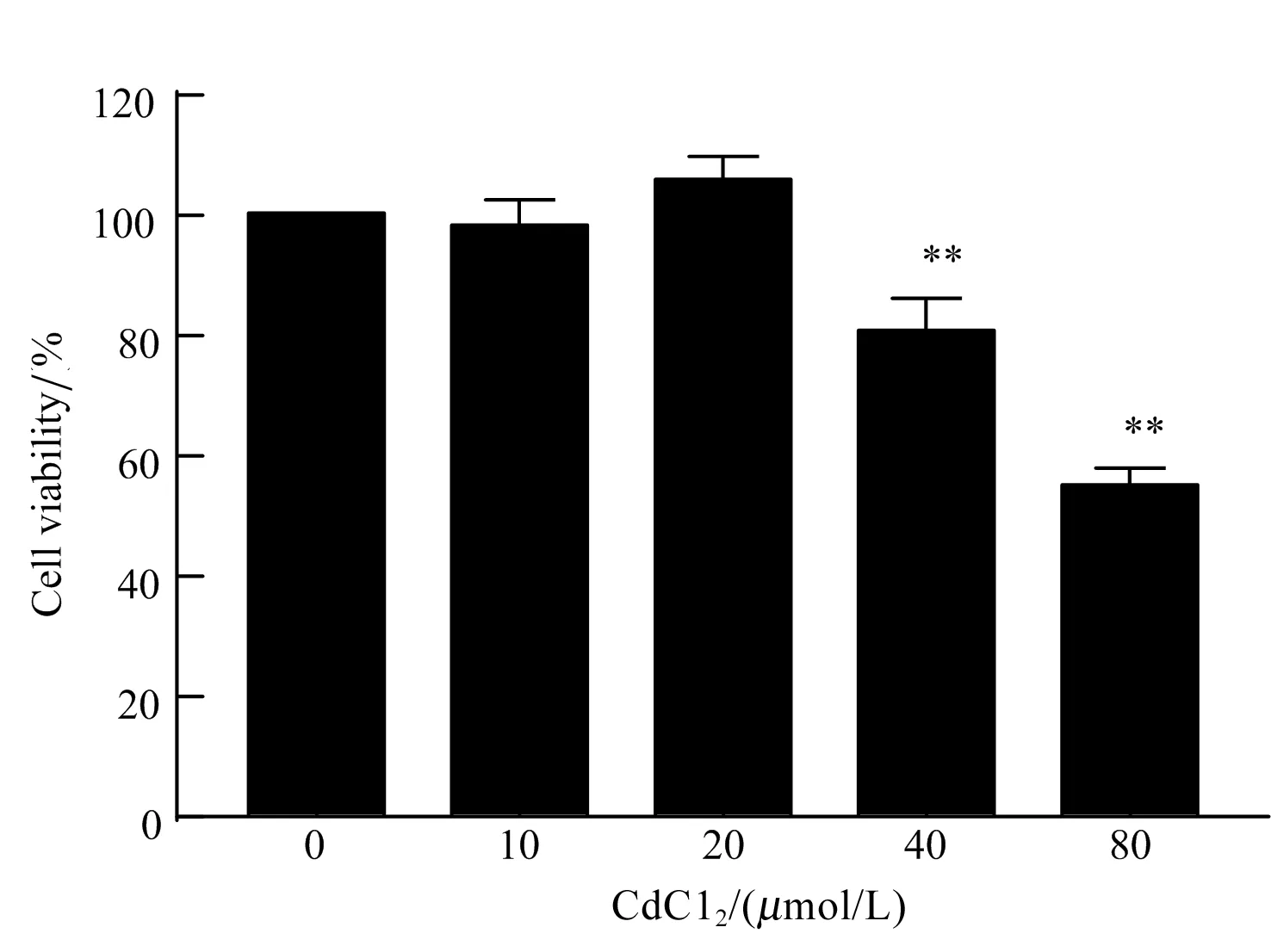
图1 不同浓度CdCl2对小鼠肝细胞活力的影响
2.2 CdCl2不同作用时间对小鼠肝细胞活力的影响
以40 μmol/L CdCl2分别处理BNL CL.2细胞0、3、6、12、18、24 h,然后采用CCK-8法测定各组细胞活力。结果如图2所示,40 μmol/L CdCl2作用BNL CL.2细胞6 h可显著抑制细胞活力(P<0.05),作用12 h后可极显著抑制细胞活力(P<0.01)。

图2 CdCl2作用不用时间对小鼠肝细胞活力的影响
2.3 HE染色
如图3所示,40 μmol/L CdCl2处理小鼠肝细胞3和6 h后,少量细胞出现空泡变性,处理12 h后,肝细胞空泡变性明显加重,细胞核固缩,部分细胞肿胀、死亡,上述病理变化在18和24 h处理组中更加明显。以上结果表明40 μmol/L CdCl2对小鼠肝细胞可造成严重的损伤作用,该损伤作用会随着处理时间延长而加剧。
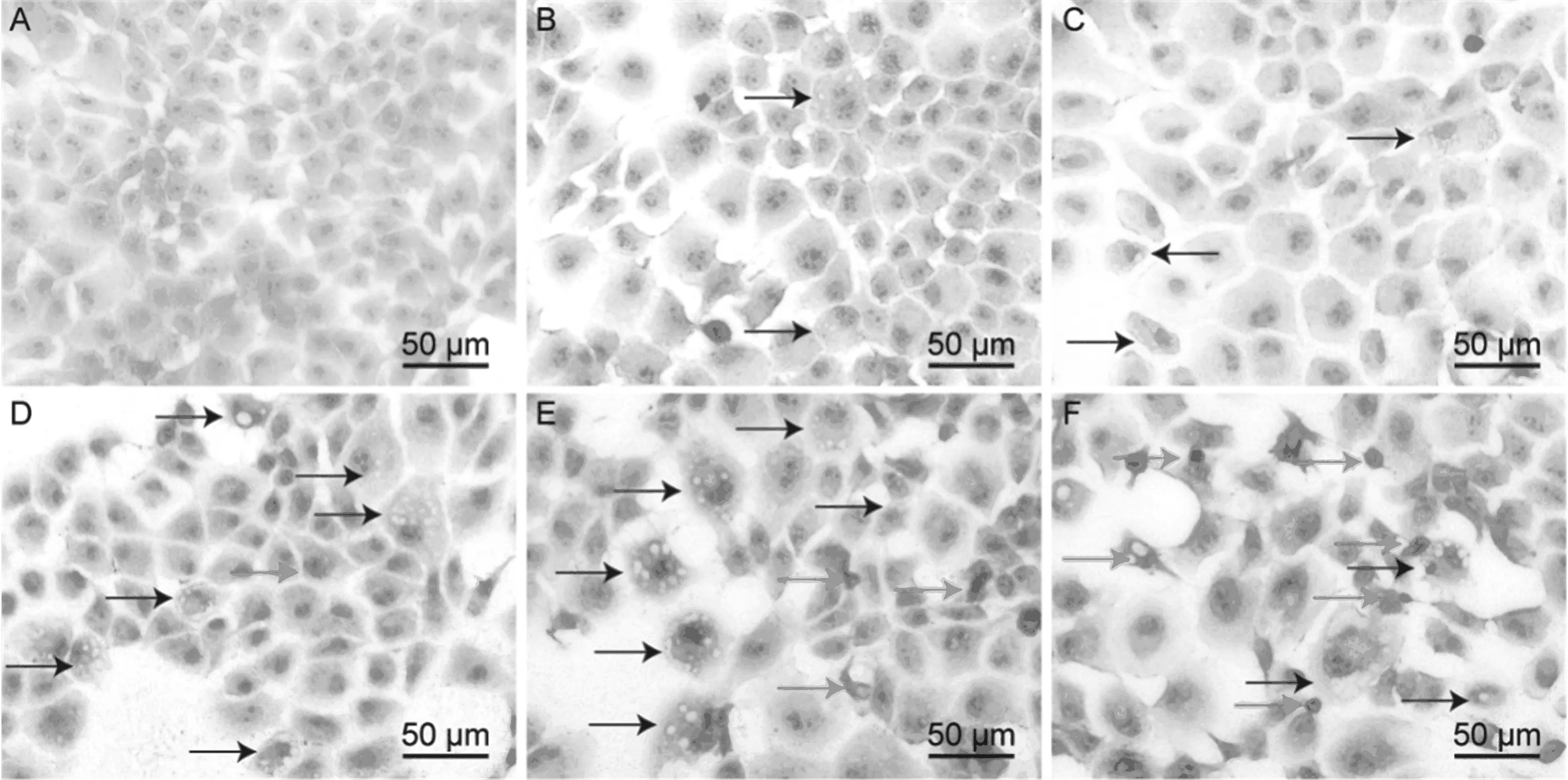
图3 HE染色法观察CdCl2对小鼠肝细胞的损伤作用
2.4 Hoechst 33342染色
40 μmol/L CdCl2分别处理BNL CL.2细胞0、3、6、12、18、24 h,然后用Hoechst 33342染液染色,倒置荧光显微镜观察各组细胞核的病理变化情况。结果如图4所示,与对照组相比,CdCl2作用3 h后逐渐开始出现细胞核浓缩、断裂等情况,随着作用时间的增加,细胞核浓缩、断裂的比例逐渐增加。
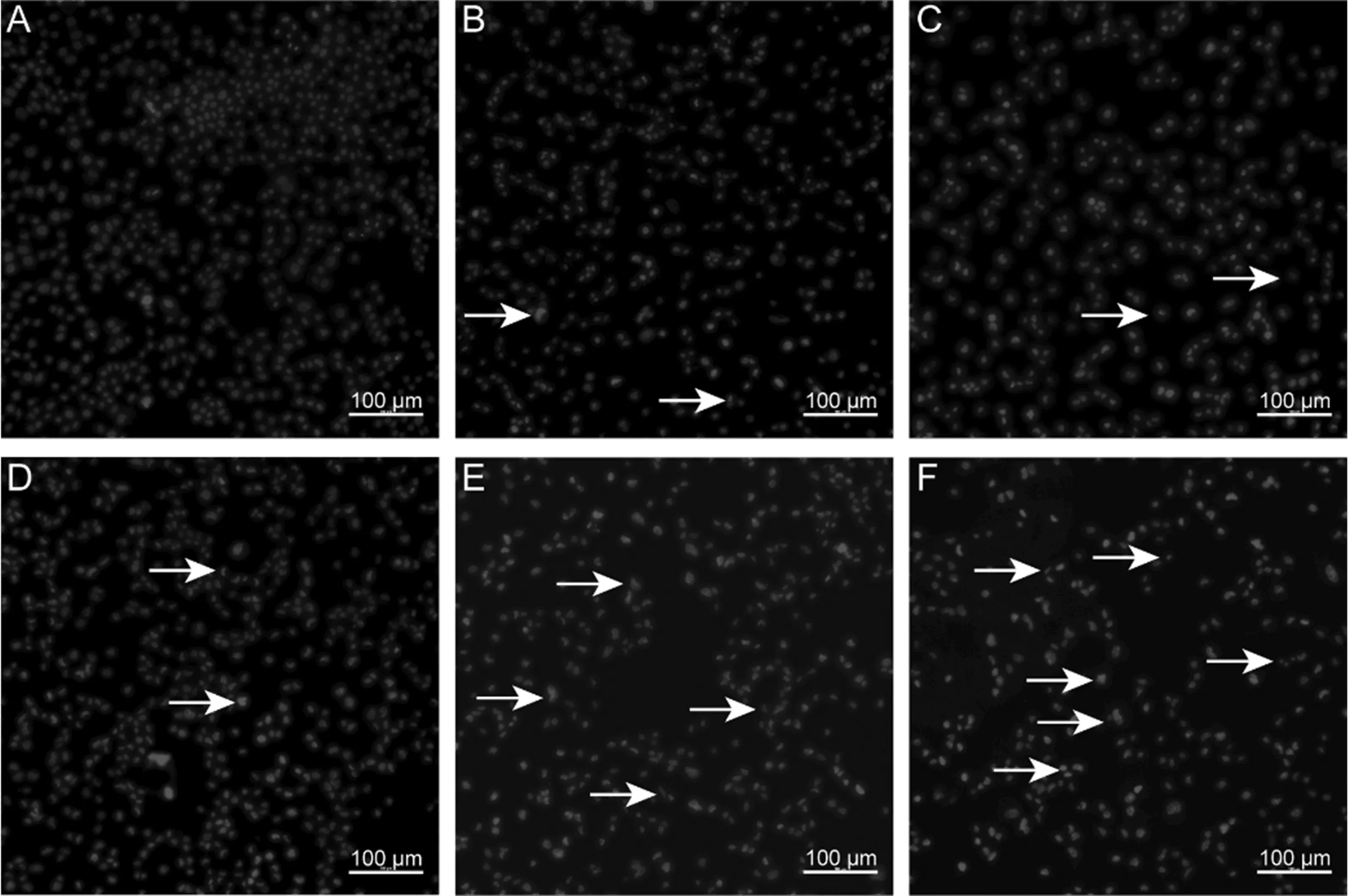
图4 Hoechst 33342染色结果
2.5 CdCl2对小鼠肝细胞SOD活力的影响
如图5所示,与空白对照组相比,40 μmol/L CdCl2作用于小鼠肝细胞6 h后,细胞SOD的活力极显著降低(P<0.01),随着作用时间延长,SOD活力进一步受到抑制,表明肝细胞抗氧化能力受到了一定的抑制作用。
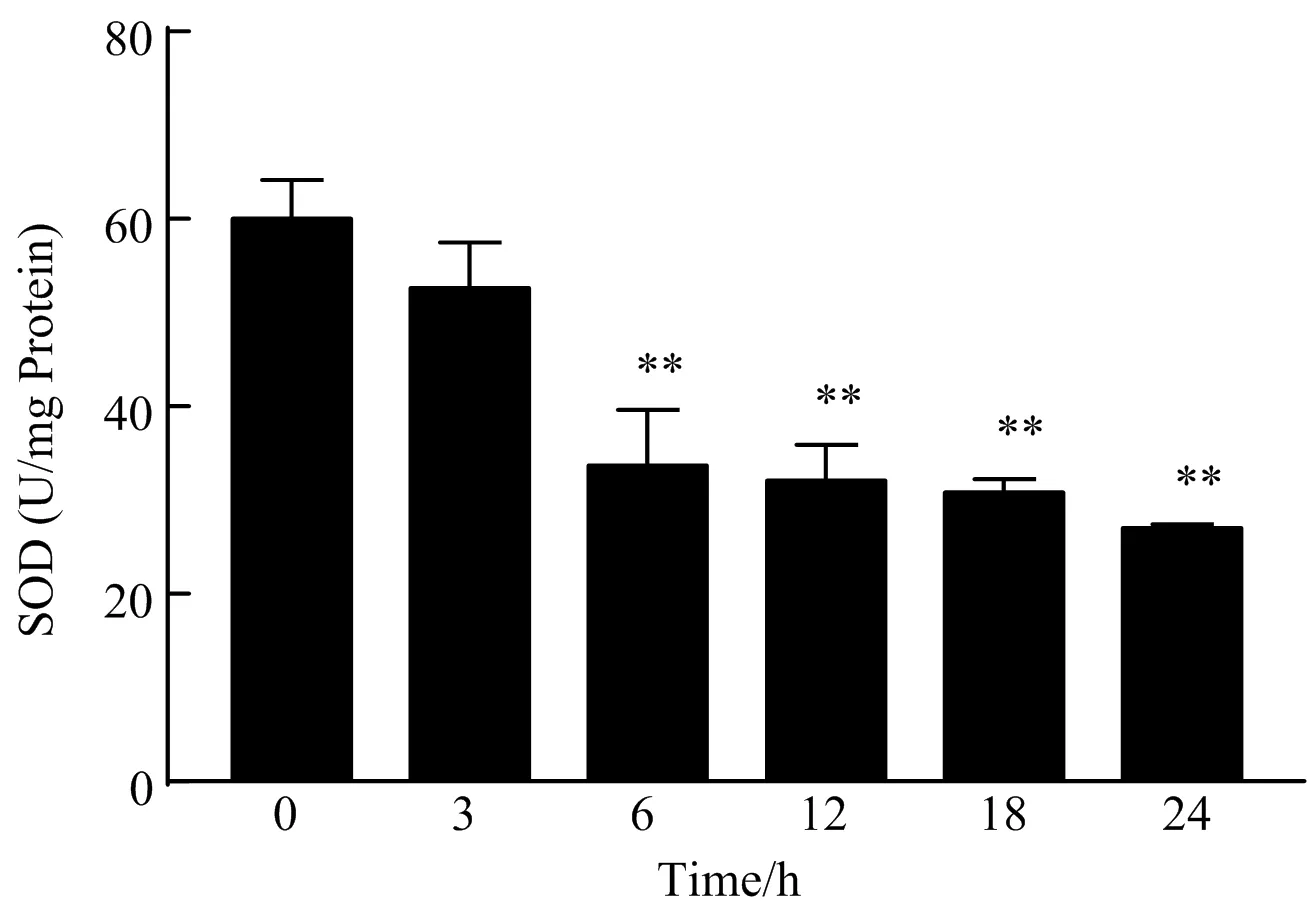
图5 CdCl2对小鼠肝细胞SOD活力的影响
2.6 CdCl2对小鼠肝细胞MDA含量的影响
与空白对照组相比,40 μmol/L CdCl2作用于小鼠肝细胞6 h后,细胞MDA含量极显著升高(P<0.01),但随着CdCl2作用时间延长,MDA含量逐渐降低,染毒18 h后,细胞内MDA含量与空白对照组差异不显著(P>0.05)。

图6 CdCl2对小鼠肝细胞MDA含量的影响
3 结论与讨论
镉作为常见的环境污染物,其诱导的肝损伤作用通常与氧化应激及其伴随的炎症反应密切相关。本研究结果显示,40 μmol/L CdCl2作用6 h即可导致BNL CL.2细胞活力显著下降(P<0.05),随着CdCl2作用时间延长,细胞活力进一步受到抑制。通过HE染色和Hoechst 33342染色发现,CdCl2作用6 h后,细胞形态即开始出现核浓缩、空泡变性等病理变化,当CdCl2作用时间进一步延长后,细胞空泡变性与核浓缩情况也随之加重,这提示40 μmol/L CdCl2作用6 h后即可造成BNL CL.2细胞损伤。同时,BNL CL.2细胞经40 μmol/L CdCl2处理6 h后,SOD活力即受到极显著抑制(P<0.01),随着作用时间延长,SOD受到进一步抑制。然而,MDA在CdCl2处理6 h后显著升高(P<0.01),但随着作用时间延长MDA含量逐渐恢复正常。
正常情况下,体内氧化与抗氧化系统常处于动态平衡之中,从而维持机体的新陈代谢[13]。当受到外来物质刺激后,机体氧化与抗氧化平衡可被打破,此时,生物膜内不饱和脂肪酸因受到自由基攻击而发生脂质过氧化损伤,其产物MDA具有明显的细胞毒性,可作为评价细胞氧化应激损伤的重要指标[14]。本研究中,CdCl2处理的BNL CL.2细胞MDA含量显著升高,表明镉可导致肝细胞膜脂质过氧化损伤,这与张文华等报道的结果一致[15],但在本研究中,当CdCl2作用18~24 h,MDA含量尽管依然高于空白对照组,但与空白对照组相比差异不显著(P>0.05),这可能与细胞中MDA含量相对较低,导致组内变异系数较大而导致组间差异不显著。SOD能够催化超氧阴离子发生歧化反应生成O2和H2O2,其中H2O2可经过氧化氢酶催化生成H2O,从而保护机体免受自由基的氧化损伤[16-17]。本研究发现,CdCl2处理BNL CL.2细胞6 h即可显著抑制SOD的活力,造成细胞氧化应激损伤,随着作用时间延长,SOD可被进一步抑制,这与本课题组前期体内试验结果一致[18]。研究表明,细胞发生氧化应激时,SOD活力会显著降低,而MDA含量则升高,细胞死亡率显著升高[19]。陈嘉兴等[20]研究发现,20 μmol/L镉作用48 h可致HEK细胞发生氧化应激损伤,细胞SOD的活性显著降低,同时MDA含量显著升高,这与本研究结果一致。
综上,本研究成功制备了镉诱导的肝细胞损伤体外模型,证实镉可诱导小鼠肝细胞发生氧化应激损伤,为深入探讨镉的肝细胞毒性提供了研究基础。

