寡糖对土壤微生物多样性及群落结构的调节作用*
钱远超,何久兴,孔 梦,宋吉青,斋藤信,吕国华**
寡糖对土壤微生物多样性及群落结构的调节作用*
钱远超1,何久兴1,孔 梦1,宋吉青1,斋藤信2,吕国华1**
(1.中国农业科学院农业环境与可持续发展研究所,北京 100081;2. 昭和电工株式会社,日本东京 105-8518)
土壤微生物种群类型,对土壤质量和作物生长具有重要影响,研究寡糖对土壤微生物种群的影响特征,有助于正确、高效及安全使用寡糖。本研究利用人工气候室进行土壤培养,土壤施加50mg·L−1的壳寡糖(CSOS)和纤维寡糖(COS)溶液,以清水(CK)为对照处理,培养6d后取样,利用高通量测序技术,分析土壤微生物群落结构组成及多样性分布特征。结果表明:壳寡糖(CSOS)和纤维寡糖(COS)处理均显著改变细菌、真菌的群落结构,提高细菌的物种观测数。变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)和拟杆菌门(Bacteroidetes)为优势细菌门,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和被孢霉门(Mortierellomycota)为优势真菌门。通过组间群落组成比较分析可知,壳寡糖(CSOS)和纤维寡糖(COS)处理均不同程度降低酸杆菌门(Acidobacteria)的相对丰度,增加变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、壶菌门(Chytridiomycota)以及有益菌属溶杆菌属()、硝化螺旋菌属()、、芽球菌属()和链霉菌属()的相对丰度,但与纤维寡糖(COS)相比,壳寡糖(CSOS)处理微生物群落组成的变化幅度更大。此外,壳寡糖(CSOS)和纤维寡糖(COS)处理在调节土壤微生物群落结构上存在一定差异。其中,壳寡糖(CSOS)处理有益菌属的相对丰度增加195%,纤维寡糖(COS)处理有益菌属假单胞菌属()的相对丰度增加215%。综上,壳寡糖和纤维寡糖处理均能优化土壤微生物群落的结构组成,其调控差异性有助于理解不同寡糖的调控机制,推动寡糖的应用与推广。
壳寡糖;纤维寡糖;高通量测序;细菌群落结构;真菌群落结构
土壤微生物丰度高、种类多、代谢快,是土壤生态系统中重要的组成部分[1−2],在防治作物土传病害、调节养分循环和稳定生态系统等方面发挥着十分重要的作用[3−5]。由于不合理施肥用药引起的土壤酸化、板结等诸多问题,不仅改变土壤微环境,破坏土壤生态系统平衡,严重威胁农业可持续绿色发展。
寡糖作为一种生物刺激素,不仅对生态环境无害,而且能调控作物生长发育,改善土壤质量[6−8],对减少化肥农药用量具有重要作用。其中,在植物生产中使用较为普遍的壳寡糖,不仅能够促进作物生长[9−10],提升作物品质[11],还能增强作物的抗逆能力[12]。研究发现,壳寡糖可以诱导植物产生抗病信号分子,能促进抗病相关酶大量合成,增强植物抗病性[13]。来源于农业废弃物如秸秆、甘蔗渣和苜蓿残渣的纤维寡糖具有较高环境效益和经济效益,多应用于食品、饲料添加剂和生物农药等领域[14]。在食品添加方面,纤维寡糖能促进人体益生菌增值,调节肠道菌群平衡,提高机体免疫机能[15]。在饲料添加方面,因纤维寡糖含有一种优良的双歧杆菌促生物质(双歧因子),能作为双歧杆菌等有益菌群的生长底物并促进其增殖生长[16]。此外,纤维寡糖作为生物农药,能有效诱导植保素的合成与积累,对植物的抗病抗逆、分子信号调控以及生长发育等有着重要意义[17−18]。
目前,有关壳寡糖的农业研究多数集中于作物生长、品质改善以及防病抗逆等方面,而纤维寡糖更多应用在食品和饲料添加方面,有关壳寡糖和纤维寡糖对土壤微生物群落结构的调控作用尚不明确。因此,本研究利用Illumina Miseq高通量测序技术,对土壤微生物多样性和群落结构组成进行系统分析,探讨土壤微生物群落结构差异,进一步揭示壳寡糖和纤维寡糖对土壤微生物多样性及群落结构的调控差异,为寡糖的农业应用提供土壤微生物学方面的理论参考。
1 材料与方法
1.1 供试土壤与材料
供试土壤取自北京市顺义区农业环境综合实验基地0−20cm耕层土壤,该地区属于暖温带半湿润大陆性季风性气候,土壤类型为砂质壤土,pH值7.58,有机质25.86g·kg−1,总可溶性氮含量为13.85mg·kg−1,速效磷含量为21.31mg·kg−1,速效钾含量为127.02mg·kg−1。壳寡糖聚合度分布在3~7,平均分子量为1159;纤维寡糖的聚合度在2~6,平均分子量为827,根据前期实验结果两种寡糖浓度采用50mg·L−1。
1.2 实验设计
实验在人工气候室内进行,设置光照为12h·d−1,温度25℃,相对湿度60%。分别称取过2mm筛的风干土500g,分层、多次装入培养盒,培养盒尺寸为底径12cm、口径16cm、高17cm。灌水调节土壤水分至田间持水量的70%左右,用保鲜膜封口,并在保鲜膜上留若干小孔。人工气候室中培养一周,期间称重补水,以保持土壤水分含量相对稳定。设置壳寡糖(CSOS)、纤维寡糖(COS)和清水对照(CK)三个处理,每个处理设置3个重复,培养一周后,分别加入50mg·L−1的壳寡糖和纤维寡糖溶液800mL,至土壤水分达到饱和,自由排水至田间持水量,对照补充相对应的去离子水。培养6d后,采集土样进行测定。
1.3 土壤微生物DNA提取及测序
将土壤样品送到北京某公司提取土壤总DNA并进行后续分析,土壤微生物组DNA提取方法参照Power Soil DNA Isolation Kit (MoBio Laboratories, Carlsbad, CA)试剂盒说明书。提取得到的DNA用1%琼脂糖凝胶电泳和分光光度法进行DNA质量和浓度检测。质检合格的样本储存在−20℃以供使用。细菌16S rRNA基因V3-V4区的扩增采用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3'),真菌ITS基因测序引物为ITS1F(5'-CTTGGTCATTTAGAGG AAGTAA-3')和ITS2(5'-TGCGTTCTTCATCGATG C-3')[19]。合成带有条形码序列的上述引物进行PCR扩增。PCR产物使用1%琼脂糖凝胶电泳检测扩增目的条带大小,并用Agencourt AMPure XP核酸纯化试剂盒纯化。PCR产物用于构建微生物多样性测序文库,基于Illumina Miseq高通量测序平台进行Paired-end测序。
1.4 测序数据的分析方法
为了使信息分析的结构更加准确可靠,下机数据经过QIIME1(v1.8.0)软件根据Barcode序列拆分样本,使用Pear(v0.9.6)软件对数据进行过滤、拼接,并根据Gold Database数据库用Uchime方法比对去除嵌合体序列。最后使用Vsearch(v2.7.1)软件UPARSE算法对优质序列按照97%的一致性进行OTU聚类,并采用Silva128数据库使用RDP Classifier算法对OTUs进行注释[20]。
1.5 统计分析方法
采用Microsoft Excel 2016分析数据并制作表格,柱状图在Origin中进行绘制。采用SPSS19.0对微生物多样性指数进行单因素方差分析(ANOVA),P<0.05说明处理间差异显著。使用Mothur (version v.1.30)软件,对样品α多样性指数进行计算和评估[21],微生物群落α多样性采用Chao1、Observed species、Shannon和PD whole tree指数表征。使用QIIME1(v1.8.0)计算β多样性距离矩阵,基于OTU偏最小二乘法判别分析(PLS-DA分析)微生物群落结构[22]。
2 结果与分析
2.1 寡糖对土壤细菌多样性及群落结构的影响
2.1.1 对土壤细菌α多样性的影响
α多样性指数中的Chao1指数和Observed species(观测物种数)用以估算群落中的OTU数目,即菌种丰富度指数,而Shannon和PD whole tree是估算样品中微生物多样性的指数,Coverage指数是样品文库的覆盖率,其数值越高,说明测序结果越接近代表样本的真实情况。由表1可见,各样本Coverage指数均达到98%以上,说明测序数据量合理,足以代表样本中微生物的真实情况。表中各项指数对比显示,与CK相比,CSOS(壳寡糖)和COS(纤维寡糖)处理的土壤中,观测物种数量显著增加,分别比CK高出82和51个OTU单位,虽然两种寡糖处理间差异不显著,但也说明该两种寡糖处理对土壤中菌种丰富度指数有一定影响。从微生物多样性指数看,两种寡糖处理对Shannon指数的影响略有差异,CSOS处理的Shannon指数显著高于CK和COS处理,而COS处理与CK差异不显著;各处理间细菌谱系多样性指数差异不显著,说明土壤中施加壳寡糖能显著提高细菌观测物种数量和Shannon指数,施加纤维寡糖显著提高细菌观测物种数量,但施加该两种寡糖对Chao1指数和谱系多样性均无显著影响。
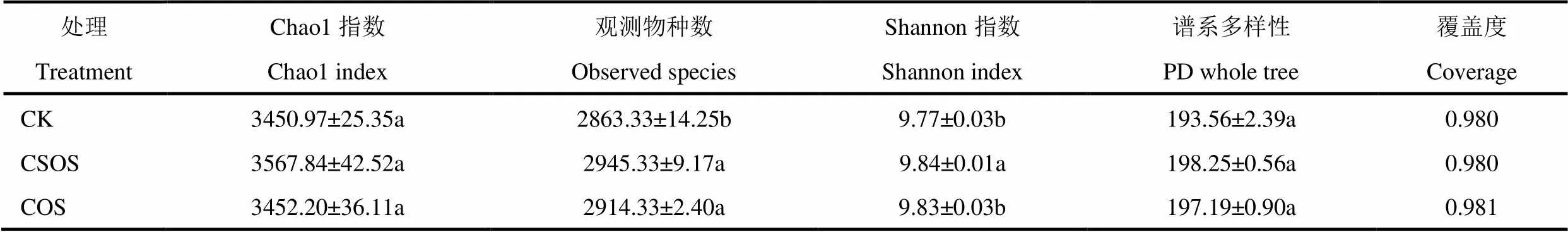
表1 不同处理土壤细菌α多样性指数评估结果
注:培养一周后的土壤,每盒分别灌施清水(CK)、50mg·L−1壳寡糖(CSOS)和纤维寡糖(COS)溶液800mL至土壤水分达到饱和,并覆盖带有若干小孔的保鲜膜,培养6d后取样。同一列小写字母表示处理间在0.05水平上的差异显著性,表中数据为平均值±标准误。下同。
Note:After one week cultivation, each box is respectively filled with clean water (CK), 50mg·L−1chitosan oligosaccharide (CSOS) and cello-oligosaccharide (COS) solution by 800mL until the soil moisture reaches saturation, covered with fresh-keeping film with several small holes, and sampled after six days. The different lowercase letters in the same column represent significant difference at 0.05 level. The data is means ± SD. The same as below.
2.1.2 对土壤细菌群落组成的影响
由图1可见,两种寡糖处理下,土壤中的优势菌门为变形菌门(Proteobacteria, 26.96%~31.03%)、酸杆菌门(Acidobacteria, 14.85%~22.97%)、放线菌门(Actinobacteria, 14.28%~16.71%)、绿弯菌门(Chloroflexi, 7.31%~8.20%)、芽单胞菌门(Gemmatimonadetes, 7.97%~9.50%)和拟杆菌门(Bacteroidetes, 6.84%~7.27%),占总体群落的86%以上。两种寡糖处理明显改变了土壤细菌群落组成,另外,在所有处理样品中还检测到了很多相对丰度较低的细菌,如粘球菌门(Myxococcota, 2.86%~3.57%)、厚壁菌门(Firmicutes, 1.43%~1.56%)、疣微菌门(Verrucomicrobia, 1.13%~1.36%)、浮霉菌门(Planctomycetes, 1.02%~1.21%)、Bdellovibrionota(1.07%~1.38%)和硝化螺旋菌门(Nitrospirota, 0.90%~1.18%)。与CK相比,两种寡糖处理对细菌在门水平上的群落组成略有影响,壳寡糖(CSOS)和纤维寡糖(COS)处理后,酸杆菌门(Acidobacteria)的相对丰度分别降低35%和16%,壳寡糖(CSOS)处理变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和芽单胞菌门(Gemmatimonadetes)的相对丰度分别增加15%、17%和19%,纤维寡糖(COS)处理变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和芽单胞菌门(Gemmatimonadetes)的相对丰度分别增加8%、7%和7%。

图1 不同土壤样品门水平细菌群落相对丰度的比较
由图2可知,在属水平上,相对丰度>1.5%的优势属为鞘氨醇单胞菌(, 3.83%~4.47%)、RB41(2.14%~3.38%)、MND1(2.67%~3.61%)和马赛菌属(, 1.71%~1.97%)。在相对丰度>0.5%的前29个属中,与CK相比,施加CSOS后有19个属相对丰度增加,10个属的相对丰度降低,其中,相对丰度明显增加的有9个属,如MND1(35%)、溶杆菌属(,25%)、硝化螺旋菌属(,24%)、放线菌属()(29%)、芽单胞菌属(,24%)、YC-ZSS-LKJ147(37%)、赭黄嗜盐囊菌属(,46%)、芽球菌属(,57%)和链霉菌属(,31%)。与CK相比,COS处理有16个属相对丰度增加,13个属的相对丰度降低,其中,MND1、YC-ZSS-LKJ147、芽球菌属()和假单胞菌属()的相对丰度分别增加18%、36%、30%和215%。

图2 不同土壤样品属水平细菌群落相对丰度的比较
2.1.3 不同土壤样品土壤细菌群落结构变化
基于OTU偏最小二乘法判别分析(PLS-DA分析)进行统计分析,由图3可知,细菌第一、二主成分的方差贡献率分别为17.42%和12.21%,同一样品点分布距离接近,不同样品有明显的分离现象。说明CSOS和COS处理改变了土壤细菌群落结构分布,且CSOS和COS处理变化也具有明显差异。

图3 基于OTU的偏最小二乘法判别分析
2.2 寡糖对土壤真菌多样性及群落结构的影响
2.2.1 对土壤真菌α多样性的影响
由表2可知,各样本Coverage指数均达到99%以上,说明测序数据量合理,足以代表样本中微生物的真实情况。表中各项指数对比显示,处理间的真菌α多样性指数差异均不显著。
2.2.2 对土壤真菌群落组成的影响
除unidentified外,各处理共检测得到11个真菌门,由图4可知,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和被孢霉门(Mortierellomycota)为所测土壤中的优势真菌门,子囊菌门相对丰度最高,占比达60%以上,其次是担子菌门(Basidiomycota, 8.19%~10.24%)和被孢霉门(Mortierellomycota, 4.65%~5.65%),而壶菌门(Chytridiomycota, 0.35%~1.34%)相对丰度占比较少。在相对丰度>1%的真菌门中,与CK相比,壳寡糖(CSOS)和纤维寡糖(COS)处理壶菌门的相对丰度分别增加了288%和174%。
由图5可知,在属水平上,相对丰度>1.5%的优势真菌属为毛壳属(, 9.56%~10.40%)、(6.54%~8.79%)、被孢霉属(, 4.65%~5.65%)、镰孢菌属(, 3.24%~3.86%)、黄丝曲霉属(, 3.80%~11.20%)、葡萄穗霉属(, 2.90%~3.37%)、粉红粘帚霉属(, 2.30%~2.92%)。在相对丰度>0.5%的前20个属中,与CK相比,施加CSOS处理相对丰度增加的有6个属,降低的属有14个,其中,黄丝曲霉属()的相对丰度变化明显,其相对丰度增加了195%。施加COS处理有10个属相对丰度表现为增加,有10个属相对丰度表现为降低,但变化均不明显。
2.2.3 不同土壤样品真菌群落结构分析
进一步基于OTU偏最小二乘法判别分析(PLS-DA分析)进行统计分析,由图6可知,细菌第一、二主成分的方差贡献率分别为14.93%和12.20%,同一样品点分布距离接近,不同样品有明显的分离现象。说明CSOS和COS处理显著改变了土壤真菌群落结构分布,且CSOS和COS处理变化也具有明显差异。

表2 不同处理土壤真菌α多样性指数评估结果
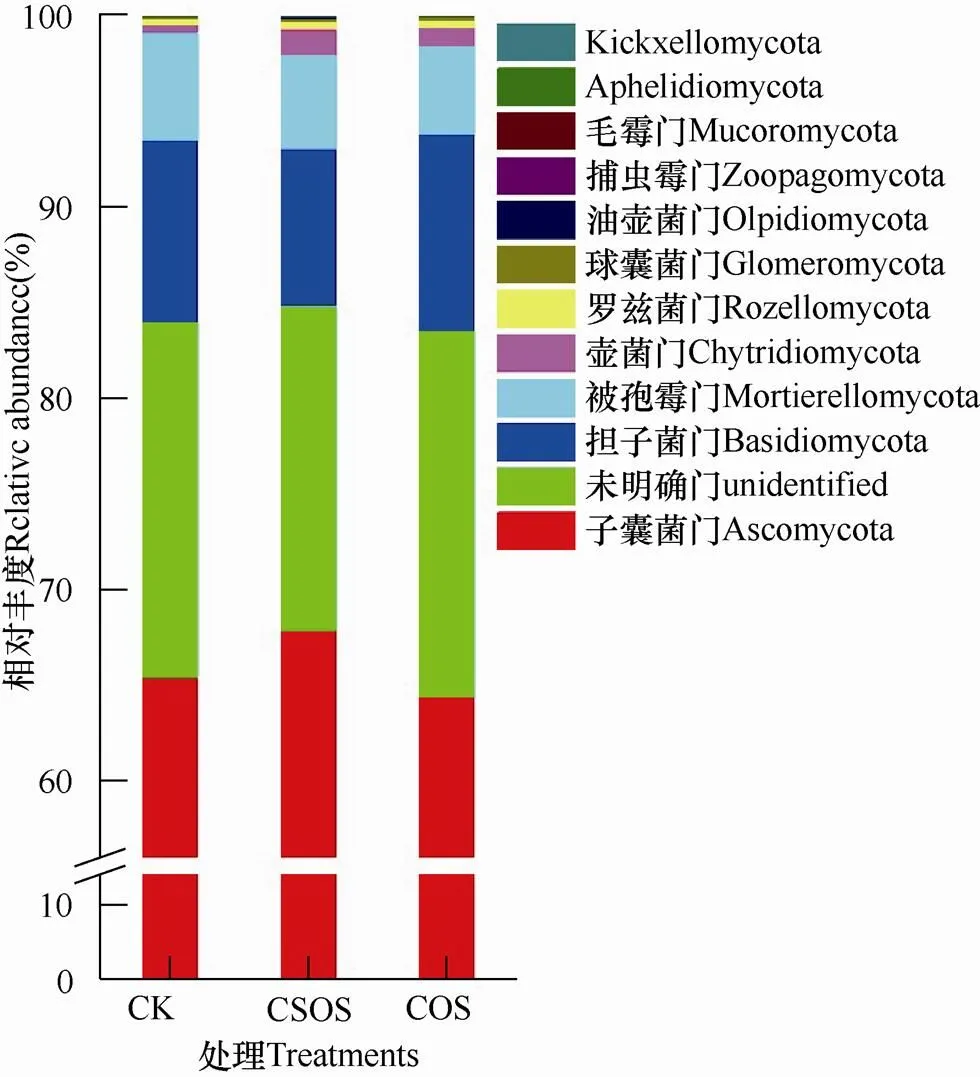
图4 不同土壤样品中门水平真菌群落相对丰度的比较

图5 不同土壤样品中属水平真菌群落相对丰度的比较

图6 基于OTU的偏最小二乘法判别分析
3 结论与讨论
3.1 讨论
糖类物质通过提供丰富的碳源,为微生物提供能量,从而改善土壤微生态环境,促进微生物生长和繁殖[23]。本研究发现壳寡糖(CSOS)和纤维寡糖(COS)处理显著增加细菌丰富度指数,即物种观测数,壳寡糖(CSOS)和纤维寡糖(COS)处理均能显著改变细菌和真菌的群落结构。这表明两种寡糖不但能提高细菌的丰富度,而且还在调控土壤微生物群落组成上均发挥着重要作用。
本研究发现,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)是本研究中相对丰度最高的三个菌门,这与前人研究结果基本一致,即变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)是不同农业系统或其他土壤类型中最为常见的门类[24]。变形菌门(Proteobacteria)和放线菌门(Actinobacteria)偏好于营养丰富的环境,富碳环境可刺激其快速增长,有助于土壤营养物质的积累,从而促进富营养型细菌的生长,而酸杆菌门(Acidobacteria)是贫营养型菌群[25−26],能在含有难降解碳的环境中生长,降解植物残体多聚物。在本研究中两种寡糖处理均一定程度降低了酸杆菌门(Acidobacteria)的相对丰度,提高了变形菌(Proteobacteria)、放线菌门(Actinobacteria)和芽单胞菌门(Gemmatimonadetes)的相对丰度,但是,与纤维寡糖(COS)相比,壳寡糖(CSOS)处理改变细菌群落组成的幅度更大。同样也有研究发现放线菌门(Actinobacteria)在土壤碳氮循环中具有重要作用[27],还能产生抗逆性较强的孢子,同时具有解磷、解钾等功能[28−30],还有研究发现,随着土壤环境中碳含量的增加,芽单胞菌门(Gemmatimonadetes)的相对丰度也增加[31]。在属水平上,鞘氨醇单胞菌()是三种处理中相对丰度最高的优势属,与本研究结果一致,有研究发现鞘氨醇单胞菌()是黄土高原雨养农业生态系统上的优势细菌属[32]。本研究结果显示,与CK相比,壳寡糖(CSOS)处理能明显增加MND1、溶杆菌属()、硝化螺旋菌属()、放线菌属()、芽单胞菌属()、YC-ZSS-LKJ147、赭黄嗜盐囊菌属()、芽球菌属()和链霉菌属()的相对丰度,纤维寡糖(COS)处理后假单胞菌属()的相对丰度增加了215%。有研究指出,溶杆菌属()和芽球菌属()在促进植物生长、抵御不良环境、防治土壤病害等方面发挥着重要作用[33−35]。硝化螺旋菌属()能促进营养元素吸收转化,增加土壤肥力[36]。赭黄嗜盐囊菌属()和链霉菌属()在磷的吸收转化中具有重要作用[37−38]。假单胞菌属是高效的病害抑制性微生物,可以有效抑制镰孢菌的生长[39]。可知,壳寡糖(CSOS)处理能促进多种利于土壤营养物质积累的有益菌群生长,纤维寡糖(COS)处理主要表现为抑制有害菌属。
子囊菌(Ascomycota)和担子菌(Basidiomycota)作为土壤中主要的分解者,对分解植物残体和降解秸秆残留物具有重要作用[40−41],本研究也发现真菌群落以子囊菌门(Ascomycota)和担子菌门(Basidiomycota)为主,占真菌总体的70%以上。此外,两种寡糖均明显增加壶菌门(Chytridiomycota)的相对丰度。在属水平上,壳寡糖(CSOS)处理明显增加有益菌属的相对丰度。作为解磷微生物,其相对丰度增加能显著提高土壤有效磷的供给[42]。以上结果表明,两种寡糖处理都有利于改善土壤功能,但在优化土壤微生物类群上具有一定的差异。
3.2 结论
施加50mg·L−1壳寡糖(CSOS)和纤维寡糖(COS)溶液的土壤,于人工气候室培养6d后,两种寡糖处理均显著改变了土壤细菌和真菌的群落结构,提高了细菌的丰富度(物种观测数)。其中,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)和拟杆菌门(Bacteroidetes)为土壤优势细菌门。子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和被孢霉门(Mortierellomycota)为优势真菌门。
两种寡糖处理均不同程度降低了土壤酸杆菌门(Acidobacteria)的相对丰度,增加了土壤变形菌(Proteobacteria)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、壶菌门(Chytridiomycota)以及有益菌属溶杆菌属()、硝化螺旋菌属()、赭黄嗜盐囊菌属()、芽球菌属()和链霉菌属()的相对丰度,但是,与纤维寡糖(COS)相比,壳寡糖(CSOS)处理微生物群落组成的变化幅度更大。壳寡糖(CSOS)处理显著增加有益菌属Talaromyces的相对丰度(195%),纤维寡糖(COS)处理则明显增加假单胞菌属()的相对丰度(215%)。综上,两种寡糖均能增加有益土壤微生物,而其调控差别对于优化土壤功能存在一定差异,其中壳寡糖(CSOS)处理能促进多种利于土壤营养物质积累的有益菌群生长,纤维寡糖(COS)处理主要表现为抑制有害菌属。
[1] Gans J,Wolinsky M,Dunbar J.Computational improvements reveal great bacterial diversity and high metal toxicity in soil[J].Science,2005,309(5739):1387-1390.
[2] Wang J,Liu G B,Zhang C,et al.Higher temporal turnover of soil fungi than bacteria during long-term secondary succession in a semiarid abandoned farmland[J].Soil and Tillage Research,2019,194:104305.
[3] Sindhu S S,Gupta S K,Dadarwal K R.Antagonistic effect ofspp. on pathogenic fungi and enhancement of growth of green gram()[J].Biology and Fertility of Soils,1999,29(1):62-68.
[4] 李岩,杨晓东,秦璐,等.两种盐生植物根际土壤细菌多样性和群落结构[J].生态学报,2018,38(9):3118-3131.
Li Y,Yang X D,Qin L,et al.The bacterial diversity and community structures in rhizosphere soil of two halophytes,and[J].Acta Ecologica Sinica,2018,38(9):3118-3131.(in Chinese)
[5] Wardle D A,Bardgett R D,Klironomos J N,et al.Ecological linkages between aboveground and belowground biota[J]. Science,2004,304(5677):1629-1633.
[6] Aftab T,Khan M M A,Naeem M,et al.Effect of irradiated sodium alginate and phosphorus on biomass and artemisinin production in Artemisia annua[J].Carbohydrate Polymers, 2014,110:396-404.
[7] 何久兴,赵解春,白文波,等.叶面喷施寡糖对生菜生长和品质的调节作用[J].中国农业气象,2019,40(12):783-792.
He J X,Zhao J C,Bai W B,et al.Effect of different oligosaccharides by spraying on plant growth and quality in lettuce[J].Chinese Journal of Agrometeorology,2019, 40(12):783-792.(in Chinese)
[8] Yang W J,Chen D Y,He Z C,et al.NMR characterization and anticoagulant activity of the oligosaccharides from the fucosylated glycosaminoglycan isolated from Holothuria coluber[J].Carbohydrate Polymers,2020,233: 115844.
[9] He J X,Han W,Wang J,et al.Functions of oligosaccharides in improving tomato seeding growth and chilling resistance[J].Journal of Plant Growth Regulation,2021(1): 1-11.
[10] 罗晓峰,代宇佳,宋艳,等.三种植物生长调节剂对大豆生长发育及产量的影响[J].核农学报,2021,35(4):980-988.
Luo X F,Dai Y J,Song Y,et al.Effects of three plant growth regulators on growth and yield of soybean[J].Journal of Nuclear Agricultural Sciences,2021,35(4):980-988.(in Chinese)
[11] 张运红,吴礼树,耿明建,等.几种寡糖类物质对菜心产量和品质的影响[J].华中农业大学学报,2009,28(2):164-168.
Zhang Y H,Wu L S,Geng M J,et al.Effects of several oligosaccharides on the yield and quality of[J].Journal of Huazhong Agricultural University, 2009,28(2):164-168.(in Chinese)
[12] Wang M,Chen Y,Zhang R,et al.Effects of chitosan oligosaccharides on the yield components and production quality of different wheat cultivars(L.) in Northwest China[J].Field Crops Research,2015,172: 11-20.
[13] Yin H,Zhao X M,Du Y G.Oligochitosan:a plant diseases vaccine-a review[J].Carbohydr Polym,2010,82(1):1-8.
[14] 刘程程.β-葡聚糖酶水解紫花苜蓿制备纤维寡糖的研究[D].北京:中国农业科学院,2011.
Liu C C.Enzymatic Hydrolysis Cello-oligosaccharide ofby β-glucanase[D].Beijing: Chinese Academy of Agricultural Sciences,2011.(in Chinese)
[15] Sadako N,Tsuneyuki O,Makoto I.Bioavailability of cellobiose by tolerance test and breath hydrogen excretion in humans[J].Nutrition,2004,20(11):979-983.
[16] Cheikhyoussef A,Pogori N,Chen W,et al.Antimicrobial proteinaceous compounds obtained from bifidobacteria: from production to their application[J].International Journal of Food Microbiology,2008,125(3):215-222.
[17] Shibuya N,Minami E.Oligosaccharide signalling for defence responses in plant[J].Physiological and Molecular Plant Pathology,2001,59(5):223-233.
[18] 邱驰,李宝聚,范海延,等.几种葡聚寡糖激发子及其衍生物生物活性的比较[J].植物病理学报,2004(4):336-339.
Qiu C,Li B J,Fan H Y,et al.Compare of biological activity of kinds of gluco-oligosaccharides and their derivants[J]. Acta Phytopathologica Sinica,2004(4):336-339.(in Chinese)
[19] Miao L,Wang S,Li B,et al.Effect of carbon source type on intracellular stored polymers during endogenous denitritation(ED) treating landfill leachate[J].Water Research,2016,100:405-412.
[20] Edgar Robert C.UPARSE:highly accurate OTU sequences from microbial amplicon reads[J].Nature Methods,2013, 10(10):996-998.
[21] Wang Y,Sheng H F,He Y,et al.Comparison of the levels of bacterial diversity in freshwater,intertidal wetland,and marine sediments by using millions of illumina tags[J]. Applied and Environmental Microbiology,2012,78(23): 8264-8271.
[22] Jiang X T,Peng X,Deng G H,et al.Illumina sequencing of 16S rRNA tag revealed spatial variations of bacterial communities in a mangrove wetland[J].Microbial Ecology, 2013,66(1):96-104.
[23] Li X W,Chen Q X,Lei H Q,et al.Nutrient uptake and utilization by fragrant rosewood () seedlings cultured with oligosaccharide addition under different lighting spectra[J].Forests,2018,9(1):29-43.
[24] Nacke H,Thürmer A,Wollherr A,et al.Pyrosequencing- based assessment of bacterial community structure along different management types in german forest and grassland soils[J].PLOS ONE,2017,6(2):e17000.
[25] Sul W J,Asuming-Brempong S,Wang Q,et al.Tropicalagricultural land management influences on soil microbial communities through its effect on soil organic carbon[J].Soil Biology and Biochemistry,2013,65(5):33-38.
[26] Morris S A,Radajewski S,Willison T W,et al.Identification of the functionally active methanotroph population in a peat soil microcosm by stable-isotope probing[J].Applied and Environmental Microbiology,2002,68(3):1446-1453
[27] Zeng Q C,Dong Y H,An S S.Bacterial community responses to soils along a latitudinal and vegetation gradient on the loess plateau,China[J].PLoS ONE,2016, 11(4):e0152894.
[28] Hamdali H,Hafidi M,Virolle M J,et al.Growth promotion and protection against damping-off of wheat by two rock phosphate solubilizing actinomycetes in a P-deficient soil under greenhouse conditions[J].Applied Soil Ecology, 2008,40(3):510-517.
[29] Hamdali H,Bouizgarne B,Hafidi M,et al.Screening for rock phosphate solubilizing Actinomycetes from Moroccan phosphate mines[J].Applied Soil Ecology,2008,38:12-19.
[30] Hamdali H,Hafidi M,Virolle M J,et al.Rock phosphate solubilizing Actinomycetes:screening for plant growth promoting activities[J].World Journal of Microbiology& Biotechnology,2008,24(11):2565-2575.
[31] Bhatti A A,Haq S,Bhat R A.Actinomycetes benefaction role in soil and plant health[J].Microbial Pathogenesis, 2017,111(111):458-467.
[32] Sun Lei,Li Jun,Wang Qian,et al.The effects of eight years of conservation tillage on the soil physicochemical properties and bacterial communities in a rain-fed agroecosystem of the Loess Plateau,China[J].Land Degradation and Development,2020,31(16):2475-2489.
[33] Jochum C C,Osborne L E,Yuen G Y.Fusarium head blight biological control with Lysobacter enzymogenes strain C3[J].Biological Control,2006,39(3):336-344.
[34] Ko H S,Jin R D,Krishnan H B,et al.Biocontrol ability ofHS124 against phytophthora blight is mediated by the production of 4-hydroxyphenylacetic acid and several lytic enzymes[J].Current Microbiology, 2009,59(6):608-615.
[35] 孙红敏,余利岩,张玉琴.地嗜皮菌科放线菌的研究进展[J].微生物学报,2015,55(12):1521-1529.
Sun H M,Yu L Y,Zhang Y Q.Recent advance in Geodermatophilaceae:a review[J].Acta Microbiologica Sinica,2015,55(12):1521-1529.(in Chinese)
[36] 朱琳,曾椿淋,李雨青,等.基于高通量测序的大豆连作土壤细菌群落多样性分析[J].大豆科学,2017,36(3):419-424.
Zhu L,Zeng C L,Li Y Q,et al.The characteristic of bacterial community diversity in soybean field withcontinuous cropping based on the high-throughput sequencing[J]. Soybean Science,2017,36(3):419-424.(in Chinese)
[37] 秦利均,杨永柱,杨星勇.土壤溶磷微生物溶磷、解磷机制研究进展[J].生命科学研究,2019,23(1):59-64.
Qin L J,Yang Y Z,Yang X Y,et al.Advances in mechanisms of soil phosphorus solubilization and dissolution by phosphate solubilizing microorganisms[J]. Life Science Research, 2019,23(1):59-64.(in Chinese)
[38] Qiu M H,Zhang R F,Xue C,et al.Application of bio-organic fertilizer can control Fusarium wilt of cucumber plants by regulating microbial community of rhizosphere soil[J]. Biology and Fertility of Soils,2012,48(7):807-816.
[39] Schippers B.Exploitation of microbial mechanisms to promote plant health and plant growth[J].Phytoparasitica, 1993,21(4):275-279.
[40] Yelle D J,Ralph J,Lu F C,et al.Evidence for cleavage of lignin by a brown rot basidiomycete[J].Environmental Microbiology,2008,10(7):1844-1849.
[41] 武俊男,刘昱辛,周雪,等.基于Illumina MiSeq测序平台分析长期不同施肥处理对黑土真菌群落的影响[J].微生物学报,2018,58(9):1658-1671.
Wu J N,Liu Y X,Zhou X,et al.Effects of long-term different fertilization on soil fungal communities in black soil based on the Illumina Mi Seq platform[J].Acta Microbiologica Sinica,2018,58(9):1658-1671.(in Chinese)
[42] 吴安琪,张扬,万松泽,等.一株金黄蓝状菌解磷特性及其对毛竹的促生效应[J].应用生态学报,2019,30(1):173-179.
Wu A Q,Zhang Y,Wan S Z,et al.Phosphate solubilizing characteristics of Talaromyces aurantiacus and its growth-promoting effect on Phyllostachys edulis seedlings [J].Chinese Journal of Applied Ecology,2019,30(1):173- 179.(in Chinese)
钱远超,何久兴,孔梦,等.寡糖对土壤微生物多样性及群落结构的调节作用[J].中国农业气象,2022,43(6):464-473
Regulation of Oligosaccharides on Soil Microbial Diversity and Community Structure
QIAN Yuan-chao1,HE Jiu-xing1,KONG Meng1,SONG Ji-qing1, MAKOTO Saito2, LV Guo-hua1
(1. Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Sciences,Beijing 100081,China;2. Showa Denko K.K., Minato-ku, Tokyo 105-8518, Japan)
The type of soil microbial population plays an important role in soil quality and growth of crops. Studying the impact characteristics of different oligosaccharides on soil microbial population will help to use oligosaccharides correctly, efficiently and safely. In this study, the soils were placed in an artificial climate chamber, 50mg·L−1Chitosan oligosaccharide (CSOS) and Cello-oligosaccharide (COS) solution were applied into the soils, treated with clean water (CK) as the control, cultured for 6 days, sampled, and analyzed the structure composition and diversity distribution characteristics of soil microbial community by high-throughput sequencing technology. The CSOS and COS treatments significantly changed the community structure of bacteria and fungi, increased the observed number of bacterial species. Proteobacteria, Acidobacteria, Actinobacteria, Chloroflexi, Gemmatimonadetes and Bacteroidetes were the dominant bacteria. Ascomycota, Basidiomycota and Mortierllomycota were the dominant fungi. Through the comparative analysis of community composition among groups, it could be seen that the treatments both reduced the relative abundance of Acidobacteria in different degrees, and increased Proteobacteria, Actinobacteria, Gemmatimonadetes, Chytridiomycota and beneficial bacteria,,,,and. However, compared with the COS, the CSOS treatment had a greater change in microbial community composition. In addition, the CSOS and COS treatments had some differences in regulating soil microbial community structure. The relative abundance of beneficial bacteriatreated with the CSOS increased by 195%, and the relative abundance of beneficial bacteriatreated with the COS increased by 215%. In conclusion, chitosan oligosaccharide and cello-oligosaccharide both could optimize the structure and composition of soil microbial community. The difference between the CSOS and COS helped to realize the regulating mechanism, and promote their application and popularization.
; Cello-oligosaccharide; High-throughputsequencing; Bacterial communitystructure; Fungal community structure
收稿日期:2021−09−24
中央级公益性科研院所基本科研业务费专项(Y2020GH12);粮食丰产增效科技创新专项(2017YFD0300410-2);中日合作项目(2020110001002708)
通讯作者:吕国华,副研究员,从事农业新材料应用研究。E-mail:lvguohua@caas.cn
钱远超,E-mail:1124875667@qq.com
10.3969/j.issn.1000-6362.2022.06.004

