钳子管道残留组织胶对内镜清洗消毒质量的影响
马久红,毕正琴,张 云,周梦娇,李贤煌,黄 茜
(南昌大学第一附属医院消化内镜中心,江西 南昌 330006)
食管胃底静脉曲张破裂出血(esophagogastric variceal bleeding, EVB)具有发病急、来势凶的特点,是门静脉高压症最致命的并发症[1]。尽管目前经颈静脉肝内门静脉分流术和球囊逆行性经静脉阻塞术治疗EVB患者疗效确切[2],但上述两种手术复杂程度高且费时。随着内镜诊疗技术的发展,内镜下组织胶注射术能快速地达到止血的目的[3-4]。因此,内镜下组织胶注射术已成为治疗EVB的重要手段之一[5]。
组织胶是内镜下组织胶注射术的关键药物,是一类含氰基丙烯酸酯的合成胶,与水、血和组织液接触后立即凝固,可有效地栓塞曲张静脉,达到止血甚至消除静脉曲张的效果[6-7]。然而,组织胶注射过程中易溢出,凝结在钳子管道内难以去除[8],可能对内镜造成一定程度的损伤。目前,内镜下组织胶注射术后钳子管道组织胶的残留情况及对内镜清洗消毒质量的影响鲜有报道,本研究旨在对内镜下组织胶注射术后的内镜钳子管道进行观察,了解组织胶残留情况,并分析其对内镜清洗消毒质量的影响,以期为制定预防组织胶残留的措施提供理论依据。
1 对象与方法
1.1 研究对象 随机选取2021年6—8月某三甲医院消化内镜中心行内镜下组织胶注射术患者使用后的GIF-Q260J胃镜(Olympus,上海)41条,为避免陈旧组织胶残留的影响,所有内镜均为首次注胶内镜,且经管腔检测仪观察确认。
1.2 方法
1.2.1 检测设备 管腔检测仪(高精度超细管腔检测仪,美国Health mark工业公司),长110 cm,直径1.9 mm,镜头放大倍数达50倍,可拍摄分辨率800×800像素的视频和照片。
1.2.2 观察方法 检测人员手持管腔检测仪从内镜钳子管道出口即先端部顺行进入,之后从内镜钳子管道入口即操作部逆行进入,以确保全方位观察钳子管道;使用目测法观察内镜钳子管道外表面组织胶残留情况,对残留组织胶部位拍照记录。
1.2.3 内镜清洗消毒方法 严格按照《软式内镜清洗消毒技术规范》WS 507—2016[9]对内镜进行手工清洗消毒,采用过氧乙酸高水平消毒5 min。
1.2.4 微生物检测法 按照《医院消毒卫生标准》GB 15982—2012[10]规定,采用一次性无菌注射器抽取50 mL含硫代硫酸钠的中和剂冲洗液注入清洗消毒后的内镜钳子管道。冲洗后使用全量收集器于腔道出口收集冲洗液即采样液。充分混匀,取1 mL采样液分别接种2个营养琼脂平板,剩余48 mL采样液在无菌条件下采用孔径0.45 μm滤膜过滤,将滤膜接种于营养琼脂平板,于(36±1)℃恒温箱培养48 h后进行活菌计数。结果评价参照《软式内镜清洗消毒技术规范》WS 507—2016[9],内镜消毒合格标准为细菌总数≤20 CFU/件。
1.2.5 重复清洗消毒及微生物检测 依照1.2.3、1.2.4中的方法对28条残留组织胶的内镜进行重复清洗消毒和微生物检测。
1.2.6 质量控制 专人使用管腔检测仪对内镜钳子管道进行观察,管腔检测仪每次使用前依照厂家说明进行严格清洗消毒处理。
1.3 统计分析 应用Excel 2013录入数据,应用SPSS 21.0软件进行统计学分析,计数资料采用构成比(%)描述,采用χ2检验、秩和检验进行比较,以P≤0.05为差异具有统计学意义。
2 结果
2.1 一般情况 41例胃静脉曲张患者接受内镜下组织胶注射术治疗,其中男性33例,女性8例,年龄35~73岁,平均(51.95±11.33)岁。病因包括乙型病毒性肝炎后肝硬化37例,丙型病毒性肝炎后肝硬化3例,酒精性肝硬化1例。注胶量平均为(1.28±0.75)mL。
2.2 钳子管道组织胶残留情况 41条内镜钳子清洗消毒后,28条有组织胶残留,发生率为68.29%。组织胶残留部位以距离钳子管道出口0~2 cm处为主(23条),其次为钳子管道出口外表面0~5 cm处(3条),钳子管道入口0~3 cm处(2条)。钳子管道出口处0~2 cm处,组织胶残留多呈块状凸起或条索状等不规则形状;钳子管道出口外表面0~5 cm处残留组织胶多呈块状;钳子管道入口0~3 cm处偶见颗粒组织胶。见图1。
2.3 首次清洗消毒合格率与菌落数分布 28条残留组织胶内镜首次清洗消毒合格率为46.43%(13条),13条无组织胶残留的内镜清洗消毒合格率为100%,两组内镜首次清洗消毒合格率比较,差异有统计学意义(χ2=8.794,P=0.003)。按照消毒后内镜检出菌落数0、1~10、11~20、21~300、>300 CFU/件进行分组,秩和检验结果显示,残留组织胶内镜组和无组织胶残留内镜组的菌落数分布比较,差异有统计学意义(Z=-3.767,P<0.001)。见表1。
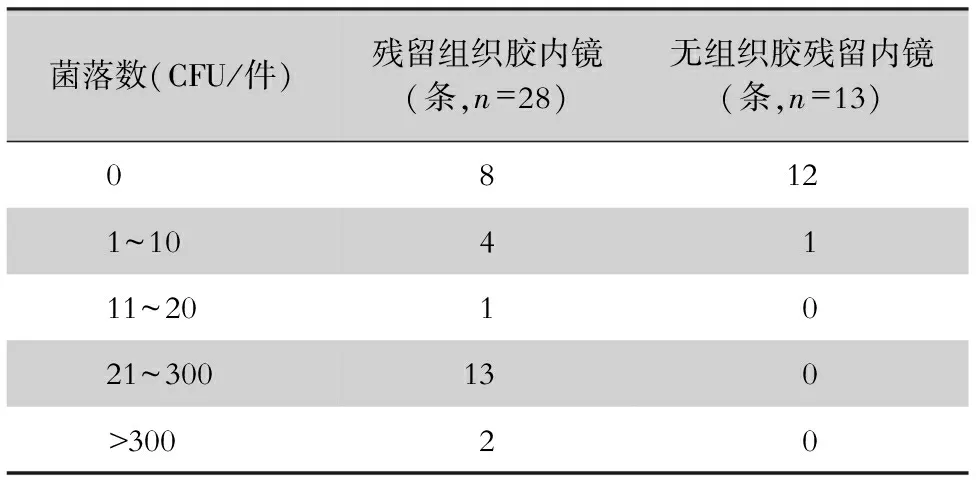
表1 首次清洗消毒后两组内镜菌落数分布
2.4 残留组织胶内镜重复清洗消毒合格率与菌落数分布 28条残留组织胶内镜重复清洗消毒合格率为53.57%(15条),与残留组织胶内镜首次清洗消毒合格率比较,差异无统计学意义(χ2=0.286,P=0.593)。残留组织胶内镜重复清洗消毒后菌落数与首次清洗消毒菌落数比较,差异无统计学意义(Z=-1.185,P=0.236)。见表2。
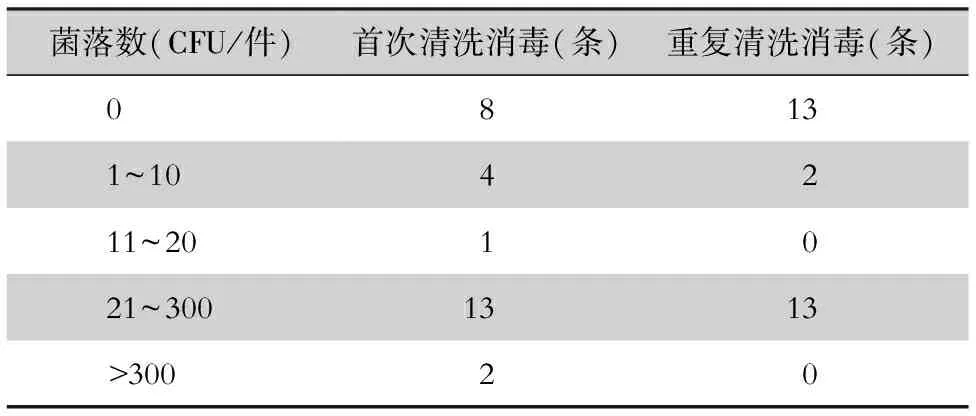
表2 28条残留组织胶内镜重复清洗消毒后菌落数分布
3 讨论
英国胃肠病学会(British Society of Gastroenterology, BSG)推荐内镜下组织胶注射术作为胃静脉曲张出血的一线治疗方法[5]。随着组织胶在内镜治疗中的广泛应用,残留在内镜钳子管道中的组织胶也成为内镜清洗消毒的一大难题[8]。
本研究发现,内镜下组织胶注射术后钳子管道组织胶残留率高达68.29%,且主要呈块状残留在钳子管道出口处,与Ofstead等[8]研究结果一致。组织胶凝结迅速,容易黏附在内镜钳子管道上,且再处理也难以彻底将其清除[11-12]。2018年美国食品和药物管理局(U.S.Food and Drug Administration, FDA)2份内镜审查报告显示,内镜清洗消毒难以清除黏附在内镜上的残留组织胶[13-14]。此外,奥林巴斯、富士、宾得等内镜厂家也指出,内镜诊疗中使用的组织胶易黏附内镜影响清洗消毒质量,甚至损坏内镜。由此可见,内镜中残留组织胶是普遍存在的现象,未来预防及清除组织胶残留挑战巨大。
管腔检测仪检测发现,组织胶主要残留部位为钳子管道出口0~2 cm处和出口外表面0~5 cm处,且以块状残留为主,黏附性较强。由于内镜组织胶注射治疗时,穿刺处的血流压力较大,针眼封堵不完全,组织胶外溢顺着注射针反流凝结在内镜钳子管道出口处。钳子管道外表面的残留组织胶可能是由内镜触碰到穿刺点上未凝固的组织胶而造成,而钳子管道入口处的颗粒组织胶则可能是由注射针退出时针管内胶水滴落凝结所致。组织胶通常在10~15 s内迅速凝固[6],为了尽量避免术后组织胶残留,要求医护人员术中技术水平过硬,操作配合默契。有条件者应立即使用管腔检测仪观察组织胶注射术使用后的钳子管道,以便及时发现并清除残留组织胶。
本研究结果显示,残留组织胶组内镜钳子管道清洗消毒合格率低于无组织胶残留组,检出菌落数高于无组织胶残留组。分析原因可能是残留的组织胶表面坑洼不平容易黏附细菌,清洗刷及消毒剂难以对其进行彻底清洗和消毒。本研究对残留组织胶的内镜进行重复清洗消毒,仍有较多内镜钳子管道检出微生物,且与28条残留组织胶内镜钳子管道首次清洗消毒合格率及菌落数比较,差异均无统计学意义。说明重复清洗消毒不能完全清除黏附在残留组织胶上的微生物和作为细菌黏附载体的组织胶。研究[15-16]表明,残留的组织胶容易成为细菌黏附和生物膜形成的聚集地,导致清洗消毒不充分而增加医院感染的风险。因此,制定高效可行的组织胶清除方法或预防措施,减少因组织胶残留而导致内镜清洗消毒质量的降低迫在眉睫。
目前,临床上常使用丙酮或多酶清洗液处理残留组织胶。丙酮作为一种有机溶剂能有效溶解残留在钳子管道口或外表面的组织胶,但对于钳子管道深部的残留组织胶需在管腔检测仪观察下定点清除;缺乏辅助观察工具的基层医院难以发现并及时清除残留在钳子管道深部的组织胶,从而增加内镜堵塞及医院感染的风险;且丙酮具有毒性、易挥发,防护不到位易危害人员健康[17-18]。相较于丙酮的快速有效,多酶清洗液虽能有效地分解体液中的蛋白质、脂肪等有机化合物[19],但对凝固后的组织胶分解效果差,无法溶解残留组织胶。由此可见,亟需开展多学科合作研发出科学合理的组织胶清除方法。
内镜下组织胶注射术后钳子管道残留组织胶发生率高,降低内镜清洗消毒质量,增加内镜相关医院感染发生的风险。临床上应重视内镜下组织胶注射所带来的钳子管道组织胶残留问题,规范组织胶注射流程及加强医护人员技能培训。对于行组织胶注射术后的内镜应常规应用管腔检测仪进行观察,以便及时发现并加强清洗消毒。目前暂无有效的方法清除内镜钳子管道的残留组织胶,期待进一步研究更好的清除残留组织胶方法,以保证安全使用内镜。
本研究为单中心横断面研究,后续期待进行多中心研究,以获得证据学更高的结果。其次,本研究仅对钳子管道内部进行微生物检测,而未对钳子管道外表面进行微生物检测,后续研究可考虑对钳子管道外表面进行微生物检测,进一步明确残留组织胶对内镜清洗消毒质量的影响。
利益冲突:所有作者均声明不存在利益冲突。

