应用近红外光谱技术监测脓毒症患儿胃肠功能障碍的前瞻性研究
姚德贞 王丽杰
(中国医科大学附属盛京医院儿科重症监护病房,辽宁沈阳 110004)
胃肠功能障碍可并发于各种危急重症,发生率高,与患者预后息息相关[1],但关于胃肠道的研究偏少且进展缓慢。脓毒症是儿科重症监护病房(pediatric intensive care unit,PICU)最常见的危重疾病,可引起多器官功能障碍,而胃肠道是多器官功能障碍综合征的枢纽器官。临床研究表明,脓毒症患者胃肠功能障碍发生率高达78.8%,病死率高达61.7%[2]。早期综合治疗可以有效改善患儿症状,降低病死率[3]。但直到目前,儿童胃肠功能障碍仍采用1995年诊断标准[4],以临床表现为主,缺少客观的诊断指标,临床上常由于没有及时发现胃肠功能障碍而错过最佳治疗时期,导致胃肠功能衰竭,甚至死亡。因此,寻找能够对胃肠功能动态监测的指标对目前临床工作进展及改善患儿预后至关重要。
近红外光谱 (near-infrared spectroscopy,NIRS)是一种无创、实时地监测局部组织灌注的技术[5]。NIRS的原理是由于氧合血红蛋白(oxygenated hemoglobin,HbO2)和脱氧血红蛋白(deoxyhemoglobin,HbR)吸收光谱不同,接收探头所收集的反射光强度由HbO2与HbR的比值决定,通过二者在组织中的平均值计算局部组织氧饱和度(regional oxygen saturation,rSO2)=HbO2/(HbO2+HbR)[6]。组织灌注和氧合是人体生理功能的重要指标,通过NIRS监测rSO2是近年来广泛应用的评估组织氧合状态的方法,在危重患儿群体中有很大的潜力,但很少有研究将其与胃肠功能障碍相关联。本研究将NIRS应用于肠系膜局部组织血氧饱和度监测,通过监测肠系膜上动脉的缺血缺氧为儿童脓毒症导致的胃肠功能障碍提供早期预警资料。
1 资料与方法
1.1 研究对象
前瞻性纳入2021年1~12月入住中国医科大学附属盛京医院PICU所有诊断为脓毒症的患儿,同时选取儿童保健科健康体检儿童为健康对照组,年龄范围1月龄至14岁。排除合并先天性心脏病(如动脉导管未闭影响患儿肠道血流)、腹壁损伤、先天性膈疝(脐下不能监测到肠系膜血氧饱和度)的患儿。本研究已通过医院伦理委员会批准(2021PS037K)。
1.2 诊断标准
脓毒症诊断标准采用2005年国际儿童脓毒症诊断共识中的标准[7]。胃肠功能障碍采用1995年第四届小儿急救医学研讨会制定的诊断标准:腹胀、肠鸣音减弱或消失、呕吐咖啡样物[4]。
1.3 分组
所有纳入的脓毒症患儿,根据入院时或PICU住院期间有无胃肠功能障碍发生分为胃肠功能障碍组及无胃肠功能障碍组;根据原发感染病灶分为肠源性感染组和非肠源性感染组。
将非肠源性感染组根据入院时或PICU住院期间有无胃肠功能障碍发生分为胃肠功能障碍亚组和无胃肠功能障碍亚组。
1.4 胃肠道rSO2监测方法
本研究统一选取餐后1 h测量肠系膜rSO2,避免肠道蠕动及喂养状态对rSO2的影响。所有入院时或住院期间诊断脓毒症的患儿,每天上午9~12点,下午2~4点(餐后1 h),应用NIRS仪器(RDS-7,Masimo)连续测量3~5 min的腹部rSO2,上下波动不超过2%为腹部血氧饱和度值。传感器2个探头放置在腹壁左下及右下象限(脐周2 cm)。胃肠功能障碍组在诊断胃肠功能障碍后开始监测rSO2直至诊断后48 h。无胃肠功能障碍组监测rSO2到出院/死亡。健康对照组在取得家长知情同意后于门诊当日完成3~5 min rSO2曲线描记。取各组监测曲线对应的rSO2平均值进行分析。
1.5 观察指标
对所有入组患儿记录入院基本情况,包括月龄、性别、身高、体重、第三代小儿死亡危险评分(Pediatric Risk of MortalityⅢ,PRISMⅢ)等,诊断脓毒症24 h内血乳酸、空腹葡萄糖、C反应蛋白(C-reaction protein,CRP)、白细胞介素6(interleukin-6,IL-6)、降钙素原(procalcitonin,PCT)、肝功能、肾功能最异常值(部分患儿在诊断脓毒症24 h内根据病情需要多次检验),住院期间是否输血、是否使用儿茶酚胺类药物、血培养是否阳性、感染灶、机械通气时间、PICU住院时间、住院费用、28 d病死率。
1.6 统计学分析
数据采用SPSS 20.0统计软件进行分析。非正态分布计量资料以中位数(四分位数间距)[M(P25,P75)]表示,两组比较用Mann-WhitneyU检验,多组比较用Kruskal-WallisH检验,当P<0.05后采用Bonferroni校正法进行多重比较。计数资料用例数和百分率(%)表示,率的比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 研究对象的基本资料
研究期间共诊断脓毒症患儿86例,7例因转科、死亡及手术等原因造成信息不完整未能纳入,纳入研究共79例,见表1。健康对照组40例,年龄为36(8,60)个月;男23例(58%),女17例(42%);中位体重指数(body mass index,BMI)为18.0(16.2,21.0)kg/m2,胃肠功能障碍组、无胃肠功能障碍组患儿与健康对照组儿童的性别构成(χ2=2.033,P=0.991)、年龄(H=2.370,P=0.306)、BMI(H=2.186,P=0.335)差异无统计学意义。
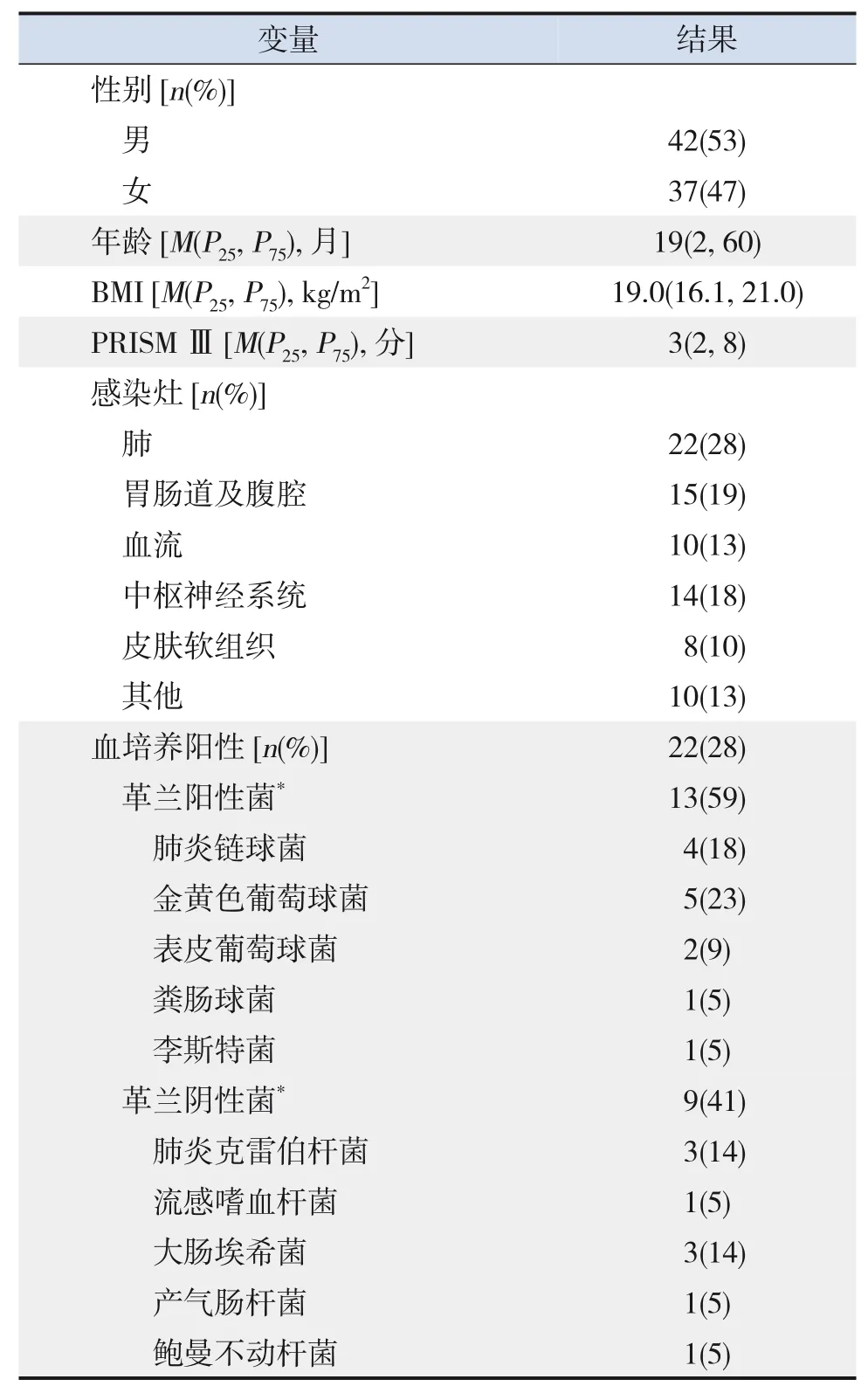
表1 79例脓毒症患儿基本资料
2.2 胃肠功能障碍组及无胃肠功能障碍组临床资料比较
79例脓毒症患儿中,胃肠功能障碍组39例,其中30例入院时即存在胃肠功能障碍,余9例胃肠功能障碍中位发生时间为入住PICU后15(5,100)h。与无胃肠功能障碍组比较,胃肠功能障碍组rSO2、白蛋白低,机械通气时间长,PRISMⅢ评分、儿茶酚胺药物使用率、输血率、28 d病死率、丙氨酸氨基转移酶、天冬氨酸氨基转移酶、血乳酸、PCT及IL-6高(P<0.05)。见表2。

表2 胃肠功能障碍组与无胃肠功能障碍组临床资料比较
2.3 胃肠功能障碍组、无胃肠功能障碍组与健康对照组rSO2比较
胃肠功能障碍组rSO2[64%(60%,67%)]、无胃肠功能障碍组rSO2[72%(70%,78%)]、健康对照组rSO2[78%(76%,84%)]比较,差异有统计学意义(H=63.674,P<0.001)。组间两两比较结果显示,胃肠功能障碍组rSO2低于无胃肠功能障碍组及健康对照组,无胃肠功能障碍组rSO2低于健康对照组(P<0.05)。
2.4 肠源性感染组与非肠源性感染组胃肠功能障碍发生率、rSO2及病死率比较
15例肠源性感染患儿包括肠梗阻8例,阑尾炎3例,坏死性小肠结肠炎1例,腹腔脓肿1例,胰腺炎1例,肠穿孔1例。肠源性感染组胃肠功能障碍发生率高于非肠源性感染组(P<0.05),且肠源性感染合并胃肠功能障碍患儿rSO2低于非肠源性感染合并胃肠功能障碍患儿(P<0.05)。肠源性感染组和非肠源性感染组28 d病死率比较差异无统计学意义(P>0.05)。见表3。
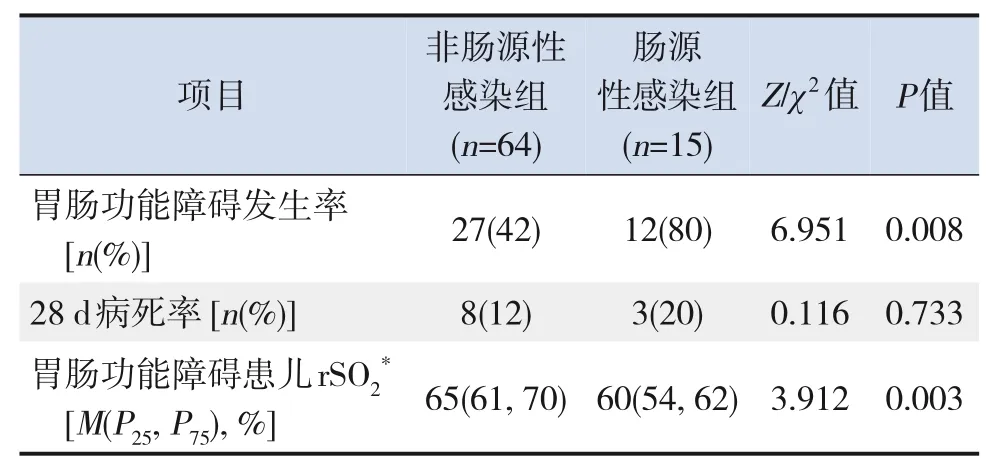
表3 肠源性感染组与非肠源性感染组比较
2.5 胃肠功能障碍亚组与无胃肠功能障碍亚组rSO2比较
非肠源性感染患儿中,胃肠功能障碍亚组rSO2低于无胃肠功能障碍亚组[65%(61%,70%)vs 72%(70%,78%),Z=3.981,P<0.001]。
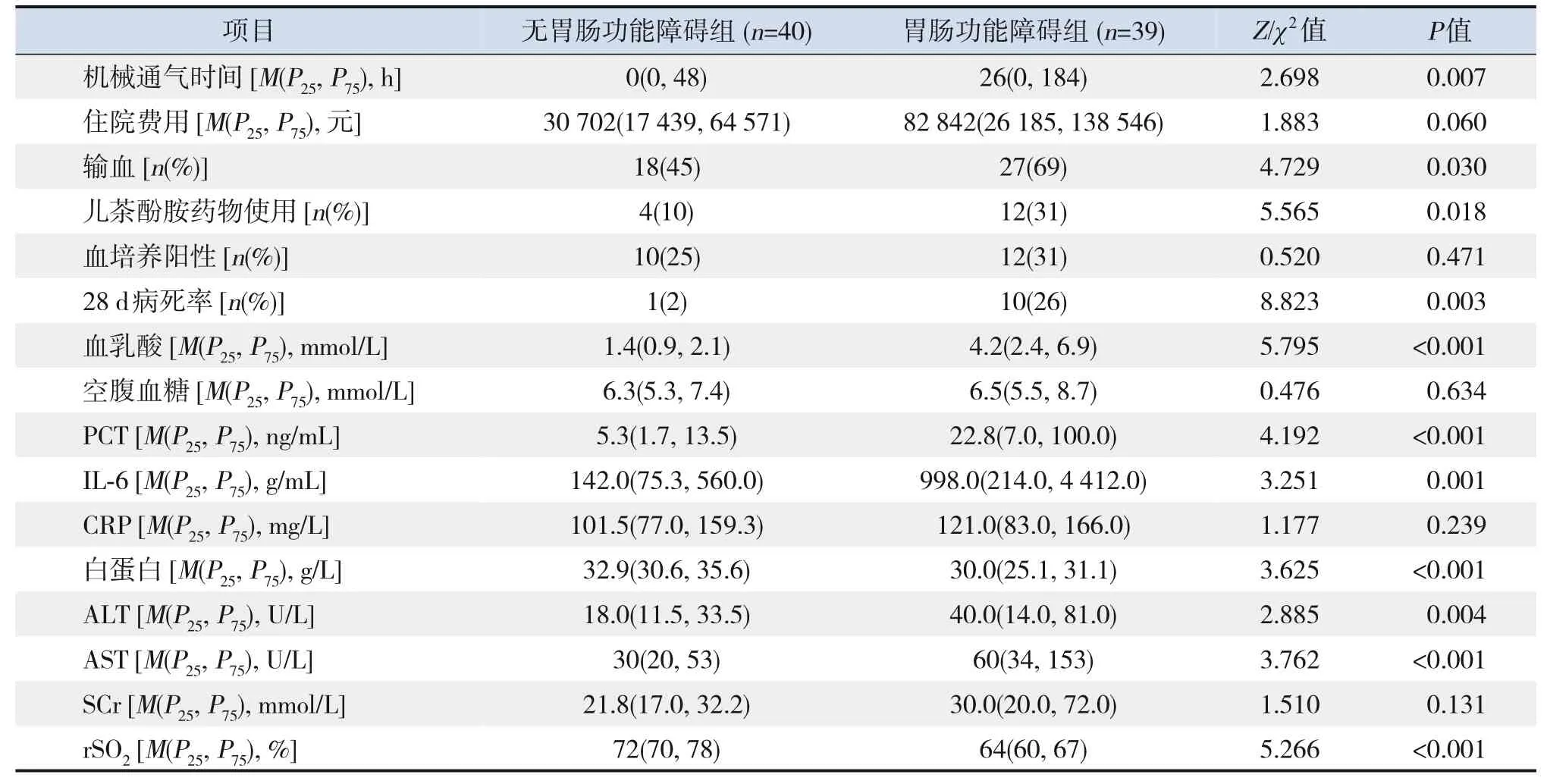
表2(续)
3 讨论
本研究脓毒症患儿胃肠功能障碍发生率49%,脓毒症患儿总病死率14%(11/79),死亡患儿中高达91%合并胃肠功能障碍。胃肠功能障碍患儿病死率26%,提示危重患儿胃肠功能障碍发生率及病死率高,需引起临床工作者重视。本研究不良预后包括机械通气时间延长、28 d病死率增高。这与国外近期研究结果一致,Padar等[8]研究表明胃肠功能衰竭患者机械通气时间更长,ICU住院时间更长,30 d和90 d病死率更高。2008年Reintam等[9]将胃肠功能衰竭评分整合到序贯器官衰竭评分系统后,可以更好地预测ICU病死率,并且是病死率的独立预测因子(OR=1.49,95%CI=1.28~1.74,P<0.001)。
本研究发现胃肠功能障碍组PRISMⅢ评分、儿茶酚胺药物使用率及输血率更高。分析原因,脓毒症患儿会出现不同程度的血流动力学紊乱,此时优先供应重要器官如脑、心脏的血流,而牺牲其他器官(包括胃肠道)的血流和氧供,胃肠道往往是第一个遭受缺血缺氧损伤的器官,故合并胃肠功能障碍患儿往往病情更重,需要更多血液制品及血管活性药物,死亡风险更大。这也佐证了前面叙述的将胃肠功能障碍纳入死亡风险评分可以提高预测价值。
本研究还发现胃肠功能障碍患儿血乳酸及PCT、IL-6、丙氨酸氨基转移酶、天冬氨酸氨基转移酶水平更高,白蛋白水平更低。从采样时间角度,本研究纳入诊断脓毒症患儿24 h内化验结果,PCT和IL-6在感染早期1~2 h即可升高,而CRP升高晚于PCT和IL-6,在24~48 h达到峰值,故CRP在两组间差异无统计学意义。大量研究表明PCT对脓毒症病情严重程度及预后判断更具特异性和敏感性,因此,临床上对高度疑似细菌感染引起的脓毒症,不能单纯应用CRP水平判断是否是细菌感染及病情严重程度,需联合多种生物标志物综合判断,或动态监测生物标志物[10]。脓毒症多种发病机制均可引起肠道功能破坏,毛细血管通透性增加,出现严重毛细血管渗漏,短时间即可出现低蛋白血症[11-12]。乳酸水平升高提示组织、器官缺血缺氧、灌注不足,因此乳酸已被应用于多种胃肠道疾病严重程度的评估,如坏死性小肠结肠炎、阑尾炎及急腹症患者肠缺血等[13-15]。近期国内外还有很多关于胃肠功能障碍标志物的研究:血清瓜氨酸联合乳酸、胃泌素和胃动素、白细胞介素10和分泌性免疫球蛋白A、血清成纤维细胞生长因子19等[16-19],但目前多局限于实验室阶段。
NIRS适用于评估不同器官的rSO2,反映氧供及氧耗之间的平衡,反映组织灌注情况[6],最初应用于脑部,近期也有研究将其应用于肝脏、肾脏及肌肉、术后血运恢复的评估[20-23],但对于胃肠道功能的研究较少[24]。而胃肠道的循环障碍通常是导致多器官功能衰竭的第一步,即使心率、血压和脉搏血氧饱和度等参数在正常范围,胃肠道组织的氧合也可能受到严重影响,而rSO2为能够早期检测的指标[25]。本研究尝试通过床旁rSO2实时监测胃肠道的灌注情况,发现胃肠功能障碍组rSO2明显低于无胃肠功能障碍组及健康对照组,提示rSO2的降低与胃肠道灌注不足导致的胃肠功能障碍相关。
当胃肠道黏膜屏障在各种内因或外因(烧伤、创伤、大手术、感染、休克)的影响下遭到破坏后,肠道内的细菌及内毒素突破肠黏膜屏障侵犯到肠外组织,可引起肠源性感染[26]。本研究发现肠源性感染更易合并胃肠功能障碍,且合并胃肠功能障碍患儿的rSO2水平更低,表示肠源性感染造成的肠道黏膜屏障功能受损、胃肠道灌注不足更加严重。为确认rSO2水平与胃肠功能障碍发生之间的关系,我们思考是否只有肠源性感染会导致rSO2的下降,故进行了细化的研究。我们将所有肠源性感染患儿排除在外,数据分析显示其他病灶引起脓毒症的胃肠功能障碍亚组rSO2仍较无胃肠功能障碍亚组明显降低,进一步证实了NIRS对胃肠功能障碍的监测意义。
本研究尝试将rSO2与胃肠功能障碍相关联,分析胃肠功能障碍患儿rSO2水平的差异,这一结果与之前NIRS应用于胃肠道的研究类似。Stienstra等[27]发现临床确诊为肠缺血和肠无缺血患者rSO2范围分别为15%~29%和45%~93%,差异具有统计学意义。Patel等[28]发现肠道rSO2≤56%与新生儿坏死性小肠结肠炎风险显著增加独立相关(优势比14.1,P=0.01)。Kaufman等[29]将腹部rSO2联合胃pH值监测、全身混合静脉血氧饱和度和血乳酸进行对比,结果显示腹部rSO2与全身混合静脉血氧饱和度(r=0.89,P<0.001)、胃pH值(r=0.79,P<0.001)和血乳酸(r=0.77,P<0.001)之间存在明显相关性,为利用腹部rSO2监测胃肠功能提供了依据。
本研究存在一定局限性,患儿数量较少,特别是发生胃肠功能障碍的人数少,有可能影响统计学结果。本研究大多数患儿入院时即存在胃肠功能障碍症状,但rSO2可能在此之前已经呈下降趋势,未来连续性的大样本研究将可能发现胃肠功能障碍的rSO2临界值。NIRS监测rSO2的特异性可能需要进一步研究,本研究所得的rSO2数值可能无法在不同的NIRS传感器之间通用[25]。然而,作为一项单中心研究,我们相信该结果为进一步研究提供了良好的临床依据。
脓毒症患儿胃肠功能障碍发生率和病死率高,影响预后,rSO2降低与胃肠功能障碍密切相关。胃肠道NIRS作为一种无创、实时、连续、可床边操作的工具,有希望用于对胃肠功能的多模态监测,尤其可以用于研究脓毒症患儿胃肠道血流动力学,为儿童胃肠功能障碍提供早期预警资料。

