量子化学计算在环境纳米技术教学中的应用
任雪峰,柳丽芬,杨俏,安茂忠,刘安敏 *
(1.大连理工大学海洋科学与技术学院,辽宁 盘锦 124221;2.哈尔滨工业大学化工与化学学院,城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150001;3.大连理工大学化工学院盘锦分院,精细化工国家重点实验室,辽宁 盘锦 124221)
“环境纳米技术”是环境科学与工程专业研究生的理论课,学生通过课程学习,能够掌握纳米材料的制备与表征及其在环境污染物治理与生态修复方面的具体应用和作用机理[1]。在课程教学环节希望融入更多创新方法,提升研究生在利用和开发纳米技术方面的创新能力,进而具备使用纳米技术解决人类社会可持续发展问题的能力。
在水污染治理中,电镀废水因含有大量氰化物与重金属离子而成为难点[2-3],未有效去除污染物的电镀废水会严重危害环境及人体健康[4-5]。电镀工艺种类繁多,因此电镀废水成分复杂[6-8]。当前电镀废水处理工艺主要有化学法、离子交换法、电解法、蒸发浓缩法、反渗透法、电渗析法、吸附法等[9-11]。其中吸附法由于具有工艺简单、装备制造便宜、操作容易等优点而被广泛使用[12]。沸石、粉煤灰、活性炭等材料对废水中的重金属离子都有一定的脱除效果,主要用于处理浓度极低的废水,吸附效果关键在于吸附容量与选择性。从净化效率和运行成本两方面考虑,都应尽可能选择吸附效率高、价格便宜的吸附材料[13]。碳材料是电镀废水处理中重要的吸附材料[14-15],然而由于其种类较多、组成复杂,因此选取适宜的碳材料是提升吸附效果的关键[16-17]。
“环境纳米技术”在授课环节中注重培养学生选择理想的纳米材料及其技术应用路径的能力,掌握对比不同纳米材料的性能并提出改进性能的方法,最终学会运用适宜的纳米技术控制污染、修复生态环境的能力,并分析相关的作用机理。创新是研究生教育的本质属性,随着计算化学的不断发展与广泛应用[18-20],量子化学计算等理论手段也被广泛应用于吸附材料选择[21-22]、环境材料作用机理等方面的研究[23-25]。
因此在“环境纳米技术”的教学环节中,希望引入量子化学计算来辅助吸附碳材料的设计和筛选,以找到适宜的碳材料用于电镀废水离子吸附并研究其吸附机理,以及指导实验制备,提升研究课题的方向性和目的性,以更高的效率开展准确的实验研究。通过教学环节的课程创新,将量子化学计算引入理论知识学习之中,提升研究生的理论思维和创新意识,有助于研究生高效开展研究工作,并提升其研究内容的理论深度。
1 创新理念与过程
以采用碳材料对电镀废水中的金属离子进行吸附捕集为课程示例,通过可在Windows 系统下运行的可视化Materials Studio(简称MS)软件作为计算化学工具,利用DMol3模块,以PBE 泛函、DNP 基组(basfile_v4.4)进行量子化学计算,研究石墨烯与改性石墨烯的量子化学性质及金属离子在其表面的吸附行为,从而判断各碳材料对金属离子的吸附能力。在计算过程中,设置溶剂为水,模拟真实情况下电镀废水中离子的吸附行为。
水中离子在碳材料表面的吸附能EAdsorption可以用式(1)计算。

其中ETotal是离子与碳材料的总能量,ECarbon和EIon分别指碳材料以及离子单独存在时的能量。
2 示范内容
2. 1 碳材料性质的研究
以石墨烯(GN)及其修饰结构作为吸附碳材料研究对象,首先计算具有氧原子掺杂(O-GN)、缺陷结构(D-GN)与氧掺杂缺陷结构石墨烯(O-D-GN)的量子化学性质。
如图1 所示,氧原子或缺陷结构的存在会显著改变石墨烯的前线分子轨道电子云分布,其中氧原子或缺陷位结构是电子云相对集中的区域(黄色与蓝色的电子云代表电子出现概率较大的区域),说明其活性较高,易于在上述位点发生良好吸附。电子云分布可以初步预测吸附活性位点,图2 所示的轨道能级则是定量预测碳材料吸附能力的重要指标。HOMO(最高占据分子轨道)值决定碳材料向金属空轨道供给电子而发生吸附作用的能力,LUMO(最低未占据分子轨道)值则表示碳材料从外界得到电子而形成反馈键的能力,反馈键的形成会进一步提升吸附稳定性[26]。
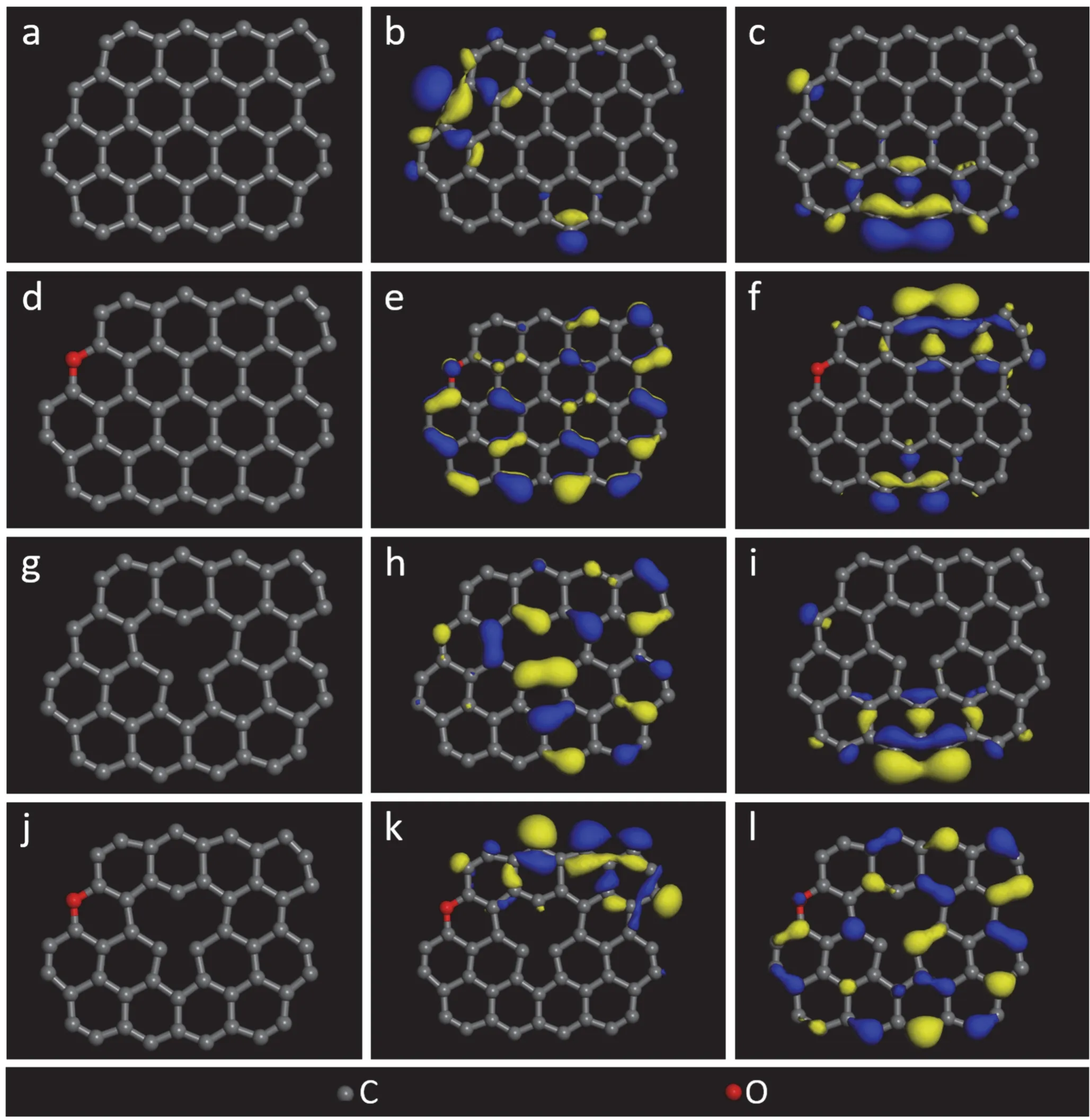
图1 碳材料的结构:(a) GN,(d) O-GN,(g) D-GN,(j) O-D-GN;最高占据分子轨道(HOMO):(b) GN,(e) O-GN,(h) D-GN,(k) O-D-GN;最低未占据分子轨道(LUMO):(c) GN,(f) O-GN,(i) D-GN,(l) O-D-GNFigure 1 Molecular structures, HOMO, and LUMO of GN (a, b, c), O-GN (d, e, f), D-GN (g, h, i), and O-D-GN (j, k, l)
如图2 所示,在引入氧原子或缺陷结构后,石墨烯基碳材料的前线分子轨道能级发生了变化,使其得失电子能力发生变化,影响其吸附能力与吸附稳定性。O-GN 与D-GN 的HOMO 值升高,因而具有更强的供电子能力,可以向金属提供电子并发生稳定的吸附作用。D-GN 与O-D-GN 的LUMO 值降低,则更易于得到电子而形成反馈键,提升吸附稳定性。因此,3 种改性手段均有助于提升碳材料的吸附稳定性。然而由于HOMO、LUMO 的能级在较小范围内变化,因此需要进一步通过考察离子在碳材料表面的吸附行为才能明确各待选碳材料的吸附能力。
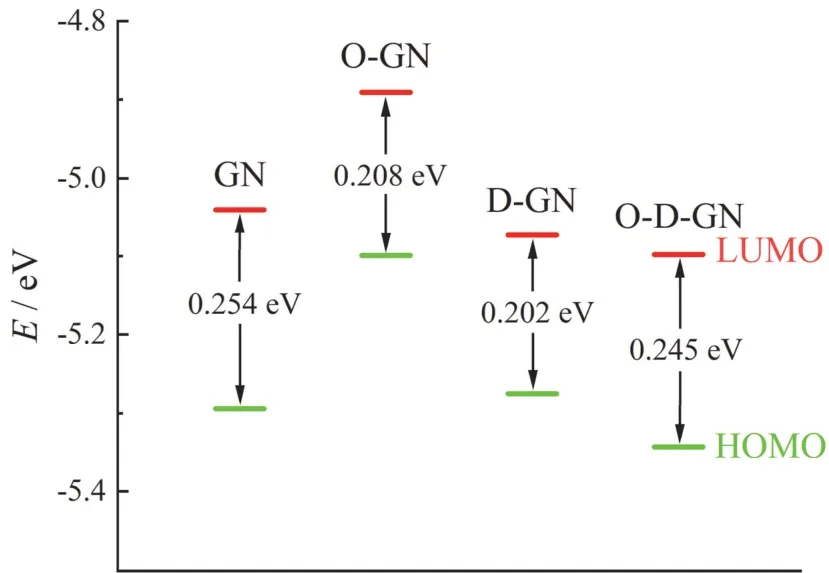
图2 几种碳材料的前线分子轨道能级Figure 2 Values of frontier molecular orbitals of several carbon materials
2. 2 碳材料表面离子吸附行为的研究
选择电镀废水中常见的金属离子Cr3+、Cu2+、Ni2+、Zn2+以及剧毒配位剂离子CN-作为碳材料表面吸附行为的研究对象,根据它们在碳材料表面的吸附能来判断其吸附稳定性。
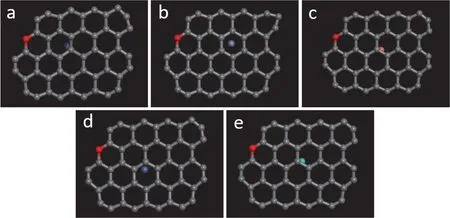
图4 氧掺杂石墨烯表面配位剂CN-离子(a)与金属离子Cr3+(b)、Cu2+(c)、Ni2+(d)、Zn2+(e)的吸附构型Figure 4 Adsorption behaviors of ligand CN- (a) and metal ions Cr3+ (b), Cu2+(c), Ni2+ (d), and Zn2+ (e)on the surface of oxygen-doped graphene (O-GN)
由图3-6 可知,量子化学计算结果表明Cr3+、Cu2+、Ni2+、Zn2+与CN-均可吸附于上述几种碳材料的表面,说明石墨烯对上述离子具有良好的吸附行为,有望将其用于吸附电镀废水中的各类离子。图7 给出了按式(1)计算的各离子在不同碳材料表面的吸附能。从中可见在4 种待选碳材料表面,各种离子均有较高的吸附能,证明它们的吸附稳定性良好。对比同一离子时会发现,缺陷石墨烯及氧掺杂缺陷石墨烯表现出更加优异的吸附行为,证明它们的吸附能力比石墨烯及氧掺杂石墨烯更好。
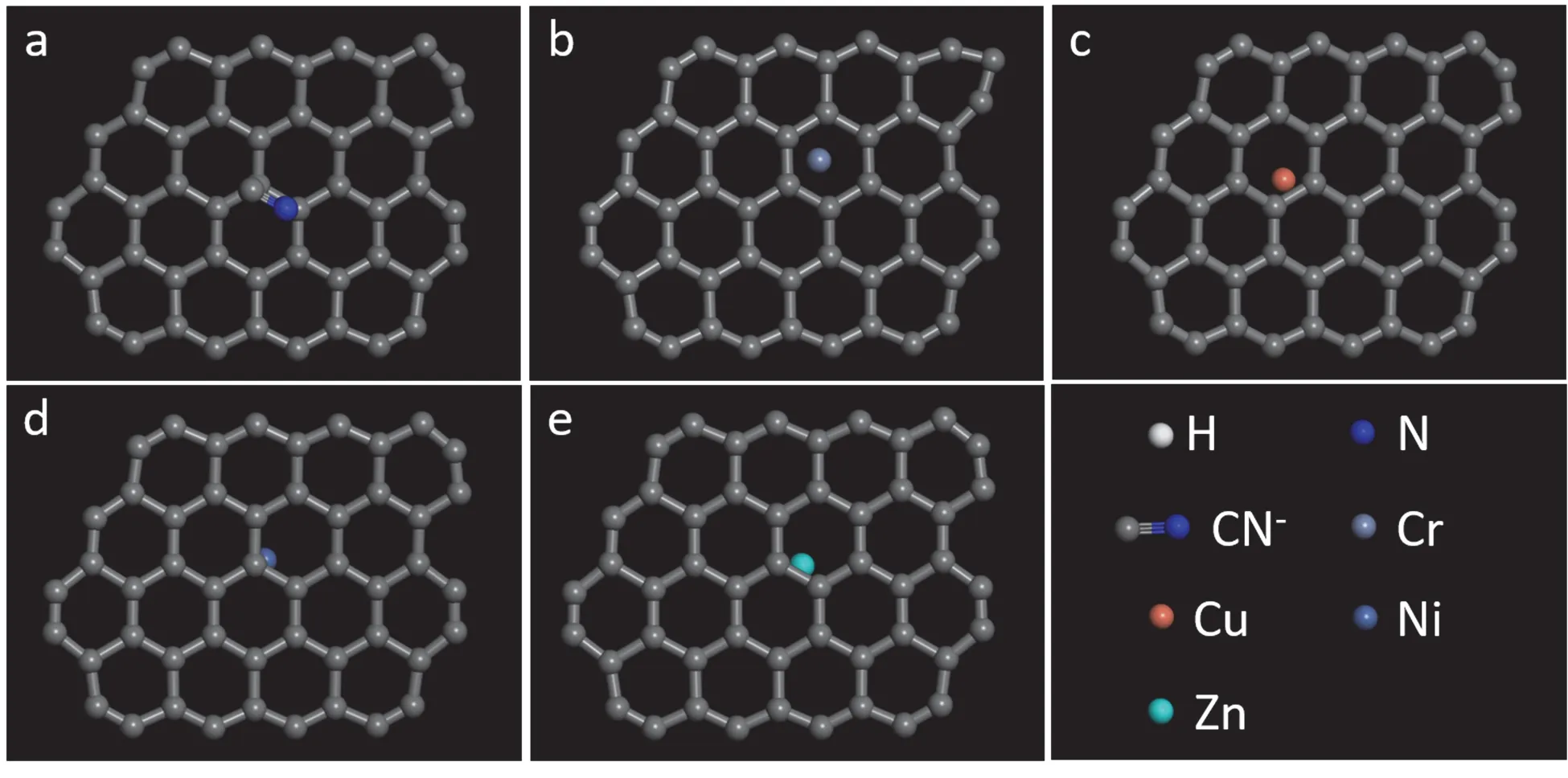
图3 石墨烯表面配位剂CN-离子(a)与金属离子Cr3+(b)、Cu2+(c)、Ni2+(d)、Zn2+(e)的吸附构型Figure 3 Adsorption behaviors of ligand CN- (a) and metallic ions Cr3+ (b), Cu2+(c), Ni2+ (d), and Zn2+ (e)on the surface of graphene (GN)
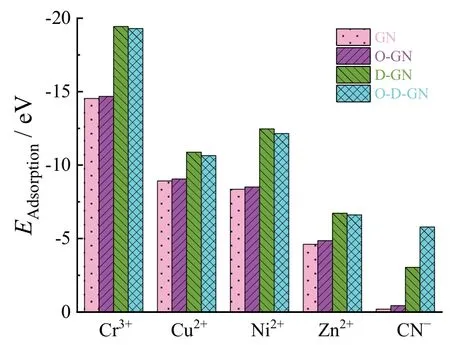
图7 待选碳材料表面金属离子Cr3+、Ni2+、Zn2+、Cu2+与配位剂CN-离子的吸附能Figure 7 Adsorption energy of Cr3+, Ni2+, Zn2+, Cu2+, and CN- on some carbon material candidates, respectively
以上研究结果表明,所考察的几种碳材料是电镀废水处理中离子吸附的理想材料,对所选的几种离子均具有良好的吸附能力。结构缺陷与杂原子的引入进一步提升了石墨烯的吸附能力,有望获得性能更加优异的吸附材料。Cr3+与其他3 种金属离子在4 个碳材料表面的吸附能存在明显差别。由此不难推测,通过对碳材料的适当设计可以实现某一离子的高选择性吸附。
以上两节的课程练习安排了学生尝试不同碳材料吸附水中微塑料的研究,锻炼其模型建立、材料量子化学性质分析与吸附能计算三方面的能力,以达到掌握材料筛选能力的目的。
2. 3 离子价态对吸附行为影响的研究
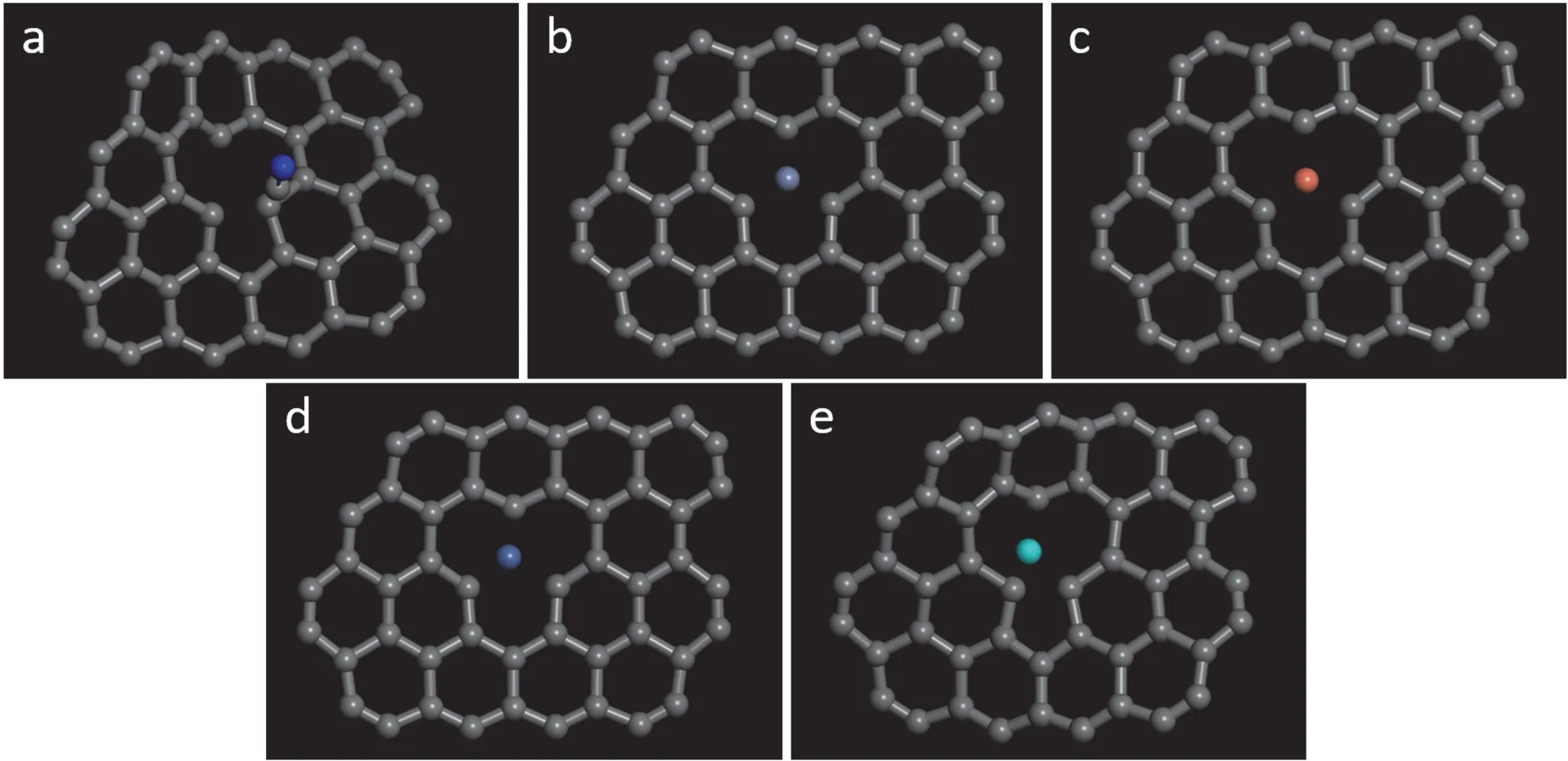
图5 缺陷石墨烯表面配位剂CN-离子(a)与金属离子Cr3+(b)、Cu2+(c)、Ni2+(d)、Zn2+(e)的吸附构型Figure 5 Adsorption behaviors of ligand CN- (a) and metal ions Cr3+ (b), Cu2+(c), Ni2+ (d), and Zn2+ (e)on the surface of defective graphene (D-GN)
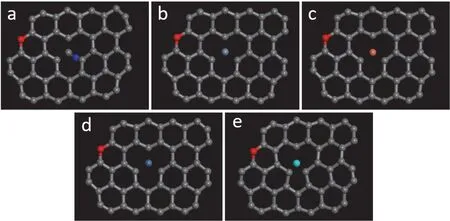
图6 氧掺杂缺陷石墨烯表面配位剂CN-离子(a)与金属离子Cr3+(b)、Cu2+(c)、Ni2+(d)、Zn2+(e)的吸附构型Figure 6 Adsorption behaviors of ligand CN- (a) and metal ions Cr3+ (b), Cu2+(c), Ni2+ (d), and Zn2+ (e)on the surface of oxygen-doped defective graphene (O-D-GN)
通过对4 种待选碳材料表面的吸附行为研究发现,三价的Cr3+与二价的Ni2+、Zn2+、Cu2+在同一碳材料表面的吸附能存在明显差异,因此怀疑不同价态的同种金属离子可能有不同的吸附行为,于是计算了Cu2+与Cu+以及Fe3+与Fe2+两组离子在待选碳材料表面的吸附能。如图8 所示,Cu+、Fe3+与Fe2+均吸附于碳材料表面,说明待选石墨烯基碳材料对这3 种离子也具有良好的吸附行为。
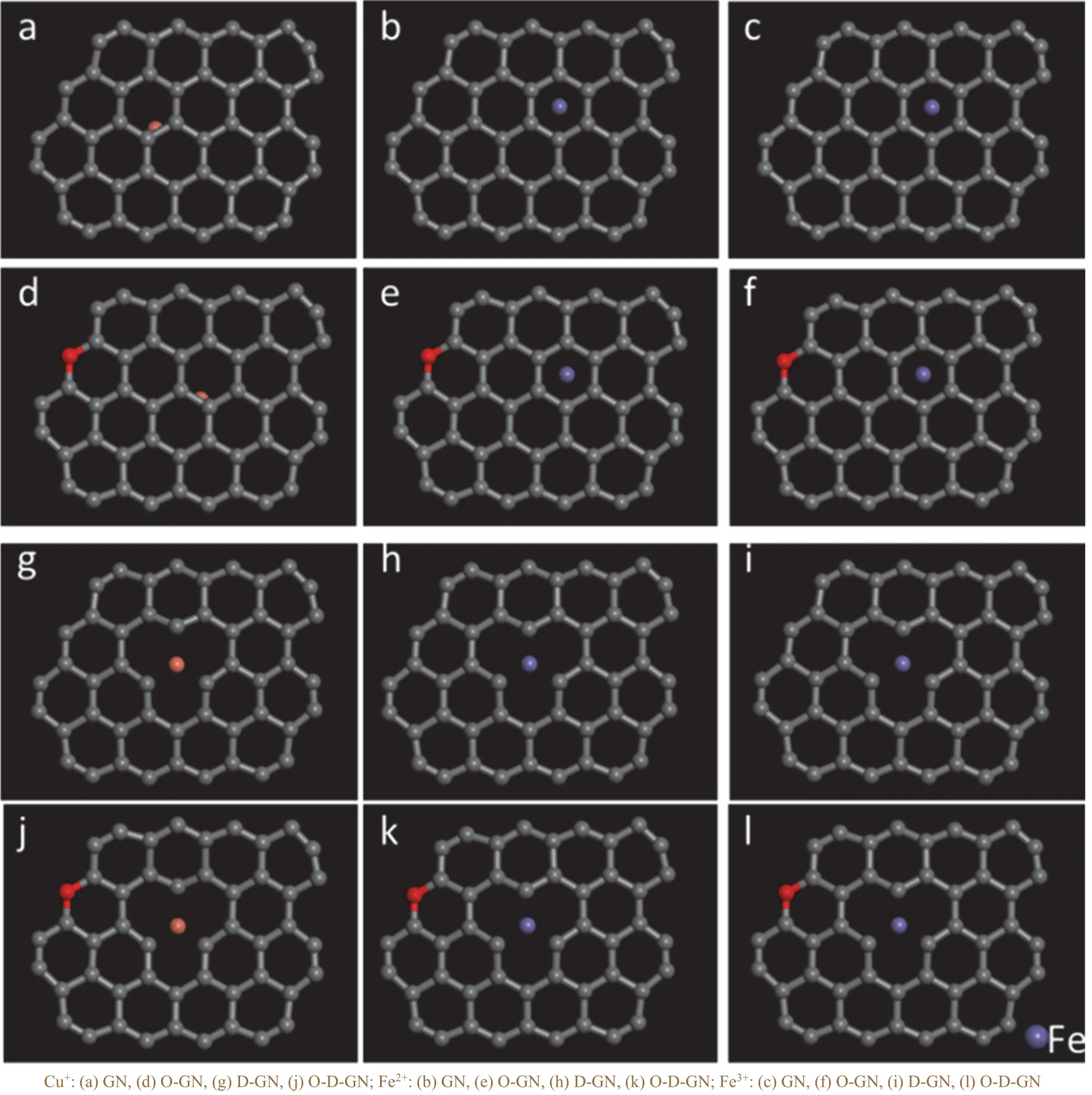
图8 待选碳材料表面Cu+、Fe3+与Fe2+的吸附构型Figure 8 Adsorption behaviors of Cu+, Fe3+, and Fe2+ on the surfaces of carbon material candidates
由图9 可见,在同一碳材料表面,Cu2+与Cu+以及Fe3+与Fe2+两组离子中的高价离子具有更高的吸附能,说明金属原子的轨道填充情况显著影响其被吸附捕集的可能性,这为筛选碳材料进行单一离子的选择性吸附提供了可能。
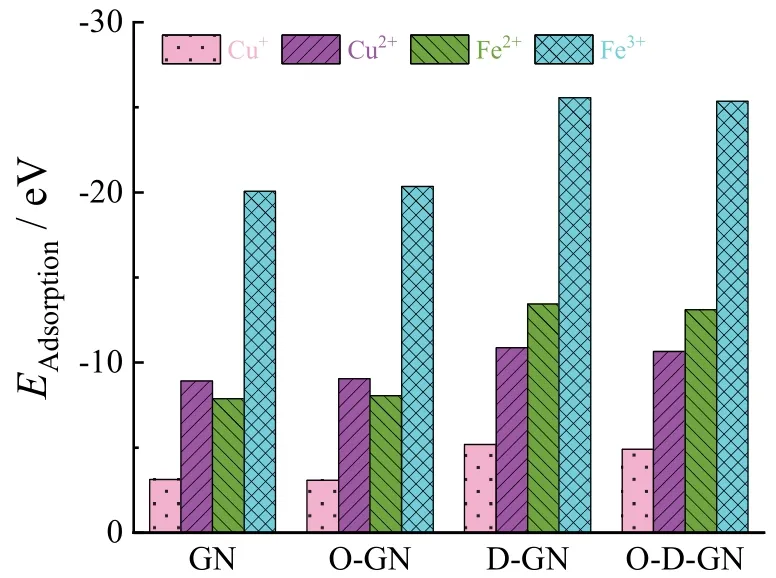
图9 待选碳材料表面金属离子Cu2+、Cu+、Fe3+和Fe2+的吸附能Figure 9 Adsorption energy of Cu2+, Cu+, Fe3+, and Fe2+ on the surfaces of carbon material candidates
本节的教学示范与训练主要是探究缺陷与杂原子对石墨烯基碳材料吸附微塑料性能的影响,要求学生建立杂原子或缺陷石墨烯,从结构稳定性、量子化学性质以及对水中微塑料的吸附稳定性出发,进一步掌握量子化学计算在材料设计与污染物吸附方面的操作。
3 总结与练习
将计算化学手段引入硕士研究生的“环境纳米技术”课程中的必要性在以电镀废水中金属离子吸附回收所用碳材料的筛选及作用机理研究的教学范例中得到了充分的展现。
根据环境科学与工程、环境工程硕士研究生的专业特点与科研方向,要求学生掌握通过量子化学计算来设计材料、研究作用机理的基本技能,并用于理论学习与课题开展的具体实践环节。课后安排学生以水中微塑料等有机污染物、工业废气中的挥发性有机物(VOCs)等为研究对象,以常见捕集材料为例,开展材料设计与筛选,要求所设计的材料达到单一污染物高选择性吸附的目的。

