RAGE敲除对AGEs-RAGE轴诱导血管平滑肌细胞线粒体动力学变化的影响机制研究
孙晟甲,黄清昱,阿力木江·买买提江
(复旦大学附属华山医院心内科,上海 200040)
虽然目前对心脑血管疾病有大量深入的基础和临床研究,但其仍是全球范围内导致人类死亡的首要原因[1]。糖尿病作为冠心病的等危症,可使心脑血管疾病发病风险显著增加[2]。糖尿病是世界上最常见的疾病之一,截止目前,全球有3.82亿糖尿病患者,到2035年这个数字将上升到5.92亿,约50%~80%的糖尿病患者死于心血管并发症[3]。大量的研究已经表明 AGEs-RAGE 信号通路是糖尿病形成和发展非常重要的一环,但是其下游分子及职责十分复杂,还未完全阐明[4]。糖尿病病人体内过多的葡萄糖不能正常的消耗或者转化成其他物质,在持续血糖浓度较高条件下,可利用葡萄糖的增加,糖基化终产物(AGEs,advanced glycation end products)的生成速度明显加快,患者体内蓄积过多的AGEs,后者与细胞表面的AGEs受体(RAGE,receptor for AGEs)相互作用而发挥一系列的血管病理作用,加速糖尿病血管并发症的发生发展[5]。人体内的AGEs包括内源性AGEs 和外源性AGEs,目前体外研究AGEs主要通过两个途径获得:一种是制备AGEs类似物,例如吡咯素(Pyrraline)、戊糖素(Pentosidine)、N-(ε)-羧甲基-赖氨酸(CML)等;另一种是通过建立非酶糖基化体系模拟体内AGEs的形成过程来制备,即直接将BSA和葡萄糖放在PBS中一起孵育来制备AGEs[6]。双联RNA依赖蛋白激酶(PKR)可被多种形式的细胞应激所激活或诱导,并且很多研究证实了PKR在2型糖尿病和肥胖中的作用[7-8]。本研究通过CML-BSA处理血管平滑肌细胞,探究VSMCs细胞生理生化的变化。体外多项研究表明,糖基化终末产物(AGEs)与其信号传导受体(RAGE)介导的病理生理反应在糖尿病患者动脉重构及缺血性血管并发症的发生及发展中起到了关键作用。AGEs-RAGE轴诱导的血管平滑肌细胞(VSMCs)氧化应激反应、细胞增殖、迁移、表型转化及细胞外基质的合成,是导致糖尿病血管重构的重要病理基础[9]。然而到目前为止,临床上尚缺乏阻断RAGE效应的有效干预措施,并且调控血管平滑肌细胞RAGE表达的确切机制也尚不明了[10]。近些年的研究显示,JAK/STAT信号通路参与调控VSMCs增殖迁移及表型转化,例如,JAK2/STAT3可参与调控高血压大鼠主动脉中层VSMCs的表型转化[11];PA2(原花色素A2)可经JAK2/STAT3信号通路抑制PDGF诱导的VSMCs增殖[12]。本次研究以此为出发点,寻找RAGE效应有效阻断方法,并探讨其缺失是如何诱导VSMCs的线粒体动力学变化以及诱导机制。
1 材料与方法
1.1 材料
(1) 实验动物 3周龄C57BL/6小鼠20只,购自上海杰思捷实验动物有限公司。
(2) 小鼠血管平滑肌细胞 细胞购买于上海中科院细胞库,在20%FBS的HG/DMEM培养基,5% CO2和37 ℃培养箱中培养。经鉴定后传代至6~12代之间的细胞被用于实验。
(3) 主要试剂和仪器 试剂:胎牛血清(FBS)、高糖DMEM培养液、0.25%胰蛋白酶、Nε-(羧甲基)赖氨酸(CML)和链脲佐菌素(STZ,streptozotocin)购自美国sigma公司;磷酸化Janus激酶2/(p-JAK2)、JAK2、磷酸化信号传导与转录激活因子3(p-STAT3)、STAT3抗体、PKR抗体、Drp1抗体、Mfn2抗体购自美国abcam公司;HE染液和油红O染液购自sigma公司;细胞和组织裂解液购自碧云天生物技术有限公司;其他试剂为国产分析纯。
仪器:CO2培养箱(Thermo公司);倒置显微镜(Olympus公司);荧光化学发光成像系统(上海勤翔仪器公司);光学显微镜(Nikon公司)。
1.2 方法
(1) 细胞培养和处理 小鼠血管平滑肌细胞生长在含有20%FBS的高糖(30 mM)培养基造模,生长条件为5%CO2和37 ℃培养箱,细胞在传代至对数期时被分为3个组:CML-BSA(6 μM,24 h)的阴性对照组;阴性对照组;CML-BSA加干扰RAGE组。转染细胞前24 h在500 μL无抗完全培养基中接入8×105个细胞,转染时细胞融合度为80%~90%,用250 μL Opti-MEM稀释0.8 μg质粒DNA,轻轻吹吸混匀。轻轻颠倒混匀转染试剂,用250 μL Opti-MEM稀释2.0 μL Lipofectamine2000,轻轻混匀,室温静置5 min。混合转染试剂和质粒DNA稀释液,轻轻吹吸混匀,室温静置20 min。转染复合物加入到6孔细胞板中,前后摇晃细胞板混匀,将细胞板置于37 ℃,5%CO2培养箱转染6 h后换成正常完全高糖(30 mM)培养基培养。继续培养48 h后胰酶消化,1 500 r/min离心5 min收集细胞沉淀用于载体验证和Western blot实验。
(2) 干扰RAGE基因的小片段双链载体的构建
靶点1 sequence:TGGCAAAGAAACACTC-GTGAA
Top5′gatccgTGGCAAAGAAACACTCGTG-AATTCAAGAGATTCACGAGTGTTTCTTTGCCA-cTTTTTTg-----3′
Bottom5′aattcAAAAAAgTGGCAAAGAAACACTCGTGAATCTCTTGAATTCACGAGTGT-TTCTTTGCCAcg-----3′
靶点2 sequence:GAGCTGAATCAGTCA-GAGGAA
Top5′gatccGAGCTGAATCAGTCAGAGGA-ATTCAAGAGATTCCTCTGACTGATTCAGCT-CTTTTTTg-----3′
Bottom5′aattcAAAAAAGAGCTGAATCAG-TCAGAGGAATCTCTTGAATTCCTCTGACTG-ATTCAGCTCg-----3′
靶点3 sequence:GCAGCTAGAATGGAA-ACTGAA
Top5′gatccGCAGCTAGAATGGAAACTGA-ATTCAAGAGATTCAGTTTCCATTCTAGCTG-CTTTTTTg-----3′
Bottom5′aattcAAAAAAGCAGCTAGAATGGAAACTGAATCTCTTGAATTCAGTTTCCAT-TCTAGCTGCg-----3′
(3) 实时定量PCR(RT-PCR)检测RAGE mRNA的表达 RT-PCR检测以β-actin为内参,按照Trizol说明书提取细胞总RNA,按照逆转录试剂盒合成cDNA,采用RT-PCR检测RAGE shRNA的mRNA表达水平,以筛选最佳干扰的shRNA。
(4) Ⅱ型糖尿病小鼠造模 实验前,所有小鼠在(25±1) ℃、(55±5)%湿度条件下,按常规的12 h/12 h的明暗周期饲养2周,以适应环境。雄性C57BL/6小鼠20只,分为对照组和敲基因组,3周龄,高脂饲喂(脂肪含量30%)后第3周起间隔3日腹腔内注射2次STZ,每次85 mg/kg,通过空腹血糖检测和OGTT实验证实建模成功。实验分组和干预,在确定造模成功的基础上将小鼠随机分为3组:模型组、野生对照组、干扰+模型组,每组5只,干预2周后处死小鼠,留取主动脉标本。
(5) 免疫荧光染色 小鼠主动脉免疫荧光检测 标本用4% PFA固定,然后OCT包埋和切片,PBS漂洗,0.5% Txiton X-100室温下处理5 min后采用TBST漂洗,于室温下封闭1 h;孵育一抗:用0.1%BSA/TBST配制并于4 ℃ 孵育过夜,0.1%BSA/TBST漂洗(5 min×3遍);孵育荧光二抗:用含0.1% BSA/TBST配制,于室温孵育 2 h,0.1% BSA/TBST漂洗(5 min×3遍),加适量DAPI工作液,室温避光孵育5 min,PBS漂洗后封片剂封片,荧光显微镜下拍照。
(6) Western blot检测 取培养好的细胞和从小鼠体内取出的组织,用冰PBS洗涤3次。取适当量的裂解液,在使用前数分钟内加入PMSF,体积比为1∶100。在4 ℃冰箱裂解20 min。于4 ℃离心机以11 000 r/min离心10 min,取上清。采用BCA法进行蛋白定量。将准备好的样品和蛋白质Marker(10~180 KD)分别上样电泳。电泳条件为浓缩胶恒压80 V,约20 min;分离胶恒压 120 V,通过预染蛋白 Marker 来确定电泳停止时间。之后将蛋白转至NC膜上,转膜条件为恒压100 V,时间1 h,5%脱脂奶粉室温封闭1 h,加入稀释好的一抗抗体,4 ℃过夜。二抗室温1 h振荡孵育。最后ECL化学发光曝光显色。进行3次曝光,选择3次曝光的重叠值。
(7) 小鼠主动脉HE染色 取已固定的主动脉标本,经脱水→透明→透腊→包埋→切片→展片→捞片→贴片→烤片等步骤进行染色前的准备,然后经脱蜡→水化→染色→脱水→透明→封片等步骤,最后用光学显微镜进行拍照分析。
(8) 小鼠主动脉油红O染色 取油红O干粉0.4 g加入到10 mL异丙醇中,密封,置于37 ℃水浴加温,使其充分溶解,配制成油红O干液。以V干液∶V三蒸水=3∶2比例混合均匀,取滤液作为油红O染液新鲜染液。标本用PBS洗3次,用滤纸吸去多余水分,50%异丙醇固定1 min,油红O染色液染色15 min;60%异丙醇洗去多余染液,三蒸水冲洗3次;显微镜下观察并拍照记录。
(9) 统计学方法 每组实验重复3次,采用SPSS19.0软件进行统计学处理,所有数据以均值±标准方差表示,组间采用单因素方差分析和t检验。P<0.05认为存在显著性差异,P<0.01认为存在极显著性差异。
2 结果
2.1 脂质体法介导质粒转染到小鼠血管平滑肌细胞
细胞转染48 h后,在倒置荧光显微镜下观察细胞,可见到部分细胞发出绿色荧光,表明质粒已经成功转染到小鼠细胞中,之后我们收集细胞沉淀提取细胞中的RNA和蛋白用于RT-PCR和Western blot实验,验证RNA干扰质粒是否有效抑制RAGE基因的转录和翻译,结果如图1所示。由图1可知,经过3组shRNA干扰后,RAGE基因在分子和蛋白水平表达量降低,但是第二组的干扰效率最高,和对照组相比P<0.01,所以接下来的细胞实验是在shRNA2干扰基础上完成。
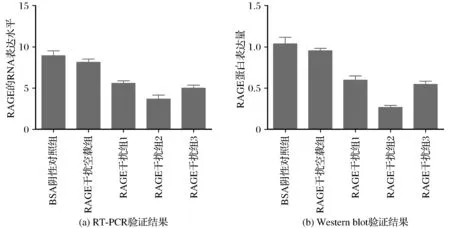
图1 RT-PCR和Western blot验证干扰RNA的效果Fig.1 Effect of RNA interference verified by RT-PCR and Western blot
2.2 RAGE基因下调能够降低VSMCs细胞DRP1蛋白的表达
通过对各组小鼠血管平滑肌细胞进行免疫荧光染色检测,与阳性对照组相比,阴性对照组线粒体动力相关蛋白DRP1蛋白表达量明显降低(P<0.01),见图2。
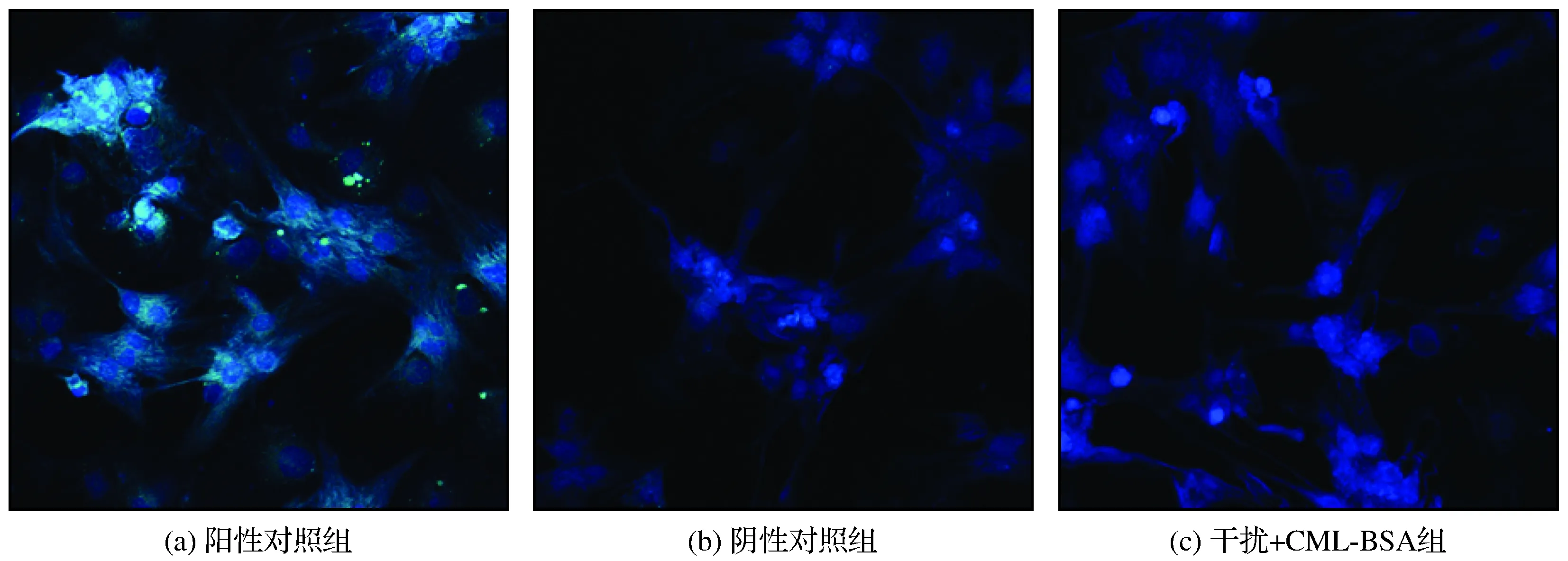
图2 RAGE干扰对VSMCs细胞DRP1蛋白表达的影响Fig.2 Effects of RAGE interference on DRP1 protein expression in VSMCs cells
2.3 RAGE基因敲除后影响线粒体相关蛋白以及JAK2/STAT3等蛋白的表达
通过脂质体转染法将shRNA2转染到小鼠血管平滑肌细胞,细胞转染后实验组用CML-BSA刺激,然后收集细胞沉淀,裂解后检测相关蛋白的表达,结果如图3所示。RAGE基因敲除后,线粒体动力相关蛋白DRP1和PKR蛋白表达量显著降低,并且伴随着JAK2/STAT3磷酸化水平升高。
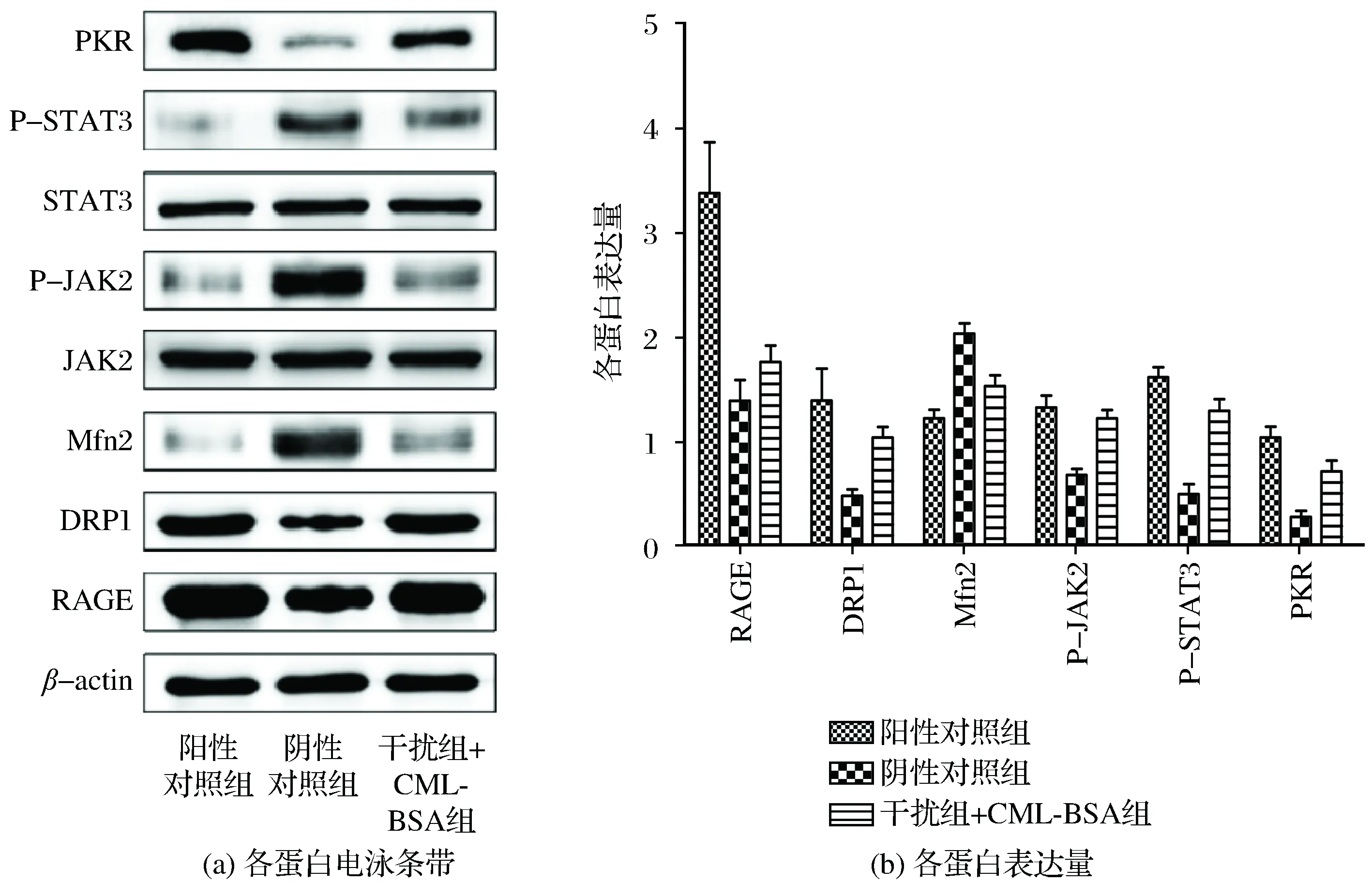
图3 RAGE基因干扰后线粒体相关蛋白的表达Fig.3 Expression of mitochondrial related proteins after RAGE gene interference
2.4 RAGE基因沉默对小鼠血管平滑肌动脉内中膜厚度的影响
用RAGE干预2周后处死小鼠,留取主动脉进行主动脉标本固定并切片后进行HE染色,然后测定内中膜厚度(IMT),结果如图4所示。实验结果表明,模型组IMT很厚,RAGE基因敲降后糖尿病小鼠的IMT厚度明显减小(P<0.05)。

图4 HE染色观察VSMCs细胞IMT的变化Fig.4 Observation of IMT changes of VSMCs cells by HE staining
2.5 油红O染色定性RAGE基因敲除评估斑块面积的变化
油红O染色定性RAGE基因敲除评估斑块面积的变化如图5所示。由图5可知,在脂肪沉积过程中,RAGE 是一个重要的转录调控因子,在糖尿病小鼠中敲除RAGE基因后,小鼠血管脂肪层厚度明显减弱(P<0.05)。
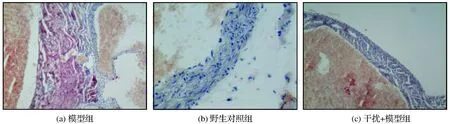
图5 油红O染色定性评估平滑肌组织斑块面积Fig.5 Qualitatively evaluated the plaque area of smooth muscle tissue by oil red O staining
2.6 RAGE缺陷型糖尿病小鼠中线粒体动力相关蛋白的表达
通过Western blot分析,首先确认RAGE缺陷型糖尿病小鼠RAGE蛋白表达水平下降,与模型组相比DRP1、PKR蛋白表达水平降低(P<0.05),Mfn2以及JAK2/STAT3通路相关的磷酸化蛋白表达升高,这也与细胞水平上相关蛋白表达相似(见图6)。
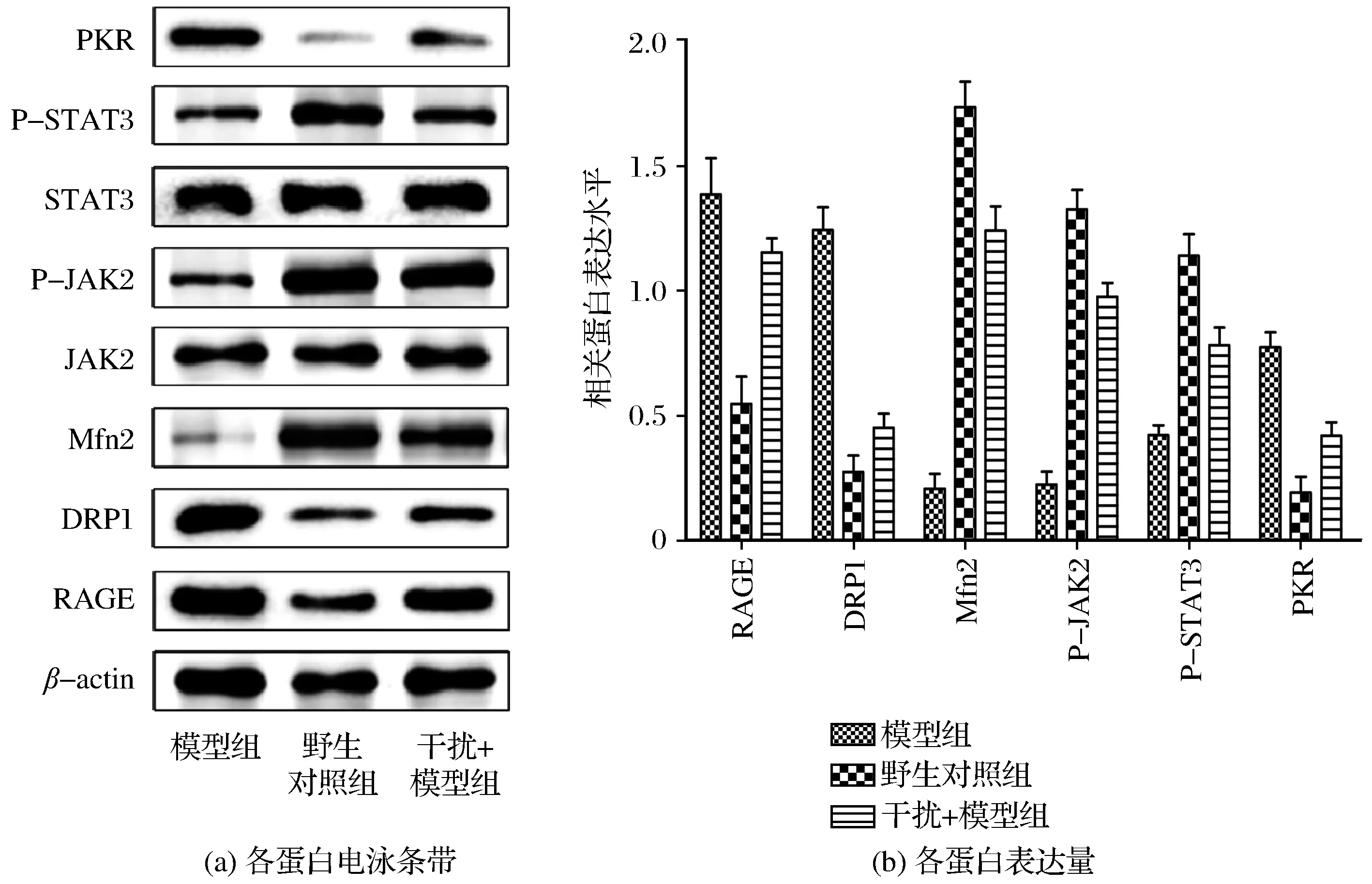
图6 Western blot分析基因敲除小鼠线粒体动力相关蛋白的表达Fig.6 Expression of mitochondrial motion-related proteins in knockout mice was analyzed by Western blot
3 讨论
在糖尿病患者中,VSMCs的增殖迁移是加速患者动脉粥样硬化的重要原因之一,并且VSMCs也是构成血管壁的主要细胞成分之一,因此,抑制VSMCs的增殖和迁移是治疗糖尿病动脉粥样硬化的重要举措[14]。晚期糖基化终产物(AGEs)是蛋白慢性非酶糖基化的产物,其在糖尿病等其他病症患者体内表达水平偏高。与此同时,研究显示线粒体动力学与糖尿病心肌病密切相关[15]。线粒体是细胞的能量工厂,同时线粒体通过不断地融合和分裂来保持其自身的稳态,这些精确调控的完成离不开线粒体动力相关蛋白(DRP1)和线粒体融合蛋白Mfn2等其他蛋白,一旦这些蛋白表达不平衡,线粒体动力学的稳态可能会受到影响,进而导致一些疾病的发生或发展[16]。目前已有研究提示PKR可通过调控JAK2/STAT3信号通路影响细胞增殖。RAGE是晚期糖基化终产物的特异性受体,但是AGEs-RAGE诱导VSMCs增殖和线粒体过度分裂过程中PKR是否参与其中,尚无文献支持,而且RAGE基因表达的改变是否会影响线粒体动力学相关蛋白表达还不确定。
为了探究这些蛋白质的表达水平,研究采用AGEs体外干预RAGE沉默的小鼠血管平滑肌细胞,对线粒体动力学两种重要的蛋白DRP1和Mfn2以及JAK2/STAT3通路蛋白进行Western blot分析,同时用免疫荧光染色检测细胞内DRP1蛋白的表达水平。结果发现干扰RAGE基因后,细胞内DRP1的表达水平明显降低,Western blot结果表明RAGE基因干扰能降低AGEs-RAGE轴对线粒体动力学相关蛋白的影响,其可能的机制是通过降低PKR表达水平进而提高JAK2/STAT3信号通路磷酸化的水平。体内实验首先建立敲基因小鼠的糖尿病模型,然后使用AGEs诱导,HE和红油O染色发现,和对照组相比RAGE基因敲除可以降低小鼠血管平滑肌动脉内中膜厚度,而且小鼠的平滑肌动脉成脂能力明显减弱。Western blot结果表明敲除小鼠RAGE基因后,DRP1和PKR表达水平显著降低,STAT3和JAK2磷酸化表达水平明显升高,这与细胞水平表达结果趋势相同。JAK2/STAT3信号通路的发现距今有30多年的历史,它不仅与肿瘤、肝脏、心脏等方面疾病相关,近些年发现与糖尿病及并发症也具有一定的相关性[17]。RAGE基因敲除能显著引起P-STAT3和P-JAK2蛋白表达升高,提示RAGE敲除能引起JAK2/STAT3信号通路激活。
通过血管平滑肌细胞组织特异性RAGE敲基因小鼠和干扰RNA技术阻断RAGE的效应,以明确RAGE的调控作用。研究结果显示,RAGE基因沉默对AGEs-RAGE轴诱导的线粒体动力学的变化以及细胞的成管和成脂有抑制作用,该抑制作用与JAK2/STAT3通路的激活有关。

