Sox基因家族在水生动物性腺发育中的功能研究进展
徐东杰,谢 熙,王蒙恩,王振亚,朱冬发
(宁波大学 海洋学院,宁波 315211)
性腺发育对水生动物的繁殖与种群延续至关重要。水生动物的性腺发育包括原始性腺的形成、性腺的分化、发育以及成熟等生理过程[1]。其中Sox基因家族作为一类保守的转录调控因子,在水生动物性腺发育中起关键的作用[2]。Sox基因家族广泛存在于无脊椎动物和脊椎动物之中,其产物包含一个具有DNA结合能力的高迁移率结构域(high-mobility group box, HMG-box)。目前已鉴定得到的Sox基因家族成员有40多种,可分为A~K 11个亚族,被报道参与调控胚胎、性腺及神经系统的发育,以及心脏、血管和骨骼的发生等多项生长发育过程[3]。本文对Sox基因家族的发现、鉴定及分类进行了概述,并对其在水生动物性腺发育中的功能研究进展进行综述,以期为更好地研究水生动物Sox基因家族调控方式和具体功能提供参考,为深入研究并进一步完善水生动物的性腺发育调控机制提供基础资料。
1 Sox基因家族的发现与鉴定
最早得到鉴定的Sox基因家族成员是SRY(Sry)基因即Y染色体上的性别决定基因,现已被确定为哺乳动物雄性性别决定的首要基因,对睾丸的正常发育有着决定性的影响[4-5]。它含有一个编码79个氨基酸的DNA结合区域,由于该区域与细胞核内染色体中非组蛋白HMG同源,故称为HMG-box结构域[6]。它能够识别和结合特异的顺式作用元件,进而调控靶基因的时空转录[7]。随后,在其他转录因子中也发现了与SRY(Sry)基因的HMG-box高度同源的结构域,因此统称为SRYrelatedHMG-box(Sox)基因家族[8-9]。Sox基因家族是最直接调控早期胚胎、性腺和神经系统发育的基因,同时也参与了毛发、心脏、血管及骨骼等多种组织器官的形成[10-11]。
早期研究通常以HMG-box区域的氨基酸序列与SRY(Sry)基因的相似性来鉴定新的Sox基因[12]。但随着Sox基因家族成员的不断增多,仅仅以氨基酸序列的同源性作为鉴定标准并不完善[3]。通过对所有已发现的Sox基因进行全面比较和系统分析,发现其HMG-box结构域中5~13位点的氨基酸残基序列即RPMNAFMVW在每个物种中十分保守,除SRY(Sry)基因以外的Sox基因家族成员都存在这一核心基序,该序列可以作为鉴定Sox基因家族目前最合理的标准[6,13]。
2 Sox基因家族的分类与进化
目前,根据结构和功能的不同以及同一亚族内不同Sox基因在其HMG-box区域的氨基酸序列相似性大于80%的原则,Sox基因家族可分为A~K共11个亚族。Bowles等[6]将Sox基因家族分为A~H共8个亚族。B亚族成员根据其氨基酸全长序列相似性和功能上的差别又可分为B1、B2两组,随着Sox基因的不断增加,分别在非洲爪蟾(Xenopuslaevis)、秀丽隐杆线虫(Caenorhabditiselegance)和青鳉(Oryziaslatipes)中发现Sox31、SoxJ、Sox32新成员,将其分别归入I、J和K这3个亚族中[3]。每个亚族包括了一个到多个成员:除A(Sry)、G(Sox15)、H(Sox30)、I(Sox31)、J(SoxJ)和K(Sox32)亚族只包括一个成员外,其他亚族均有多个成员组成,如B亚族包括B1组的Sox1、Sox2、Sox3及B2组的Sox14和Sox21成员,E亚族包括Sox8、Sox9和Sox10成员[3,11]。
迄今在鱼类、两栖类、爬行类、鸟类和哺乳类中发现了至少40种Sox基因,并且其编码氨基酸都含有保守性较高的HMG-box,这充分说明Sox基因家族成员在进化上具有超强的保守性[14]。Sox基因不同亚族间的HMG-box区以及同一亚族HMG-box区外均具有保守性和同源性。同一亚族内HMG-box区高度保守其相似性在80%以上,但不同亚族之间HMG-box相似性明显的低于80%(大于46%),并且在其他区域也几乎没有相似性[13]。同一亚族Sox基因在HMG-box区外也存在较大相似性:在一些亚族中,HMG-box相邻两侧序列也是十分保守的,如B亚族成员在HMG-box区外C末端的8个氨基酸基序是非常保守的;而C,E亚族成员的保守区域则位于HMG-box区外的N末端;D亚族成员的保守区域包括位于HMG-box区域之外的亮氨酸拉链基序、谷氨酸丰富区域和螺旋-螺旋区域[3]。这种基序及结构上的相似性表明,同族基因具有共同的进化起源,Sox基因家族的功能在不同物种中也可能具有保守性[15]。
关于Sox基因的系统进化,多数学者认为,它们是由一个共同的祖先经过重复、散布、突变等一系列作用而产生的,其中HMG结构域序列在复制过程中,通过结合之前存在的功能域形成嵌合蛋白后而快速获得了新的功能[3,13]。这种变化从某种程度上阐明了Sox基因不同亚族的起源,从而产生了今天所见到的Sox蛋白的分布状况[15]。
3 Sox基因家族在水生动物性腺发育中的作用
3.1 鱼类
哺乳动物原始的性腺具有双向分化的潜能,因此其可以分化为精巢或者卵巢[16]。当原始未分化的性腺出现后,与性别分化相关的一系列基因启动转录,首先SRY(Sry)基因被激活,促进了支持细胞的发育;而后,Sox9基因开始转录表达[17]。在SRY(Sry)、Sox9、Wt-1和Sf1等基因的共同调节下,抗缪勒氏管激素基因(Anti-Müllerianhormone,Amh)开始表达,使原始性腺朝着雄性睾丸方向发展[18]。与此同时,Dosage-sensitivesexreversaladrenalhypoplasiacongenital,criticalregionontheXchromosomegene-1(Dax-1)基因可以抑制Amh基因的表达,从而使原始性腺朝着雌性卵巢方向分化[19]。目前研究发现SRY(Sry)同源片段在鱼类性别决定中没有起到决定性作用,这可能是由于鱼类性别决定机制的复杂多样性所致[2]。在鱼类中已经发现B1、B2、C、D、F、G、H和K等亚族成员,其中主要是E家族的Sox8、Sox9基因和B1家族的Sox3与鱼类的性腺发育密切相关(表1)。
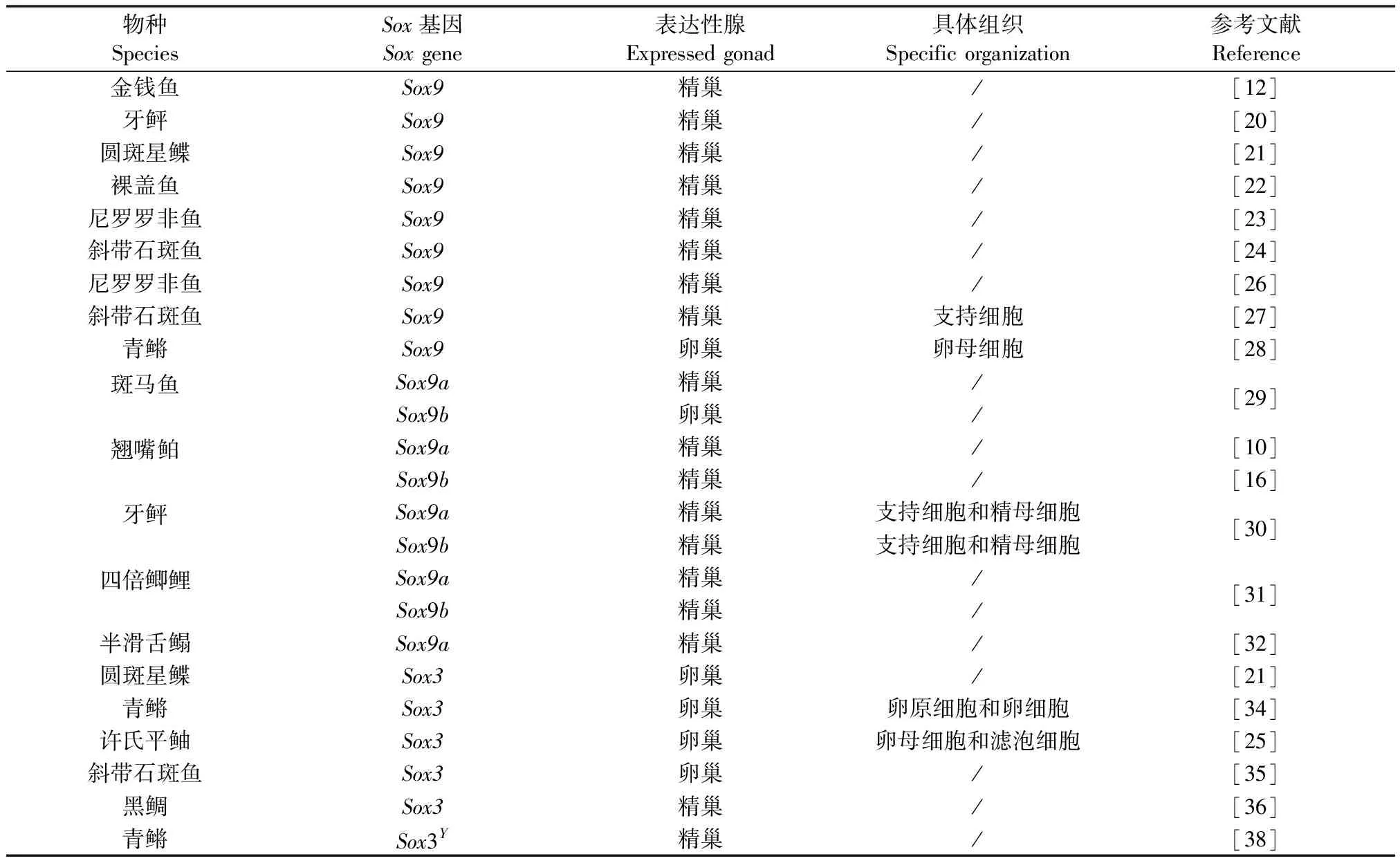
表1 Sox基因在调控鱼类性腺发育中的作用研究汇总
3.1.1SoxE亚族基因
Sox8和Sox9基因在调控鱼类的性腺发育中具有重叠功能,Sox8可以替代Sox9的部分功能。但二者中Sox9起主导作用,且其更倾向于鱼类的雄性精巢发育[2]。大量研究表明Sox9基因在金钱鱼(Scatophagusargus)[12]、牙鲆(Paralichthysolivaceus)[20]、圆斑星鲽(Veraspervariegatus)[21]、裸盖鱼(Anoplopomafimbria)[22]、尼罗罗非鱼(Oreochromisniloticus)[23]和斜带石斑鱼(Epinepheluscoioides)[24]等成体性腺中显示出性别两相性差异,在精巢中的表达量显著高于卵巢。马丽曼[25]在许氏平鲉(Sebastesschlegeli)中发现,Sox9基因在出生后25日龄(性腺分化时期)时的表达量达到较高的水平可能与仔鱼性腺分化有关;而Ijiri等[26]发现Sox9基因仅在尼罗罗非鱼精巢分化的后期特异性表达,可能参与精巢后期的发育过程。在斜带石斑鱼中,Xia等[27]通过免疫荧光定位发现Sox9基因仅存在于精巢的支持细胞中,暗示其可能参与了精子的发生过程;但在青鳉中,Yokoi等[28]通过Northern杂交和原位杂交分析却发现Sox9基因仅在卵巢的卵母细胞中表达,表明其可能参与了卵子的发生过程,在性腺发育过程中具有不同的作用方式。
斑马鱼(Daniorerio)[29]、翘嘴鲌(Culteralburnus)[10]、牙鲆[30]等鱼类的Sox9基因有两个分型即Sox9a(Sox9a1)和Sox9b(Sox9a2),且它们在性腺中的表达模式可能有所不同。Chiang等[29]发现,在成年斑马鱼中,Sox9a基因主要在精巢中表达,Sox9b基因只在卵巢中表达;但在四倍鲫鲤(Allotriploidcruciancarp)[31]、翘嘴鲌[10]和牙鲆[30]等中的Sox9a和Sox9b都只在精巢表达,而在卵巢不表达。此外,Dong等[32]在半滑舌鳎(Cynoglossussemilaevis)中发现,Sox9a在雄性脑、垂体和精巢中显著表达,在性腺分化时期表达量达到较高水平,且在原肠胚期的表达水平与其他时期具有显著性差异,这表明其对其脑-垂体-性腺轴、性腺分化、胚胎的细胞分化起重要作用;而Nakamura等[33]研究发现Sox9b并不直接参与青鳉性腺的分化,在生腺细胞增殖和存活方面发挥着重要作用。
3.1.2SoxB亚族基因
Sox3基因属于B1亚族成员,更倾向于鱼类雌性卵巢的发育。张乐乐[21]通过性腺切片实验和荧光定量PCR发现Sox3基因在性腺中的表达显示出性别两相性差异,其在卵巢中的表达量显著高于精巢,而且在性腺分化时期表达量显著上升,暗示其可能参与圆斑星鲽幼鱼性腺分化过程。这与青鳉、许氏平鲉和斜带石斑鱼Sox3基因的研究结果相似,浦权[34]通过原位杂交发现青鳉Sox3基因存在于卵原细胞和早期卵细胞,以及后期卵细胞的颗粒细胞和膜细胞中;马丽曼[25]利用原位杂交发现许氏平鲉Sox3基因主要定位在卵巢的卵母细胞和滤泡细胞中;Zhou等[35]在雌雄同体斜带石斑鱼中也发现其在卵子发生过程中起着非常重要的作用。而Shin等[36]的研究结果与他们不同,通过研究黑鲷(Acanthopagrusschlegelii)性逆转过程中Sox3基因的表达模式,发现其在成熟的精巢中表达量最高,在精巢发育中的作用可能强于卵巢。
此外,因Sox3与SRY(Sry)基因序列的相似性最高,Graves等[37]认为Sox3基因是性别决定相关的关键基因,在XX/XY 型性别决定的生物中Sox3基因位于X染色体上。而Takehana等[38]却发现了一个存在于Y染色体上的Sox3Y,其在青鳉的性别决定中发挥了重要的作用。Sox3Y在XX个体中过表达或者在XY个体中缺失都会导致性逆转的发生,因此Sox3Y被认为是青鳉的性别决定基因。这些研究结果表明Sox基因家族在鱼类性腺发育中发挥着重要的作用,但在不同物种中的作用不同,可能与鱼类复杂多样的性别决定机制有关。
3.2 甲壳动物
相对鱼类而言,甲壳动物在进化上更为低等,其性腺发育的遗传机制尚不清楚。但近年来的研究发现,其性腺发育同样受到B亚族和E家族Sox基因成员的调控(表2)。

表2 Sox基因在调控甲壳动物性腺发育中的作用研究汇总
E亚族成员与甲壳动物胚胎发育过程中细胞的分化、生殖腺原基的形成、性腺早期分化和后期的成熟有关,如Hu等[39]在日本沼虾(Macrobrachiumnipponense)中通过荧光定量PCR发现,MnSoxE基因在原肠胚期的表达水平显著高于其他时期,其表达量在生殖腺原基出现时期显著上升,且在雌雄幼体可以被视觉区分时雄性中表达量显著高于雌性,但在雌雄成熟性腺中并没有显著性差异。进一步的原位杂交发现其主要位于卵母细胞和精母细胞中;而Wan等[40]在拟穴青蟹(Scyllaparamamosain)中发现Sox9基因也不特异于雄性或雌性成熟性腺中,通过荧光定量PCR发现Sox9可能参与精子发生和早期卵巢发育。此外,周丽红[41]在脊尾白虾(Exopalaemoncarinicauda)中通过RNAi证实了Sox9可能与胰岛素样促雄腺激素基因(Insulin-likeandrogenicglandhormone,IAG)相互作用来参与精巢发育,敲除Sox9导致IAG转录水平显著降低,而敲除IAG转录水平降低导致Sox9转录水平升高。IAG是一种重要的激素,主要由促雄腺分泌,虽然甲壳动物性别决定机制尚无定论,但普遍认为其雄性性腺分化由IAG负责调控[42]。在拟穴青蟹中研究IAG和卵黄抑制激素基因(Vitellogenesis-inhibitinghormone,VIH)时,预测这两个基因的上游调控区域中转录因子都含有Sox9和Sry等[43]。随后Liao等[44]通过双荧光素酶报告基因系统和RNAi等实验,证实了Sox9可能通过与VIH基因的相互作用来调控拟穴青蟹的卵巢发育等生理过程。
B亚族Sox基因在甲壳动物胚胎发育过程中细胞的分化、卵巢发育过程中也发挥着重要作用,如亓海燕等[45]在中华绒螯蟹(Eriocheirsinensis)中扩增出一个只在性腺中特异表达的EsSox21b-like基因,其只在精巢、成熟的卵巢有表达,在成熟卵巢中的表达量高于精巢。这表明它可能参与调控性腺的发育过程,而它从卵巢成熟时开始有较弱表达,到排出的卵子中有较强表达的现象还说明它有可能参与早期胚胎的发育过程;这与梁可蓥等[9]在拟穴青蟹的研究中一致,通过实时定量PCR,发现同为B2亚族的Sox14基因在雌蟹卵巢中的表达量远高于其他组织,在性腺发育周期中其mRNA高表达于卵黄发生前期,暗示其参与卵巢的前期发育等生理过程的调控。而Liu等[46]又在中华绒螯蟹中克隆出一个在性腺中特异表达的B2亚族成员EsSoxB2-1基因,其蛋白主要在精巢中表达,甚至在顶体反应结束时也仅定位于精子细胞和精子的细胞核中,并与成熟精子核质中未浓缩的染色质结合,进一步通过RNA干扰发现敲除EsSoxB2-1基因会导致精子形成过程中细胞核的异常转化,这表明EsSoxB2-1基因与精子细胞核成熟有关,可以作为调节早期胚胎发育的转录因子染色质一起传递到受精卵中,暗示EsSoxB2-1基因可能参与调控精巢的成熟等过程。
3.3 软体动物
B和E亚族Sox成员同样参与软体动物性腺发育过程的调控。研究表明E家族Sox9基因在性腺中显示出性二态表达模式,且被认为是雄性精巢发育的相关基因,如企鹅珍珠贝(Pteriapenguin)[47]和池蝶蚌(Hyriopsisschlegelii)[48]Sox9基因在雄性性腺中的表达量显著高于雌性。但与他们研究不同的是,梁少帅等[49]在栉孔扇贝(Chlamysfarreri)中通过原位杂交和免疫组织化学技术发现,Sox9并不特异于雄性或雌性性腺中,其在成熟性细胞中表达量较少,主要集中在精母与卵母细胞中,表明Sox9基因可能参与了性腺的后期发育过程。也有报道表明B家族的Sox2基因与雌性卵巢发育密切相关,如在三角帆蚌(Hyriopsiscumingii)中该基因在雌雄性腺之间存在极显著性差异,雌性性腺表达水平显著高于雄性性腺[50]。
此外,在软体动物的研究中,H亚族的SoxH基因HMG box与脊椎动物Sox30、SRY(Sry)同源性较高,鉴于Sox30和SRY(Sry)基因在脊椎动物中参与调控精巢的分化,推测其在软体动物雄性性腺分化中也发挥着重要作用[51]。研究表明SoxH具有较强的组织特异性,且在雄性性腺中高表达,在虾夷扇贝(Patinopectenyessoensis)中,Zhou等[52]认为Dmrt1基因是调控虾夷扇贝性腺分化的关键基因,它的表达会激活Sox30等基因,进而调控Tbx4和Hsfp基因的转录,从而促进精巢的分化。若Dmrt1基因关闭,则Cyp1a4、Foxa2和0vo等基因激活转录,刺激Vg、Fuc-t的转录和表达,进而调控卵巢的分化。而在太平洋牡蛎(Crassostreagigas)中,SoxH基因能够直接或间接地与促进雄性性腺发育的Dsx基因相互作用,SoxH基因的表达会激活Dsx基因而导致雄性性腺的分化;而在某些雄性中,Foxl2异常高表达,SoxH和Dsx低表达会导致由雄性逆转为雌性[53]。

表3 Sox基因在调控软体动物性腺发育中的作用研究汇总
3.4 扁形动物和腔肠动物
在扁形动物中,已发现的Sox基因很少,大多都是参与再生过程中神经系统的形成。如在日本三角涡虫(Dugesiajaponica)克隆的SoxB基因,在再生过程中参与了干细胞增殖、组织分化及极性的构建,特别是在再生早期起重要作用[6]。因而,需要进一步的实验来验证Sox基因能否调控性腺的发育。在腔肠动物中,暂未发现Sox基因的报道。
4 展望
综述Sox基因家族在鱼类、甲壳动物和软体动物等水生生物性腺发育调控中的研究进展,发现SoxE亚族和SoxB亚族基因在水生动物性腺发育中具有保守作用,广泛参与原始性腺的形成、性腺的分化、配子发生和性腺成熟等生理过程。但目前,水生动物Sox基因家族的研究还主要以分析其组织分布特点和表达谱系模式为主,其具体的生理功能和作用机制还有待进一步深入研究,这将有助于我们进一步理解Sox9等基因在不同物种中功能上的差异性以及Sox基因家族的功能进化过程。此外,作为一类保守的转录调控因子,Sox基因家族成员之间是否存在相互的调控关系在水生动物相关研究中很少被提及,全面深入地功能研究对揭示基于Sox基因家族的分子调控网络也具有重要意义。

