从海泥中分离的约氏不动杆菌聚磷特性研究
张喜昌,薛明洋,戚晓舟,冷晓飞,许淑芬 ,王高学*
(1. 大连海宝渔业有限公司,辽宁 大连 116045;2. 西北农林科技大学动物科技学院,陕西 杨凌 712100)
水体富营养化是全球十大环境问题之一。氮磷尤其是磷的输入是引起水体富营养化的关键因素。磷不仅为控制水体藻类生长丰度的重要限制因子,而且是水体富营养化的最主要的限制性因素。因此,如何除去水体中过量的磷越来越受到人们的关注。目前大规模污水处理采取的方式是化学除磷,但化学除磷剂铁盐如聚合氯化铝铁等会造成二次污染,而且投加一定量的除磷药剂之后,污水中所含的聚磷菌除磷效果明显下降甚至消失,化学除磷的方法也不适用于养殖水除磷。生物除磷由于不产生二次污染,效率高成为当前环境保护领域的研究热点。聚磷菌是一类特殊微生物的统称,广泛存在于活性污泥中,是一种非常重要的工程菌。在好氧和厌氧交替的条件下可以吸收远远超过其自身所能利用的磷,聚磷菌在厌氧条件下分解poly-P (多聚磷酸盐),同时聚集PHB (聚-β-羟基丁酸);在好氧条件下分解PHB 聚集poly-P, 从而使菌体内含有超量的磷, 以降低水体中的磷含量。常见的聚磷微生物菌群主要分布在不动杆菌属()、气单胞菌属()、假单胞菌属()、产碱杆菌属()和肠杆菌属()。
近年来,我国水产养殖的发展取得了令人瞩目的成就,养殖面积和养殖规模不断扩大。在水产集约化养殖过程中,由于养殖密度和饵料投入量增大,对水体和底泥造成严重污染,使得养殖水体含磷量严重超标。我国水产养殖多采用大引大排的方式,不仅极大的消耗了水资源,对周边水体生态环境也造成了严重的危害。为了降低水产养殖带来的环境污染,确保水产养殖业健康可持续发展,迫切需要寻求高效环保的水产养殖废水处理技术。本研究从海泥中分离出1株具有良好聚磷效果的细菌,经生理生化试验和16S rDNA序列分析,鉴定为约氏不动杆菌()。为进一步开发水产养殖生物除磷技术提供了有效菌种资源。
1 材料与方法
1.1 样品采集与培养基
海泥样本采自大连黑石礁海滩。培养基及配方为YG培养基、牛肉膏固体培养基、聚磷培养液、MOPS培养基。模拟养殖水:葡萄糖0.3 g、蛋白胨 0.1 g、酵母粉 0.01 g、NaCl 0.05 g、 MgSO·2HO 0.15 g、 NHCl 0.18 g、HO 1 000 mL,最后用NaOH或HCl调节pH,用KHPO调整磷浓度,使其磷浓度为1.5 mg/L。
1.2 聚磷菌的筛选
取20 g海泥样品用40 mL 0.35%的无菌盐水充分混匀,震荡,沉淀后取上清;将其作为原液,采用倍比稀释法将其连续稀释9倍,分别在各个稀释浓度吸取100 μL到YG平板中上,用玻璃涂布棒涂匀、编号,并做3个重复,于恒温培养箱中28 ℃培养2 d。挑出不同形态的菌落,在平板上多次划线纯化。挑取单菌落接种到YG斜面上,28 ℃培养2 d,4 ℃冰箱保存。将YG平板上分离纯化的细菌接种到MOPS限磷、过磷平板上,28 ℃培养2 d,观察蓝白斑生长情况。选取在限磷和过磷平板上都产生蓝斑的菌株划线纯化,最后得到的纯化菌即为聚磷菌。
1.3 聚磷培养基验证聚磷效果
将筛选出的聚磷菌接种到不同磷浓度(0.1 mg/L、0.5 mg/L、1mg/L、5 mg/L、10 mg/L)的培养基(250 mL)中,在28 ℃摇床中120 r/min 震荡培养。分别在24 h,48 h,72 h测定上清液磷浓度。
1.4 磷浓度的测定
磷浓度的测定用钼酸铵分光光度法。
1.5 菌种鉴定
1.5.1 菌株的生理生化鉴定 根据《常见细菌系统鉴定手册》和《一般细菌常用鉴定方法》进行鉴定。
1.5.2 16SrDNA 序列测定及比较 DNA的提取用OMEGA公司的 Bacterial DNA kit 试剂盒。引物为细菌 16S rDNA扩增通用引物 16SF(27F):AGAGTTTGATCMTGGCTCAG,16SR(1492R):GGTTACCTTGTTACGACTT。PCR 扩增体系见表1。

表1 PCR 反应体系Table 1 Reaction system of PCR
PCR反应条件:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃下延伸1 min,循环次数为30次;72 ℃最终延伸10 min。取5 μL扩增好的16S rDNA序列产物进行琼脂糖凝胶电泳检测,电泳结束后,取出凝胶放入Bio-Rad凝胶成像系统中观察扩增效果。将PCR扩增产物送至生工生物(上海)公司进行测序,所测序列在NCBI中进行同源性比对(Blast),选取同源性较高的细菌序列,利用MEGA6.0进行比对分析并构建系统进化树。
1.6 菌株聚磷特性的研究
聚磷菌的聚磷特性是否稳定对其应用过程中的聚磷效果有重要影响,本研究考察了温度、培养基初始pH对该菌聚磷效果的影响。将聚磷菌接种到培养基中分别在温度为10、15、20、25、30、35、40 ℃的条件下恒温震荡培养2 d。分别测定上清液磷浓度,磷浓度的测定同1.4中所示。用1 mol/L的盐酸和氢氧化钠溶液将培养基的pH分别调整为5、6、7、8、9,每个pH设三个平行,然后将该菌接入到该培养基中(磷浓度为1.5 mg/L)中,28 ℃摇床中120 r/min 震荡培养2 d。分别测定上清液磷浓度,磷浓度的测定同1.4中所示方法。
1.7 模拟养殖水中的聚磷效果
在实验室人工模拟养殖水(磷浓度为1.5 mg/L),将培养好的聚磷菌菌液浓度调整为1×10cfu/mL,以体积比1∶50、1∶100、1∶1000、1∶10000的比例接入该聚磷菌菌液,在28 ℃摇床中120 r/min 震荡培养24 h和72 h后,检测上清液中磷浓度。
1.8 菌体含磷量检测
分别将筛选得到的聚磷菌和枯草芽孢杆菌接种到磷浓度为1.5 mg/L的普通肉汤培养基中,28 ℃摇床中120 r/min震荡培养2 d。菌液于9 000 r/min离心10 min,将菌体烘干后称重,并检测菌体含磷量,检测方法同(1.5)。
1.9 统计学分析
试验数据用 SPSS 17.0 统计软件的单因素方差分析进行生物学统计, 设置差异显著性水平=0.05,当<0.05 时表示差异显著。
2 结果与分析
2.1 培养基中聚磷效果
由表2可见,24 h时磷浓度为0.1 mg/L的聚磷培养基中聚磷率达到74.22%。不同浓度磷浓度中该菌的聚磷效果差异显著(<0.05)。五种不同浓度的聚磷培养基中,平均聚磷率达到67.76%。48 h和72 h时,各浓度下聚磷率都有所增加。72 h时平均聚磷率达到73.59%。
2.2 菌种鉴定
该聚磷菌菌落在牛肉膏蛋白胨培养基上呈乳白色,湿润,有光泽,边缘整齐;为革兰氏阴性菌,菌体杆状无运动性,柠檬酸、过氧化氢酶、葡萄糖试验为阳性,氧化酶、尿素酶、乳糖等试验为阴性(表3)。由图1可见,聚磷菌与(KB849237)的亲缘关系较近,聚为一分支,综合该聚磷菌的菌落形态、生理生化性质与16S rDNA序列分析结果,将该聚磷菌鉴定为:约氏不动杆菌()。

表2 不同磷浓度下该菌的聚磷效果Table 2 Removal ability of Phosphate under different concentration of this strain bacterium
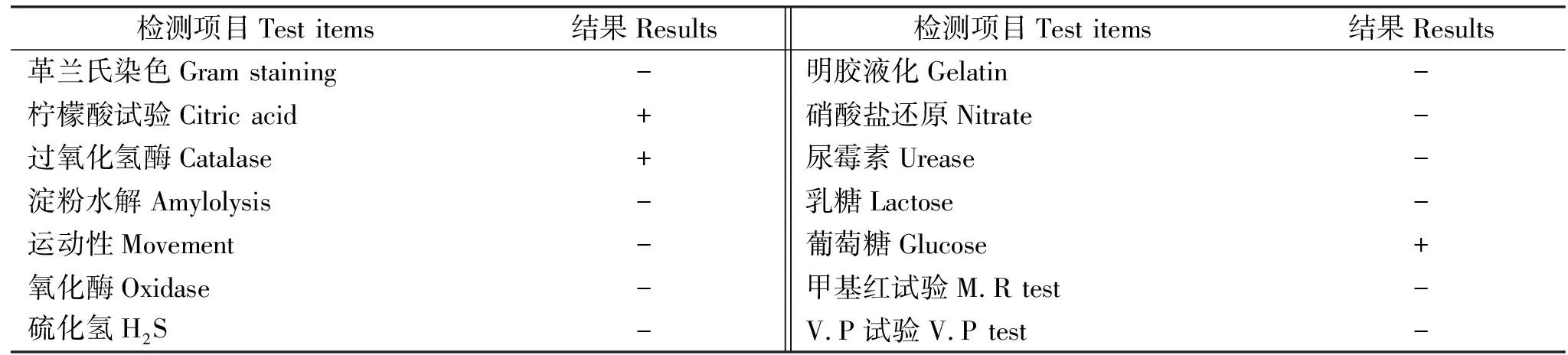
表3 该菌株生理生化鉴定Table 3 Results of physiology and biochemical tests of the strain
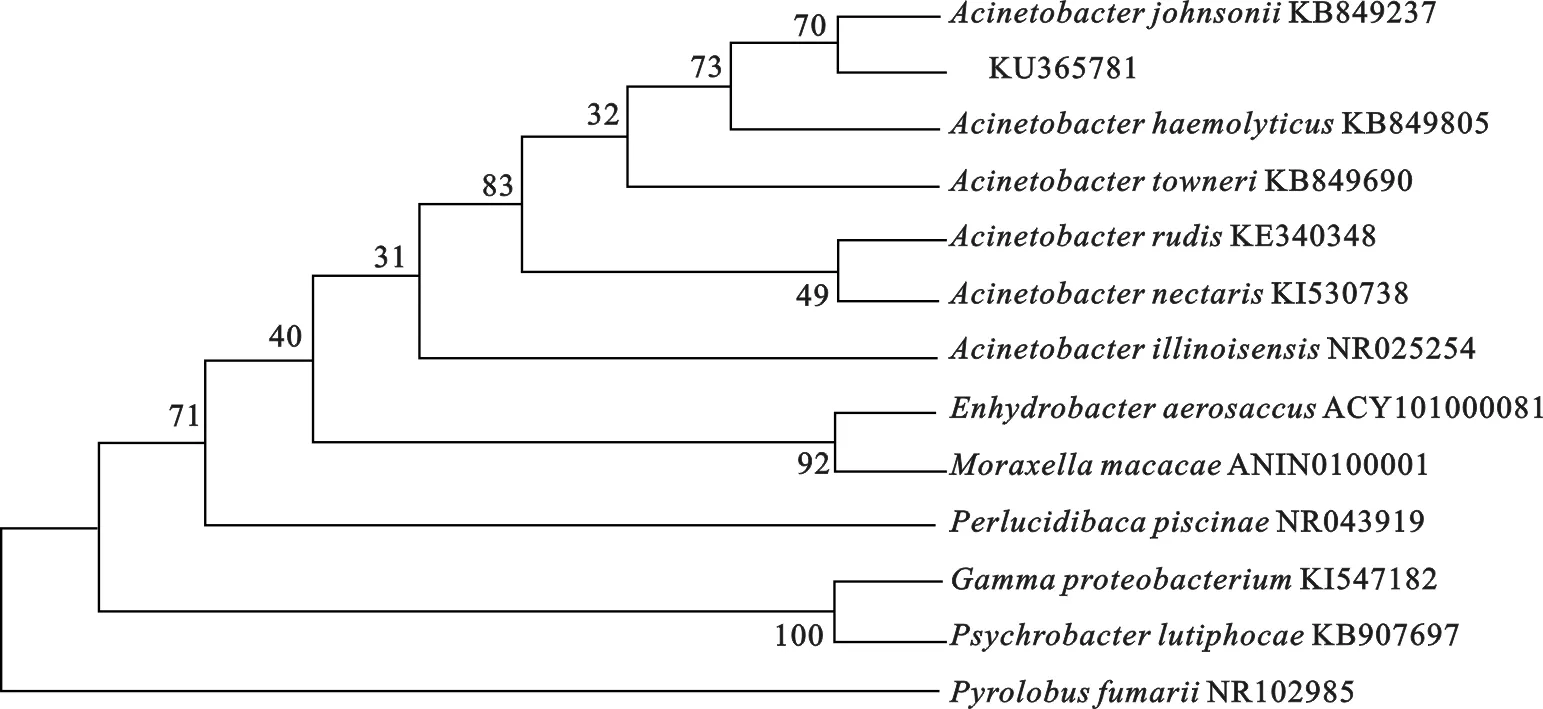
图1 聚磷菌(GenBank登录号KU365781)的系统发育树Fig.1 The phylogenetic tree of the phosphate accumulating strains
2.3 温度和pH对该菌聚磷效果的影响
2.3.1 温度对该菌聚磷效果的影响 由图2可见,当温度在28~33 ℃时,该菌聚磷效果最好聚磷率达到70%。当温度高于35 ℃或低于20 ℃时,聚磷效果较差。
2.3.2 培养基初始pH对该菌聚磷效果的影响 由图3可见,当培养基pH在7时,该菌聚磷能力最强,聚磷率达到70%。当pH小于6或者大于8时,该菌聚磷能力较差。
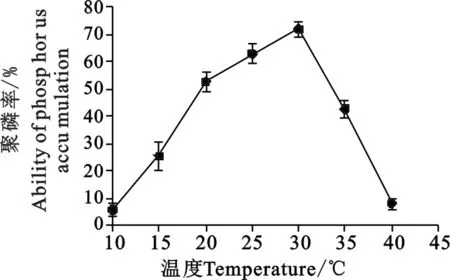
图2 温度对该菌聚磷能力的影响Fig.2 Effect of temperature on strainP accumulation capability
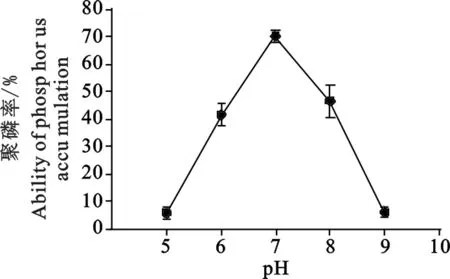
图3 初始PH对该菌聚磷能力的影响Fig.3 Effect of initial PH on strainP accumulation capability
2.4 模拟养殖水中除磷效果
在实验室人工模拟养殖水,以1∶50、1∶100、1∶1000、1∶10000的比例接入约氏不动杆菌菌液(1×10cfu/mL),28 ℃培养24 h和72 h后,检测上清液中磷浓度,磷浓度检测同(1.5)。其在模拟养殖水中聚磷效果见表4。
模拟养殖水中磷浓度为1.5 mg/L,以不同比例接入约氏不动杆菌,在24 h时,平均聚磷率为60.49%。不同比例加入约氏不动杆菌,其聚磷率差异显著(<0.05),接种比例越高聚磷率越高。72 h后,各组聚磷率无显著差异(>0.05),其平均聚磷率达到70.75%。
2.5 菌体含磷量
聚磷菌在厌氧条件下分解poly-P (多聚磷酸盐),同时聚集PHB (聚-B-羟基丁酸);在好氧条件下分解PHB聚集poly-P, 从而使菌体内含有超量的磷,达到聚磷效果。该聚磷菌在含磷培养基培养2天后菌体的含磷量达到菌体干重的7.8%,而枯草芽孢杆菌菌体的含磷量为2.2%。
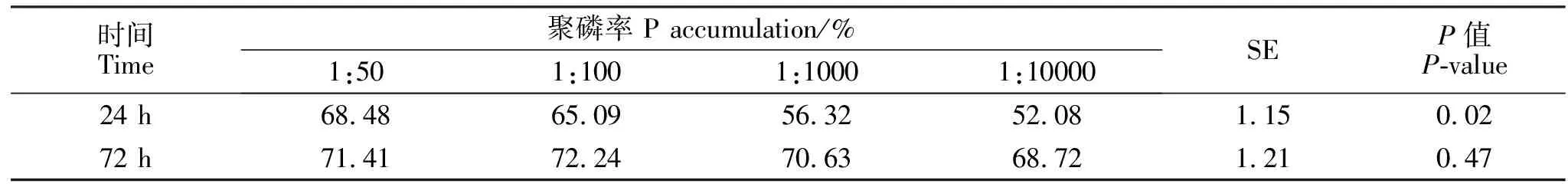
表4 模拟养殖水中该菌聚磷率Table 4 Ability of phosphorus accumulation under simulated fishery water of the strain
3 讨 论
本研究从海泥中分离出一株具有较强聚磷作用的细菌,经生理生化和分子生物学鉴定为约氏不动杆菌(A. johnsonii)。该菌在0.1 mg/L~10 mg/L磷浓度的培养基中,该菌72 h后平均聚磷率达到73.59%;当pH为6~8、温度为28~33℃条件下该菌聚磷效果最好,聚磷率能达到70%以上;在模拟养殖水中,以不同比例加入该菌, 72 h后平均聚磷率达到70.75%。
近年来,利用微生物除磷得到众多学者的关注,国内外也从不同的环境中发现了一些聚磷菌,如不动杆菌()、假单胞菌()、柠檬酸杆菌()、芽孢杆菌()等。目前,聚磷菌的种类和数目相对较少,而且生物除磷的机理研究进展也较慢。本研究发现的约氏不动杆菌平均聚磷率达到73.59%,有较强的聚磷作用。pH对聚磷菌的聚磷效果有较大的影响,一方面可能影响了聚磷菌的生长,另一方面可能抑制了聚磷相关的代谢活动。本研究中聚磷菌在28~33℃、pH6~8条件下具有良好的聚磷效果,当pH低于6或高于8时,聚磷菌的聚磷效果显著降低,与吴晓娜等研究结果相似。目前聚磷菌研究大多在生活污水处理上,而本研究中的聚磷菌是为了解决水产养殖过程中的养殖水体富营养化,养殖水体和其他污水在成分有所不同,而且养殖水体由于养殖动物的存在更适合使用生物除磷的方式。本研究在实验室模拟不同磷浓度的养殖水,进一步研究该聚磷菌在养殖水中的聚磷作用,在模拟养殖水中,以不同比例加入该菌,72 h后平均聚磷率达到70.75%,也能够发挥较好的聚磷作用。但是在实际生产中,养殖池塘和底泥中存在着复杂的微生物群落,这些微生物是否会影响聚磷菌的作用还需进一步研究。
4 结 论
从海泥中分离出1株具有良好聚磷能力的细菌,经生理生化特征及16S rDNA鉴定,确定其为约氏不动杆菌。
约氏不动杆菌具有良好的聚磷能力,在培养基和模拟养殖水中聚磷率都达到70%以上。

