页岩气集输管道生物膜的形成及腐蚀行为研究
吴虹宇 谭 鹏,2 刘汉军 邱海燕 兰贵红 王顺慧
(1. 西南石油大学化学化工学院,四川 成都 610500;2. 中国石油塔里木油田分公司监督中心,新疆 库尔勒 841000;3. 中国石油集团川庆钻探工程有限公司安全环保质量监督检测研究院,四川 德阳 618300)
0 引言
微生物腐蚀(MicrobiologicallyInfluenced Corrosion,MIC)是页岩气地面集输管道点蚀穿孔失效的主要原因[1],造成了严重的经济损失与环境污染。因此,研究MIC机理,有效地进行腐蚀防护,保障页岩气集输管道的安全运行十分重要。目前,对四川盆地的页岩气集输管道的MIC研究主要集中于SRB腐蚀,如Wu和刘华敏等[2,3]研究表明,SRB的富集是导致页岩气集输管道出现点蚀的主要原因;Liao等[4]研究认为,在低流速的集输管道中,SRB与CO2、O2和Cl-等腐蚀介质的协同腐蚀是导致集输管道出现腐蚀穿孔的主要原因。生物膜的形成是MIC发生的关键步骤之一,但对页岩气集输管道内壁形成腐蚀产物/生物膜的过程研究较少,大部分对腐蚀产物/生物膜的研究集中于海水和油田。如舒韵等[5]研究模拟海水中X80钢表面的SRB生物膜形成过程,结果表明SRB在金属表面形成的腐蚀产物/生物膜且逐渐致密的过程中,SRB的浓度上升,SRB腐蚀加剧。尚未有学者对腐蚀产物/生物膜形成过程中的主要腐蚀微生物演替变化进行研究。
因此,本研究模拟长宁区块页岩气地面集输管道环境,通过动态腐蚀挂片失重法、电化学阻抗谱图、高通量测序以及腐蚀产物形貌表征等手段,研究在L360N钢表面逐渐形成腐蚀产物/生物膜的过程中,试片表面的主要腐蚀微生物演替以及腐蚀机制变化,有利于更好地防控MIC。
1 材料与方法
1.1 实验材料
实验所用水样为四川盆地某页岩气单井压裂投产四个月后的采出水,其水质情况(mg/L)为:pH 6.6,Na+15240.00,K+571.00,Fe2+/Fe3+47.25,Ca2+769.00,Mg2+85.00,Ba2+188.90,Cl-24722.39,SO42-35.89。实验材料为页岩气开采现场外输管道所用管材L360N钢加工制成。动态腐蚀挂片实验的试片尺寸为40×13×3mm(含Φ2mm的孔);电化学测试所用工作电极尺寸为10×10×2mm。试片经打磨抛光后,依次使用丙酮、去离子水、无水乙醇清洗,称重后,紫外消毒20min。
高通量测序和腐蚀形貌观察需要使用0.2mol/L磷酸缓冲液(Phosphate Buffer Saline,PBS),PBS的配方为(g/L):5.2gNaH2PO4·H2O,58.0gNa2HPO4·12H2O,调pH值至7.4。戊二醛固定液的配方为:10mL 25%(质量分数)戊二醛,40mL无菌水,50mL 0.2 mol/LPBS溶液,调节pH为7.3。腐蚀酸洗液配方为(g/L):3.5g六次甲基四胺,500mL浓盐酸。
1.2 动态腐蚀挂片与电化学测试
根据页岩气地面集输管线的现场实际情况,设置实验条件为35℃、水相流速为0.5m/s的厌氧环境(使用高纯氮气2h对采出水进行除氧处理),分别进行周期为1、3、5、7、10、14d的动态腐蚀挂片实验。实验结束后,取出试片,使用1.1节中所配的腐蚀酸洗液除去试片表面腐蚀产物,再使用去离子水和无水乙醇清洗,称重,计算试片腐蚀速率,腐蚀速率计算公式如式(1)所示[6]:
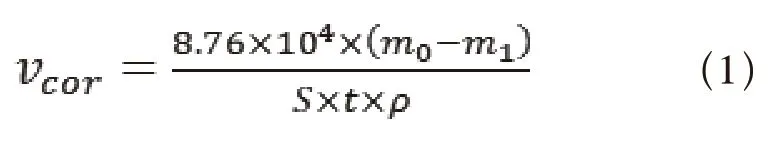
式中,vcor为腐蚀速率,mm·a-1;m0为试片初始质量,g;m1为试片除去腐蚀产物后的试片质量,g;S为试片表面积,cm2;t为腐蚀挂片实验周期,h;ρ为试片密度,g·m-3。
使用CorrTest(CS310H)电化学工作站进行电化学阻抗谱(Electrochemical Impedance Spectroscopy,EIS)测试。工作电极为L360N钢(工作面积为1cm2),辅助电极为石墨电极,参比电极为饱和甘汞电极(Saturated Calomel Electrode,SCE),设置交流激励信号振幅为5mV(vs Eocp),扫描频率范围为10-2~104Hz。EIS数据使用ZsimpWin软件进行拟合分析。
1.3 腐蚀产物/生物膜形貌及元素分析
将实验周期为3、7、14d的动态腐蚀挂片取出后,立即放入1.1节中配的戊二醛固定液浸泡4h,随后依次在25%、50%、75%、100%(体积分数)的乙醇溶液中浸泡15min,冷风吹干后进行形貌表征。采用SU3500型扫描电镜(Scanning Electron Microscope,SEM)对试片表面的腐蚀产物/生物膜进行观察,Aztec X-Max20型能谱仪(Energy Dispersive Spectrometer,EDS)进行元素能谱分析[7]。使用1.1节中配的腐蚀酸洗液和无水乙醇清洗试片后,采用SEM和ContourGT InMotion型三维光学显微镜观察试片表面腐蚀形貌,并测量试片点蚀深度。
1.4 腐蚀产物分析及高通量测序
动态腐蚀挂片试验结束后,使用X射线衍射仪(X-Ray Diffractometer,XRD)对试片表面的腐蚀产物进行定性分析。用PBS对试片表面的生物膜进行清洗,对清洗后的PBS溶液进行16S rRNA基因V3-V4区高通量测序。
2 结果与讨论
2.1 动态腐蚀失重实验与电化学测试结果
图1是动态腐蚀挂片实验的试片平均腐蚀速率图。随着时间的推移,试片的平均腐蚀速率呈下降趋势,7~14d时平均腐蚀速率维持在0.0143mm/a左右。图2是电化学阻抗谱图。通常容抗弧大小与电极表面形成的腐蚀产物膜和生物膜有关[6]。容抗弧的半径越大,电极表面的保护膜越致密,工作电极的均匀腐蚀减缓[8]。由图2(a)可知,随着时间的推移,容抗弧半径呈逐渐增大的趋势。这表明工作电极表面腐蚀产物/生物膜形成,并逐渐致密。

图1 试片平均腐蚀速率随时间的变化

图2 L360N钢在采出水中浸泡不同实验时间的电化学阻抗谱图
为更好地理解L360N钢电极表面腐蚀产物/生物膜的阻抗特性,使用ZsimpWin软件对EIS测试结果进行拟合,等效电路图如图3所示。3~14d的测试结果采用图3(b)进行拟合,1d的测试结果采用图3(a)进行拟合,拟合结果误差均<10%。在等效电路中,Rs为溶液电阻,Qf为腐蚀产物/生物膜电容,Rf为腐蚀产物/生物膜电阻,Qdl为双电层电容,Rct为电荷转移电阻。其中,Q是常相位元件,Y0为阻纳,n为弥散指数,拟合结果如表1所示。可以看出,3d后Rf值呈逐渐增大的趋势,从8.085Ω·cm-2增加到12860Ω·cm-2,这表明电极表面有腐蚀产物/生物膜形成并逐渐致密。同时Rct值的大小可以用来评价金属腐蚀程度[9],Rct值呈逐渐增大的趋势,这表明电极腐蚀程度逐渐减低,与Rf的变化规律以及动态腐蚀挂片的实验结果一致。

表1 EIS拟合数据

图3 EIS拟合等效电路图
2.2 腐蚀产物/生物膜形貌及元素分析结果
试片表面腐蚀产物/生物膜的SEM形貌表征和EDS分析结果如图4所示,试片表面的微生物和腐蚀产物逐渐增多且分布均匀,14d时试片表面形成了较致密的腐蚀产物/生物膜,其中Fe元素和S元素含量达到最高。试片表面的腐蚀产物XRD分析结果如图6所示,随着实验周期的增加,主要腐蚀产物由Fe2O3,变为Fe2O3、FeS2和FeS,14d时主要腐蚀产物为FeS,这些均为典型的SRB腐蚀产物[10]。这都表明腐蚀后期试片表面的主要MIC是SRB腐蚀。由于采出水介质中存在CaCO3悬浮物,3d和7d试片表面的腐蚀产物中检测出CaCO3。


图4 不同实验时间的试片表面腐蚀产物/生物膜SEM图和EDS分析结果图
试片的腐蚀形貌表征分别由图6和图7所示。3d时L360N试片表面主要呈均匀腐蚀形貌,局部区域有深度为3.0138μm的点蚀坑;7d时试片开始出现明显的典型点蚀形貌,局部点蚀坑深度为7.4624μm;14d时试片表面点蚀数量变多,点蚀直径变大,试片局部点蚀深度为7.8564μm。这表明,在腐蚀产物/生物膜逐渐致密的过程中,试片表面由均匀腐蚀变为点蚀,且点蚀深度和数量逐渐增加。

图6 不同实验时间的试片表面腐蚀形貌SEM图


图7 不同实验时间试片表面点蚀的三维显微镜图
2.3 腐蚀产物/生物膜细菌菌群结构变化
属水平上的群落结构组成如图8所示,采出水与试片表面腐蚀产物/生物膜的细菌菌群结构有较大差异。采出水中的主要菌属是脱硫微杆菌属(Desulfomicrobium)和嗜蛋白菌属(Proteiniphilum),而试片表面的主要菌属是假单胞菌属(Pseudomonas)、弓形杆菌属(Arcobacter)、脱硫微杆菌属(Desulfomicrobium)和脱硫化曲菌属(Desulfocurvus)。采出水中的嗜蛋白菌属(Proteiniphilum)属于产酸菌(Acid-producing Bacteria,APB),是一种严格厌氧的APB,能代谢产生有机酸腐蚀金属[11]。而试片表面相对丰度逐渐上升的假单胞菌(Pseudomonas)是一种产粘液菌(Slime-producingBacteria,SPB)菌属[12],可产生大量胞外聚合物(Extracellular Polymeric Substance,EPS),促进金属表面生物膜的形成[13]。假单胞菌(Pseudomonas)在试片表面的相对丰度逐渐上升,这意味着试片表面的生物膜逐渐增多。脱硫微杆菌属(Desulfomicrobium)和脱硫化曲菌属(Desulfocurvus)等典型的SRB菌属[14],海细菌属(Marinobacterium)、弓形杆菌属(Arcobacter)和Dethiosulfatibacter等可以代谢产生H2S的非典型SRB菌属[15-17],在试片表面的相对丰度也在逐渐上升。硫膨大杆菌属(Thioclava)和Thiomicrospira等硫氧化菌(Sulfur-oxidizing Bacteria,SOB)菌属的相对丰度在逐步降低[18,19]。

图8 微生物16S rRNA基因序列属水平分类图
2.4 成膜过程中的腐蚀机制变化
L360N试片在实验室模拟的页岩气地面集输管线的环境中(35℃、水相流速为0.5m/s的厌氧环境),由于微生物的存在,表面会逐渐形成一层较致密的腐蚀产物/生物膜。在腐蚀产物/生物膜逐渐形成的过程中,试片表面的腐蚀反应也在发生变化,如图9所示。

图9 试片表面各阶段主要腐蚀反应过程
3d时试片表面有局部腐蚀产物/生物膜形成,有SOB菌属硫膨大杆菌属(Thioclava)附着在试片表面,相对丰度为7.18%。而采出水中相对丰度为29.37%的嗜蛋白菌属(Proteiniphilum)是一种严格厌氧的APB。试片的腐蚀产物主要为Fe2O3为主,且表面呈均匀腐蚀状。这表明0~3d时,试片表面的腐蚀反应以SOB腐蚀和APB生长代谢导致的酸腐蚀为主。
有研究表明[20],Cl-浓度为30g/L时,金属对Cl-的腐蚀敏感度最高且体系中的SRB代谢活性最强,有助于SRB在金属表面形成生物膜并与Cl发生腐蚀协同作用,而采出水中Cl-含量为24722.39mg/L,这表明该体系的SRB代谢活性最强,且形成生物膜。因此,7d时试片表面的腐蚀产物/生物膜覆盖率增加,如图4(c)所示。试片表面的主要菌属为假单胞菌属(Pseudomonas)、脱硫微杆菌属(Desulfomicrobium)、弓形杆菌属(Arcobacter)、Thiomicrospira和硫膨大杆菌属(Thioclava)等,SOB、SPB和SRB菌属的相对丰度上升。试片表面的主要腐蚀产物有FeS2和FeS,并开始出现点蚀形貌。这表明试片表面的硫循环腐蚀过程加强,但腐蚀产物/生物膜的存在阻挡了Cl-的扩散[21],降低了Cl-对试片的腐蚀。因此,试片的均匀腐蚀下降,开始出现点蚀。试片表面发生的主要腐蚀反应开始由SOB腐蚀和APB导致的酸腐蚀,转变为以SRB和SOB为主的硫循环腐蚀。SRB引起的主要腐蚀[22]反应如下:

14d时试片表面形成较致密的腐蚀产物/生物膜,主要腐蚀产物为FeS,如图4(e)和图5所示。试片的主要细菌是假单胞菌属(Pseudomonas)、脱硫微杆菌属(Desulfomicrobium)、弓形杆菌属(Arcobacter)和脱硫化曲菌属(Desulfocurvus),SPB和SRB菌属的相对丰度持续增加,但SOB菌属降低。由于SRB的腐蚀产物FeS与EPS交织在一起形成腐蚀产物/生物膜,因此大多数微生物会嵌入腐蚀产物/生物膜中[23],膜下的微生物浓度较高。而腐蚀产物/生物膜下的SRB会用金属代替碳源获取电子进行生长代谢,使点蚀加剧。SRB产生的HS和H2S会与Fe2O3反应,使试片腐蚀产物以FeS为主。

图5 不同实验时间试片表面腐蚀产物XRD图
3 结语
(1)在实验室模拟的页岩气地面集输管道环境(常压、35 ℃、流体流速为0.5m/s的厌氧环境)中,L360N试片表面形成腐蚀产物/生物膜并逐渐致密。在试片表面成膜的过程中,试片均匀腐蚀速率下降,7d后稳定在0.0143 mm/a左右,试片的点蚀数量和深度逐渐上升,点蚀深度升至7.8564μm;
(2)在L360N试片表面腐蚀产物/生物膜形成并逐渐致密的过程中,试片表面的主要腐蚀细菌发生变化,SPB和SRB菌属富集,SOB菌属逐渐减少。0~3d时,试片表面主要发生APB和SOB的均匀腐蚀,尚未形成明显腐蚀产物/生物膜,主要腐蚀细菌是嗜蛋白菌属(Proteiniphilum)和硫膨大杆菌属(Thioclava);3~7d时,试片表面形成局部腐蚀产物/生物膜,SRB菌属开始富集,7d时试片表面出现点蚀,腐蚀产物/生物膜中的主要腐蚀细菌是假单胞菌(Pseudomonas)、脱硫微杆菌属(Desulfomicrobium)、弓形杆菌属(Arcobacter)、Thiomicrospira和硫膨大杆菌属(Thioclava),主要腐蚀机制是SRB和SOB的硫循环腐蚀;7~14d时,试片表面逐渐形成完整且较为致密的腐蚀产物/生物膜,点蚀加剧,14d时腐蚀产物/生物膜中的假单胞菌(Pseudomonas)、脱硫微杆菌属(Desulfomicrobium)和弓形杆菌属(Arcobacter)富集,SOB菌属相对丰度减少,主要腐蚀机制是SRB腐蚀。

