人工湿地中几种常见水生植物氨氮耐受性试验研究
朱士江 李凯凯 徐文 向鹏 廖再毅 贵树彪
摘要:选择人工湿地中常用的6种水生植物(美人蕉、菖蒲、香蒲、芦苇、凤眼蓝和睡莲)为受试植物,进行氨氮耐受性试验。在人工培养条件下配置不同氨氮浓度的营养液对这6种植物进行培养,一定时间后,对植物的抗氧化酶防御系统主要酶学指标进行测试。通过测定植物叶片中丙二醛(MDA)含量、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性变化,找出6种水生植物的氨氮耐受性规律。结果表明:① 菖蒲的SOD活性在氨氮浓度为300 mg/L左右时达到峰值,凤眼蓝、香蒲、睡莲的SOD活性峰值均在氨氮浓度为500 mg/L左右时出现,美人蕉和芦苇的SOD活性峰值出现在600 mg/L以后,且前期呈稳定增长;② 凤眼蓝、睡莲、香蒲、菖蒲的CAT活性峰值均在氨氮浓度为500 mg/L左右出现,且前期都呈稳定增长,美人蕉和芦苇的CAT活性峰值在氨氮浓度为600~700 mg/L时出现,其中芦苇呈稳定增长,美人蕉呈先减后增的趋势;③ 凤眼蓝和睡莲的MDA在氨氮浓度为300 mg/L左右时达到峰值,香蒲和菖蒲的MDA在氨氮浓度为500 mg/L左右时出现峰值,美人蕉和芦苇的MDA峰值在氨氮浓度为600 mg/L以后出现;⑤菖蒲、凤眼蓝、芦苇、睡莲适用于低浓度氨氮环境,美人蕉和芦苇虽然受到低浓度氨氮的一些胁迫,但在高浓度时表现出色,美人蕉和芦苇对氨氮的耐受性更强。
关 键 词:氨氮耐受性; 富营养化; 水生植物; 人工湿地; 生态修复
中图法分类号: X52
文献标志码: A
DOI:10.16232/j.cnki.1001-4179.2022.05.015
0 引 言
自然水体中氮磷含量的增加造成了水体富营养化。水体富营养化是当前存在的范围最广、危害最严重、防治最困难的水环境问题之一[1-4]。如何有效地去除自然水体中富余的氨氮,是目前亟待解决的问题[5-7]。人工湿地作为一种绿色又环保的技术被广泛应用于废水处理,可以有效减少入侵受纳水体的污染负荷,提升受纳水体水质,尤其是对生活污水中氮磷的去除做出巨大贡献[8-10]。 近年来,越来越多的学者开展了对人工湿地的研究,开发出了多种各具特色的湿地系统。
人工湿地的植物有一定的净化作用,研究者们常用水生植物的净化功能来协助污水生态处理工作,实现环境保护的目的[11-15]。选择合适的湿地植物,既要适应当地的环境,抗冻,抗病虫灾害,去污效果好,又要有一定的经济价值和景观效果[16-17]。国内外很多学者都对湿地中水生植物对氮、磷的吸附效果进行了研究[18],有学者认为某些水生植物对氮、磷等营养盐比较敏感是有效去除氮磷的主要原因[19],也有学者认为水生植物通过调节体内的抗氧化酶机制来响应水体中氮磷浓度的变化对植物的胁迫作用[20]。围绕不同种类的水生植物对氨氮耐受性的研究成为很多学者共同关注和研究的对象。水体中氨氮浓度直接影响着水生植物的生长,氨氮浓度过高会打破植物细胞内的平衡,破坏植物的细胞壁、细胞膜、叶绿体等,影响植物的光合作用,使植物的生长受到抑制,从而影响到整个湿地的生态平衡,致使湿地失去净化能力、景观效果和经济效益[21-23]。
采用不同浓度的培养液对3类水生植物进行试验,通过检测植物抗氧化酶防御系统主要酶学指标,来表征植物氨氮耐受性,初步得到不同浓度下的耐受性指标,找出6种水生植物的氨氮耐受性规律。
1 材料与方法
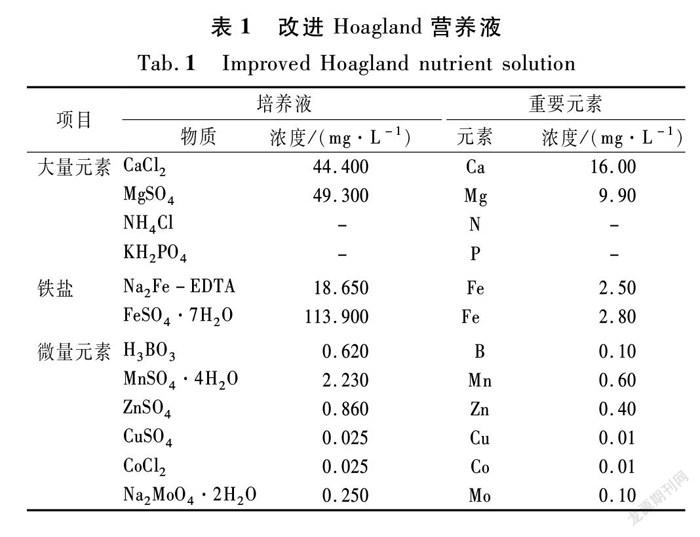
1.1 材 料
试验选用的3类水生植物分别是,挺水植物:美人蕉(Canna indica)、菖蒲(Acorus calamus)、香蒲(Typha orientalis Presl)、蘆苇(Phragmites communis);漂浮植物:凤眼蓝(Eichhornia crassipes);浮叶植物:睡莲(Nymphaea tetragona)。
本次试验时间为2020年8月10日至10月31日,试验周期80 d,试验设8个浓度变化的试验组,8个对照组,每个试验组和对照组各设3个重复,对照组氨氮浓度缺失。选取外形完好、形状和大小一致的植株种植在底径26cm、高31cm的试验盆中,用洗净的石英砂做固定基质。采用改进的Hoagland培养液,配方如表1所列。氨氮耐受性试验在18 L水中加入改进Hoagland营养液,氮源为氯化铵,每隔10 d增加培养液中氨氮浓度,在浓度递增的环境下观察酶活性和含量的变化。其他大量元素、微量元素、铁盐浓度不变,氨氮浓度设置为20,50,100,200,400,500,600,700 mg/L,为了维持盆中氨氮浓度,每隔5 d更换一次培养液,每天观察蒸发损耗并加一定量蒸馏水进行补充[24]。
1.2 方 法
每隔10 d在同一时间取植物叶片,测定叶片中丙二醛(MDA)含量、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性,SOD测定采用氮蓝四唑(NBT)光化学还原法[25];MDA测定采用硫代巴比妥酸法[26];CAT测定采用紫外吸收法[27]。试验期间使用仪器如下:紫外分光光度计(UV-1700)、光照培养箱(LRH-250-LG)、超低温冰箱(DW-HL340)、高度冷冻离心机(TGL-16MG)、分析天平(GL224-ISCN)、台式PH计(PHS-3E)、纯水仪(SYR-10L)、制冰机(IMS-20)。
1.3 数据处理
采用Microsoft Office Excel 2019对测量的数据做简单的整理分类并进行初步分析;统计数据采用 Origin 2018 软件绘图;数据统计分析采用IBM SPSS Statistics 25软件对数据进行单因素方差分析和皮尔逊相关性分析。
2 结果与分析
2.1 不同氨氮浓度下SOD的活性变化
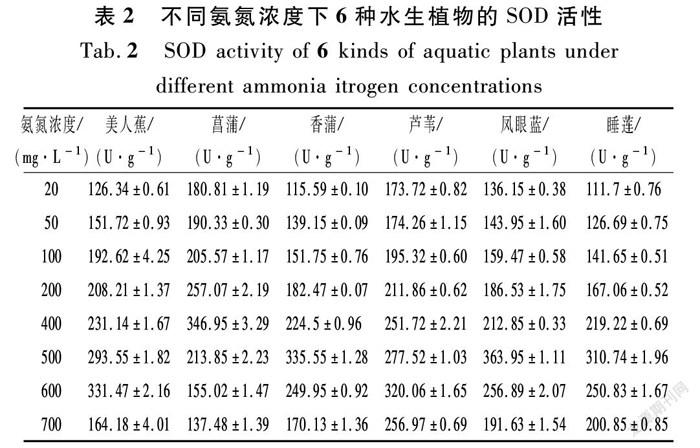
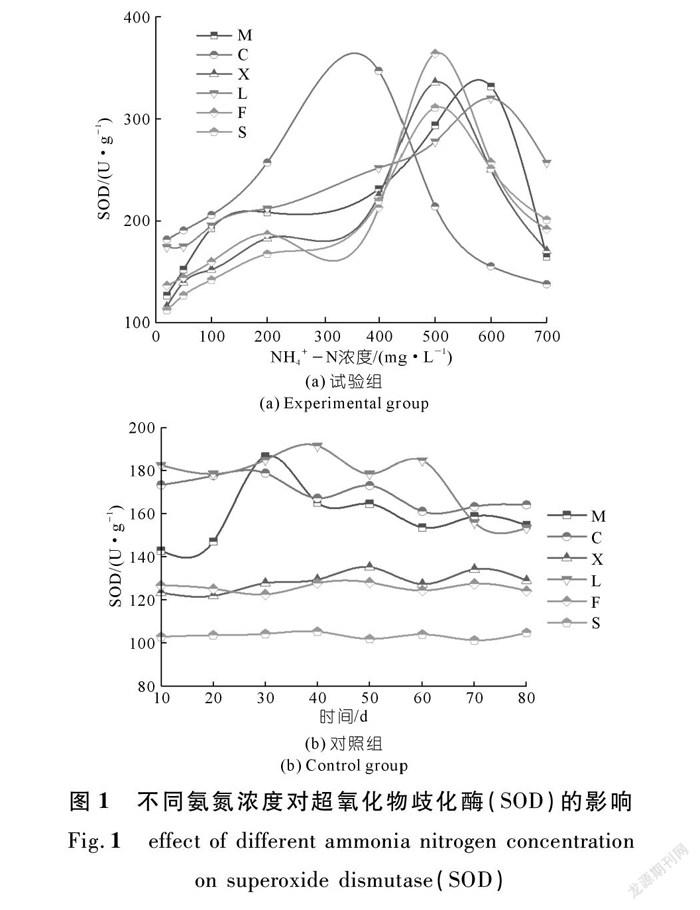
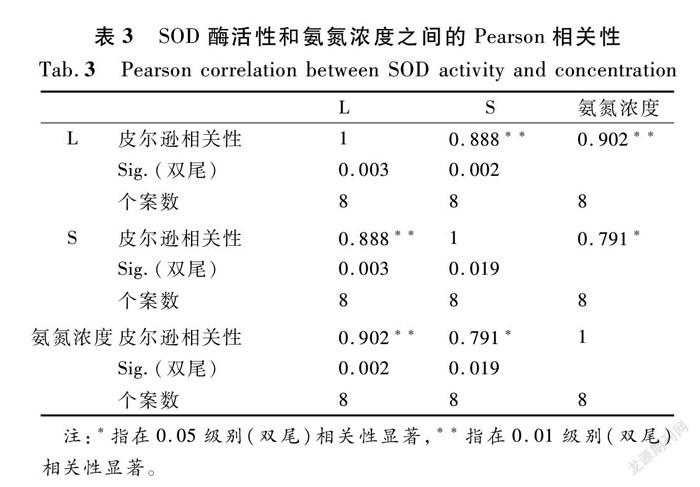
植物在生长发育中受到环境胁迫时,依靠自身抗逆性能够抵抗逆境带来的不良影响,SOD是机体清除活性氧的第一道防线,催化超氧化物的歧化反应,增强了植物在逆境胁迫下的耐受能力[28-31]。从表2可以看出:不同氨氮浓度下,美人蕉(M)、菖蒲(C)、香蒲(X)、芦苇(L)、凤眼蓝(F)、睡莲(S)的SOD活性都是先持续增加然后减少的,说明低浓度的氨氮对植物的SOD活性起到了一定的激发作用,而高浓度的氨氮对植物的SOD活性具有抑制的作用。
图1(a)表明:
① 在较低NH4+-N浓度(20,50,100,200 mg/L)时,6种植物的SOD活性都呈稳定上升趋势;
② 当NH4+-N浓度在200~400 mg/L之间时,菖蒲的SOD活性持续上升至峰值后持续下降,芦苇、美人蕉、睡莲的SOD活性缓慢上升,凤眼蓝和香蒲的SOD活性呈先下降后上升的趋势;
③ 当NH4+-N浓度在500 mg/L时,睡莲、香蒲、凤眼蓝的SOD活性出现峰值,之后持续下降,此时植物耐氨氮胁迫能力已经达到了极限;
④ 当NH4+-N浓度大约在600 mg/L时,美人蕉和芦苇的SOD活性达到峰值,随后开始下降;
⑤ 当NH4+-N浓度定在700 mg/L时,菖蒲的SOD活性略低于初始值,说明高浓度下菖蒲叶片细胞内的膜系统受到破坏,其他5种植物均高于初始值。
图1(b)是对照组(CK)相应于试验组(a)测量天数的SOD活性,美人蕉、菖蒲和芦苇的SOD活性普遍高于香蒲、凤眼蓝和睡莲的活性;美人蕉的SOD活性呈先上升后下降的趋势,在第30 d测量时达到峰值;香蒲、凤眼蓝和睡莲的SOD活性相对来说变化幅度不大,其中睡莲的SOD活性最小,浮动在100~110 U/g之间。
根据Pearson相关分析,开展了6种水生植物的SOD酶活性与氨氮浓度的显著相关性分析。芦苇和睡莲与浓度之间存在着显著和极显著相关性,表明芦苇和睡莲叶片中的SOD酶活性受到不同NH4+-N浓度胁迫的影响,如表3所列。而美人蕉、菖蒲、香蒲、凤眼蓝叶片中的SOD活性与氨氮浓度的相关性并不显著,说明氨氮浓度并不只是影响这几种植物叶片中SOD酶的唯一因素,可能是长时间的低浓度氨氮胁迫所致,可能还跟植物体的叶片大小、光合作用以及自身的调节作用有关。
2.2 不同氨氮浓度下CAT的活性变化
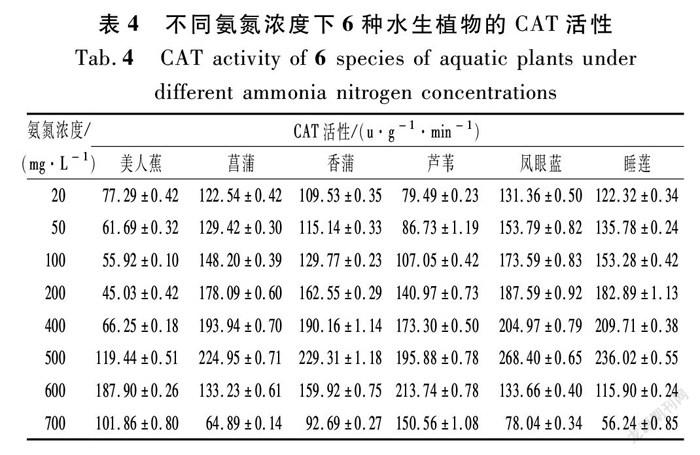
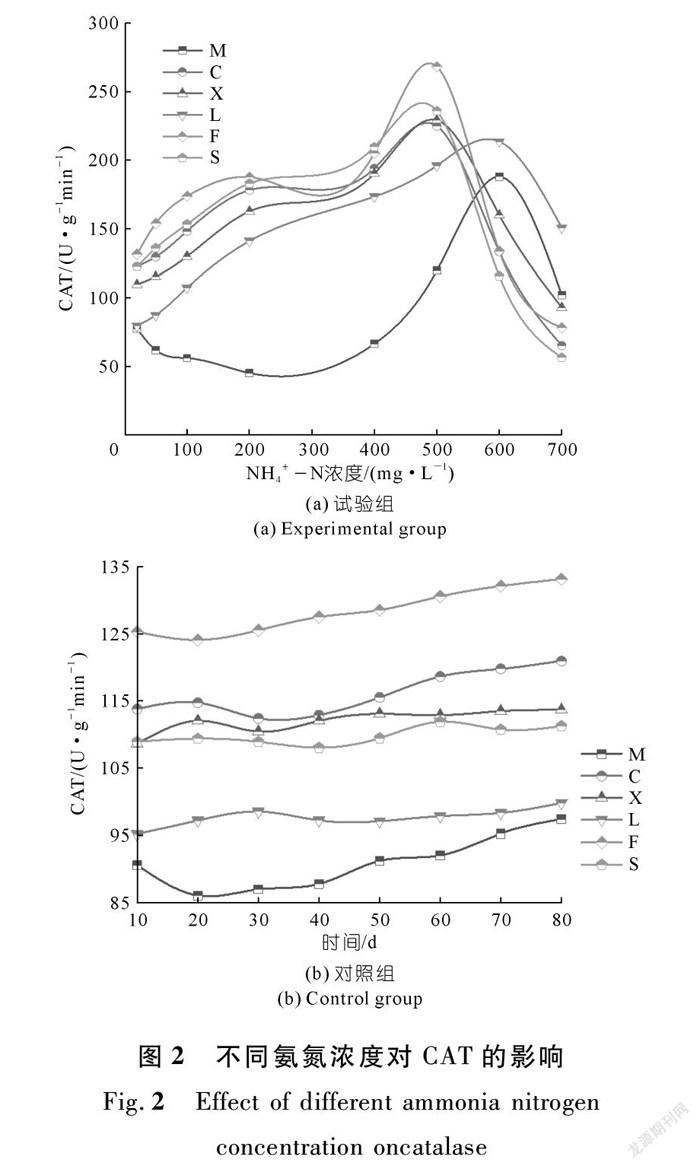
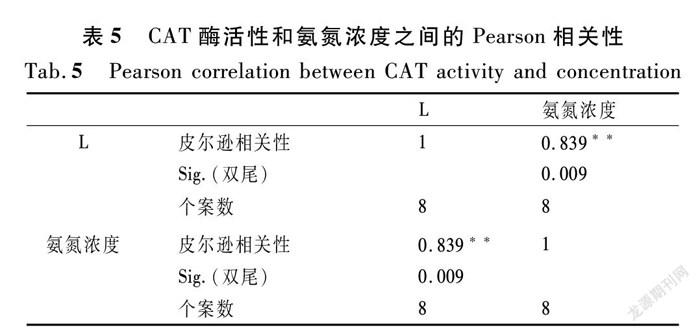
过氧化氢酶是广泛存在于动植物体内主要的抗氧化酶之一,它的主要功能是专一地清除过多的过氧化氢,以防止活性氧自由基对植物造成的伤害[32-34]。从表4和图2可以看出:不同NH4+-N浓度下,菖蒲、香蒲、芦苇、凤眼蓝、睡莲的CAT活性是先上升后下降的,而美人蕉是先减少后增再减少的,CAT活性在45.03~187.9 U/(g·min)之间,CAT活性较其他几种植物小,说明氨氮胁迫的作用相对较小,Pearson相关分析结果如表4所列。
由图2可知:① 在较低NH4+-N浓度(20,50,100,200 mg/L)时,菖蒲、香蒲、芦苇、凤眼蓝和睡莲的CAT活性呈稳定上升趋势,而美人蕉(M)的CAT活性呈缓慢下降趋势。② 在浓度增加的过程中,芦苇中的过氧化氢酶随不同NH4+-N浓度先上升后下降(r=0.839,n=8);当NH4+-N浓度在200~400 mg/L时,芦苇的CAT活性保持稳定增长的趋势,另外5种水生植物的CAT活性都有一个缓冲的过程,此时的叶片细胞内液浓度较细胞外液浓度低,整体表现为水分子通过半透膜进入到外界溶液,植物细胞有质壁分离的趋势,其中美人蕉的CAT含量出现峰谷,且峰谷约为其他植物的0.3倍。③ 在NH4+-N浓度为500 mg/L时,凤眼蓝、睡莲、香蒲、菖蒲叶片中的CAT活性达到了峰值,然后开始极速下降,此时观察到植物几乎不能生长,其中凤眼蓝的峰值最高。植物因为氨氮浓度的增加受到刺激而产生的保护酶系统在此浓度下达到了阈值,说明植物过氧化氢酶对植物的保护达到了一定的限度,植物承受氨氮胁迫的能力已经达到了极限,导致酶的结构发生变化甚至被破坏。④ 当NH4+-N浓度在600 mg/L时,芦苇和美人蕉的CAT活性达到了峰值,说明芦苇和美人蕉的耐氨氮胁迫能力更强。⑤ 从700 mg/L的NH4+-N浓度可以看出,睡莲、菖蒲、香蒲、凤眼蓝的CAT活性较低,尤其是在酶活性陡降后,开始慢慢出现死亡。
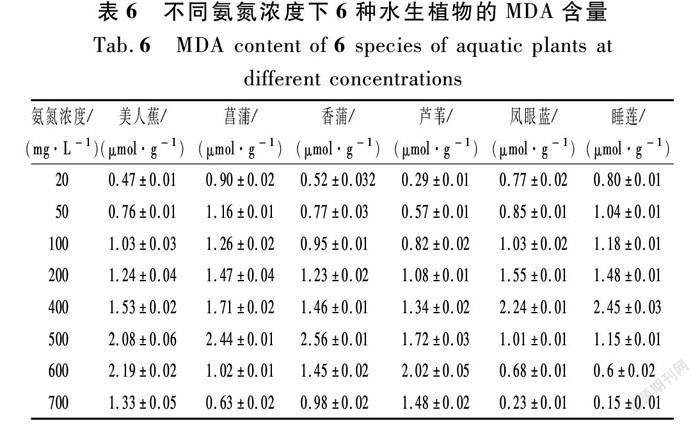
2.3 不同氨氮浓度下MDA的含量变化
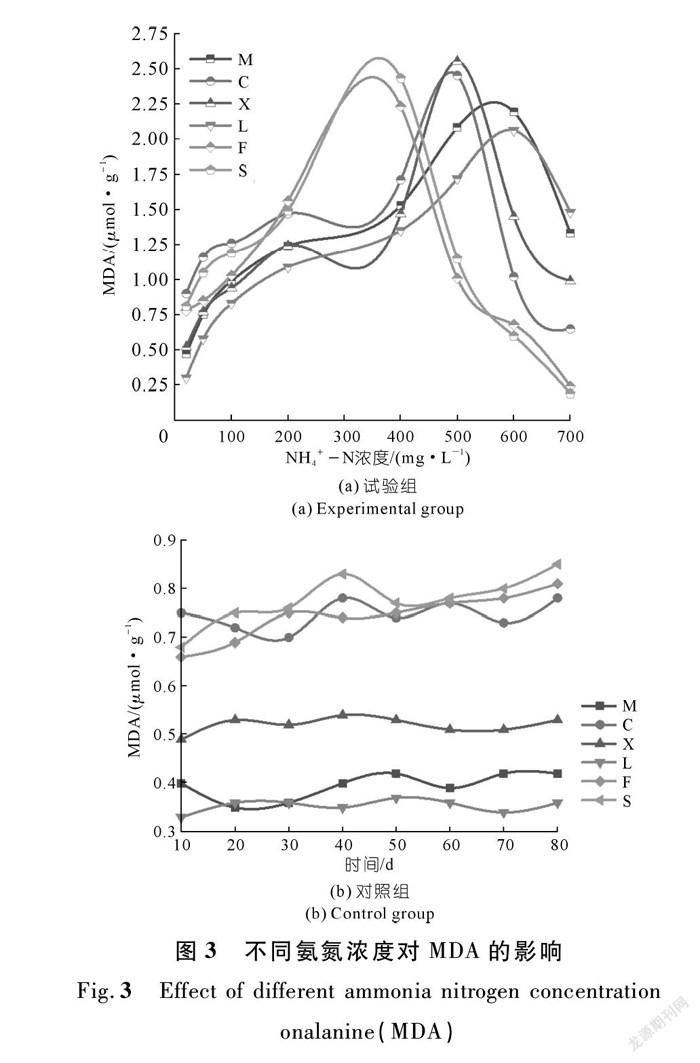
MDA是由于植物器官衰老或在逆境条件下受伤害,其组织或器官膜脂质发生过氧化反应而产生的,可通过MDA的含量变化来了解膜脂过氧化的程度,间接测定膜系统受损程度以及植物的抗逆性[35]。从表6可以看出:不同NH4+-N浓度下,MDA含量的变化比较小,除最大值以外,大多都在1.0附近,在氨氮浓度为700 mg/L时,美人蕉和芦苇的MDA含量最高,由此可见,美人蕉和芦苇器官衰老相对于其他几种植物较快。
由图3(a)可知:
① NH4+-N浓度在20~200 mg/L之间,6种水生植物的MDA含量均呈上升趨势,其中凤眼蓝(F)的上升速度极快;
② 当NH4+-N浓度在200~400 mg/L之间时,凤眼蓝和睡莲的MDA含量出现了峰值,之后开始下降,美人蕉和芦苇缓慢增长,菖蒲和香蒲呈现先减后增的趋势;
③ 当NH4+-N浓度达到500 mg/L时,菖蒲和香蒲的MDA含量均出现峰值,随后开始下降;
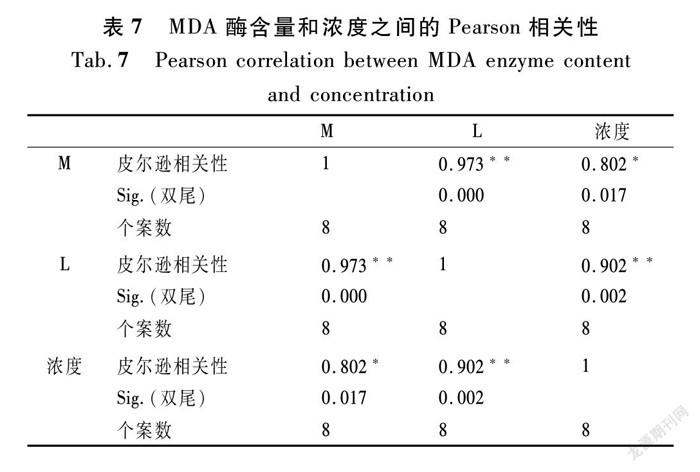
④ 美人蕉和芦苇的峰值出现在600~700 mg/L之间,且峰值低于前4种水生植物。在整个过程中,美人蕉中的MDA含量随不同NH4+-N浓度先上升后下降(r=0.802*,n=8),芦苇中的MDA随不同NH4+-N浓度先上升后下降(r=0.902**,n=8),Pearson相关分析结果如表7所示;
⑤ 当NH4+-N浓度达到700mg/L时,睡莲、凤眼蓝、菖蒲的MDA含量均低于20 mg/L时的MDA含量,MDA系统遭到损害。
由图3(b)可知:在对对照组进行第二次测量时,美人蕉和菖蒲的MDA含量是下降的,且美人蕉在20 d时出现转折;凤眼蓝、菖蒲、睡莲的MDA含量高于香蒲,美人蕉和芦苇的含量。整体上,在其他大量元素、微量元素、铁盐充足的情况下,氮缺失对植物影响不大。
3 结论与展望
本试验分析了6种水生植物在不同浓度的氨氮环境下,植物叶片中丙二醛、超氧化物歧化酶和过氧化氢酶的活性变化,氨氮浓度的增加会激发植物自身的保护酶系统对抗外界伤害[36]。
在不同程度上氨氮胁迫作用较为明显,3种酶含量随着浓度的增加有一定程度的升高,根据3种酶含量的变化,菖蒲、凤眼蓝、睡莲、香蒲的酶含量峰值出现较早,耐受范围在0~500 mg/L,当浓度在700 mg/L的时候,CAT无法恢复初始值,叶片抗氧化和抗衰老能力降低,因此在氨氮浓度适中的水环境中,具有一定的优势。菖蒲位于离河流相对较远的地方,而不是生活在水道中,并且有很强的水生态处理能力,凤眼蓝不仅繁殖速度快,价格低廉,还有很强的吸附重金属能力[37-38],2种植物在南方水处理中优势明显。
美人蕉和芦苇的氨氮耐受性最强,耐受范围在0~600 mg/L,在高浓度氨氮胁迫下,溶解氧过度积累,容易导致植物的酶活性提前进入峰值状态,但芦苇的SOD、MDA、CAT含量峰值均出现在600~700 mg/L之间,具有很强的抗逆性,在700 mg/L时的酶含量都高于初始值,具有一定的稳定性,且与氨氮浓度之间有很强的显著性(P<0.05)。美人蕉的3种酶曲线中都是在高浓度下达到峰值,且在低浓度氨氮胁迫下不易受到影响。此外,芦苇生长密集,根系发达,芦苇穗、芦苇茎和芦苇根都有一定的脱氮除磷效果。美人蕉具有很强的观赏性,不仅可以美化环境,还可以处理水中的氮磷、悬浮物等。
综上,6种水生植物皆可作为人工湿地处理含氮废水的理想植物。因此,在不同水生环境下选择适宜的水生植物建立生态系统,对人工湿地处理水体富营养化有一定的参考价值。而目前所做的水生植物净化水体的研究,大多基于室内或静态水体环境,与实际应用中的流动水体相比,净化效果存在差异。下一步工作将重点开展模拟动态环境下几种水生植物的不同组合对处理含氮磷废水的研究,选择最优的组合应用于实际流体中。
参考文献:
[1] 赵玥,景连东.成都东湖水体富营养化研究[J].西南民族大学学报:自然科学版,2021,47(1):37-43.
[2] YU J B,SHENG Z,ZHAO Z Y,et al.Water eutrophication evaluation based on multidimensional trapezoidal cloud model[J].Soft Computing,2021,25(5):2851-2861.
[3] LEIP A,BILLEN G,GARNIER J,et al.Impacts of European livestock production:nitrogen,sulphur,phosphorus and greenhouse gas emissions,land-use,water eutrophication and biodiversity[J].Environmental Research Letters,2015,10(11):115004.
[4] LIN S S,SHEN S L,ZHANG N,et al.Method for lake eutrophication levels evaluation:TOPSIS-MCS[J].Methods X,2021(4):101311.
[5] 龔娟,王宇晖,赵晓祥,等.人工湿地处理高氨氮废水中植物的耐受性[J].湖北农业科学,2015,54(3):534-538,542.
[6] YAO Y Q,LU D F,QI Z M,et al.Miniaturized optical system for detection of Ammonia Nitrogen in water based on gas-phase colorimetry[J].Analytical Letters,2012,45(15):2176-2184.
[7] 向鹏,朱士江,徐文,等.资水营养盐分布规律及水质现状分析[J].安徽农业科学,2020,48(7):100-103.
[8] Gersberg R M,Elkins B V,GOLDMAN C R.Nitrogen removal in artificial wetlands[J].Pergamon,1983,17(9):1009-1014.
[9] 许巧玲,温学源,杨芷欣,等.三种湿地植物在冬季人工湿地处理生活污水中脱氮除磷的贡献[C]∥中国环境科学学会,2020(6).
[10] SCHüCK M,GREGER M.Screening the capacity of 34 wetland plant species to remove heavy metals from water[J].International Journal of Environmental Research and Public Health,2020,17(13).
[11] 谢东升,朱文逸,陈劲鹏,等.5种华南地区水生植物对城市生活污水的净化效果[J].环境工程学报,2019,13(8):1903-1908.
[12] 孙琳琳,宋协法,李甍,等.外加植物碳源对人工湿地处理海水循环水养殖尾水脱氮性能的影响[J].环境工程学报,2019,13(6):9-14.
[13] 华昇,陈浩,刘云国,等.不同季节人工湿地处理污水效果[J].安徽农业科学,2019,47(19):68-72.
[14] 赵佳浩,栗敏杰,范逸婷,等.影响人工湿地污水净化效果的因素综述[J].江西农业学报,2020,32(11):119-124.
[15] PINHO H J O.MATEUS DINA M R.Sustainable production of reclaimed water by constructed wetlands for combined irrigation and microalgae cultivation applications[J].Hydrology,2021,8(1):30.
[16] LIU H X,MA B.Wetland landscape design based on 5G network and FPGA system[J].Microprocessors and Microsystems,2020,81(1):103710.
[17] JAN V,卫婷,赵亚乾,等.细数植物在人工湿地污水处理中的作用[J].中国给水排水,2021,37(2):25-30.
[18] 夏梦华,刘铭羽,郭宁宁,等.美人蕉、梭鱼草和黄菖蒲人工湿地系统对养猪废水的脱氮特征研究[J].生态与农村环境学报,2020,36(8):1080-1088.
[19] 徐寸发,闻学政,张迎颖,等.漂浮植物组合生态处理污水处理厂尾水的效果及植物生理响应[J].环境污染与防治,2019,41(11):1355-1340.
[20] 陈丹艳,周威,段婧婧,等.水生植物对不同形态氮素污水的生理响应及相应脱氮效率[J].江苏农业学报,2020,36(6):1468-1474.
[21] 陈书琴,孙慧群,储昭升.氨胁迫下沉水植物抗氧化酶系统研究进展[J].环境科学与技术,2016,39(11):42-46.
[22] 尹传宝,张翠英,张敏,等.三种营养物质急性胁迫下菹草的生理生化特性[J].湿地科学,2015,13(1):129-134.
[23] ZHOU Q Y,GAO J P,ZHANG R M,et al.Ammonia stress on nitrogen metabolism in tolerant aquatic plant—Myriophyllum aquaticum[J].Ecotoxicology and Environmental Safety,2017,143(9):102-110.
[24] 纪庆亮.三种水生植物氨氮耐受性和冬季净水效果研究[D].南京:南京林业大学,2010.
[25] 魏婧,徐畅,李可欣,等.超氧化物歧化酶的研究进展与植物抗逆性[J].植物生理学报,2020,56(12):2571-2584.
[26] 张清航,张永涛.植物体内丙二醛(MDA)含量对干旱的响应[J].林业勘查设计,2019(1):110-112.
[27] 彭建,王丹英,徐春梅,等.钼酸铵法测定水稻过氧化氢酶活性[J].中国农学通报,2009,25(16):61-64.
[28] 于孝保,朱繼宏,付德峰,等.4种蔬菜中SOD活性测定研究[J].现代农业科技,2012(11):82,88.
[29] 孟婉,刘扬,朱士江,等.洞庭湖流域沉积物重金属分布特征及其生态风险[J].南水北调与水利科技(中英文),2021,19(4):739-749,767.
[30] 刘云芬,王薇薇,祖艳侠,等.过氧化氢酶在植物抗逆中的研究进展[J].大麦与谷类科学,2019,36(1):5-8.
[31] ZHOU C Z,ZHU C,FU H F.Genome-wide investigation of superoxide dismutase(SOD)gene family and their regulatory miRNAs reveal the involvement in abiotic stress and hormone response in tea plant(Camellia sinensis)[J].PloS one,2019,14(10):e0223609.
[32] MARCO S,BERND L,MATTEO S,et al.Plant growth regulator and soil surfactants’ effects on saline and deficit irrigated warm-season grasses II:pigment content and superoxide dismutase activity[J].Crop Science,2014,54(6).
[33] 南芝润,范月仙.植物过氧化氢酶的研究进展[J].安徽农学通报,2008(5):27-29.
[34] SWATI S,VINITA H.Identification of coding sequence and its use for functional and structural characterization of catalase from Phyllanthus emblica[J].Bioinformation,2018,14(1):8-14.
[35] QIAN J,JIN W,HU J,et al.Stable isotope analyses of nitrogen source and preference for ammonium versus nitrate of riparian plants during the plant growing season in Taihu Lake Basin[J].Science of The Total Environment,2020(2):763-779.
[36] 欧阳泽怡,陈雯彬,欧阳硕龙,等.低磷胁迫对赤皮青冈幼苗叶片生理指标的影响[J].中南林业科技大学学报,2021,41(1):69-79.
[37] 郑足红,胡超,王华伟,等.3种水生植物对富营养化水质的净化性能比较[J].环境污染与防治,2018,40(10):1147-1151.
[38] GABALLAH M S,ISMAIL K,ABOAGYE D,et al.Correction to:Effect of design and operational parameters on nutrients and heavy metal removal in pilot floating treatment wetlands with Eichhornia crassipes treating polluted lake water[J].Environmental Science and Pollution Research,2021,28(20):25664-25678.
(編辑:黄文晋)
Experimental study on ammonia nitrogen tolerance of several common aquatic plants in constructed wetlands
ZHU Shijiang1,3,LI Kaikai1,XU Wen1,3,XIANG Peng1,LIAO Zaiyi1,2,GUI Shubiao1
(1.College of Hydraulic and Environmental Engineering,China Three Gorges University,Yichang 443002,China; 2.Department of Architectural Science,Ryerson University,Toronto M5B 2K3,Canada; 3.Engineering Research Center of Eco-environment in Three Gorges Reservoir Region of Ministry of Education,Yichang 443002,China)
Abstract:
Six kinds of aquatic plants commonly used in constructed wetlands,namely Canna indica,Acorus calamus,Typha orientalis Presl,Phragmites communis,Eichhornia crassipes and Nymphaea tetragona,were selected for nitrogen tolerance analysis.They were cultured in nutrient solutions of different ammonia nitrogen concentrations.The main enzyme indexes of plant antioxidant enzyme defense system were tested in a certain period of time.The nitrogen tolerance of six species of aquatic plants was preliminarily found by measuring the content of malondialdehyde (MDA),the activities of superoxide dismutase (SOD) and catalase (CAT) in leaves.The results showed that the SOD of Acorus calamus reached the peak when the concentration was about 300 mg/L,then decreased.The SOD of Eichhornia crassipes,Typha orientalis Presl and Nymphaea tetragona reached the peak when the concentrations were around 500 mg/L.The SOD of Canna indica and Phragmites communis reached the peak when the concentrations were over 600 mg/L,and showed a steady growth trend in the early stage.The CAT of Eichhornia crassipes,Nymphaea tetragona,Typha orientalis Presl and Acorus calamus reached the peak when the concentrations were all about 500 mg/L,and showed a steady growth trend in the early stage,while the peak values of Canna indica and Phragmites communis were between 600~700 mg/L,in which Phragmites communis increased steadily,and Canna indica decreased at first and then increased.The MDA of Eichhornia crassipes and Nymphaea tetragona reached the peak when the concentrations were around 300 mg/L.The MDA of Typha orientalis Presl and Acorus calamus reached the peak when the concentrations were around 500 mg/L.The MDA of Canna indica and Phragmites communis reached the peak when the concentrations were over 600 mg/L.The results showed that Acorus calamus,Eichhornia crassipes,Phragmites communis and Nymphaea tetragona were suitable for low concentration ammonia nitrogen environment.Although Canna indica and Phragmites communis were subjected to some stress of low concentration ammonia nitrogen,they performed well at high concentration,and Canna indica and Phragmites communis were more tolerant to ammonia nitrogen.
Key words:
ammonia nitrogen tolerance;eutrophication;aquatic plants;constructed wetland;ecological restoration

