2020年ESICM抗菌药物监测 在成人危重症患者中的应用指南解读
——抗菌药物部分
崔旋旋 师维 陆宗庆 李惠 杨旻
作者单位:230601 安徽合肥,安徽医科大学第二附属医院重症医学二科,心肺复苏与危重病实验室
对于危重症患者,合理的抗感染治疗可显著改善其临床预后,但由于自身疾病和其他潜在危险因素的影响,危重症患者常具有显著的个体间和个体内药代动力学差异,临床上常规抗菌药物种类以及剂量的选择并不适用于此类患者[1]。因此,由欧洲重症监护医学学会(European Society of Intensive Care Medicine,ESICM)等多个机构联名成立研究小组,通过对成人危重症患者抗菌药物治疗药物监测(therapeutic drug monitoring,TDM)的现有数据进行回顾和分析,于2020年发表了《抗菌药物监测在成人危重症患者中的应用》。本指南在对每种抗菌药物进行详细分析后指出,通过TDM可使危重症患者的抗菌药物剂量个体化,从而提高患者的临床疗效;最后,该指南针对危重症患者进行抗菌药物治疗时是否推荐使用TDM以及如何使用TDM给出了详细的介绍及建议。本文对该指南抗菌药物部分进行解读,旨在为我国重症医学科医师能更好地使用抗菌药物提供参考。
1 指南制定流程
由ESICM、欧洲临床微生物学和感染疾病协会 (European Society of Clinical Microbiology and Infectious Diseases,ESCMID)的危重症患者药物代谢动力学/ 药物效应动力学(pharmacokinetic/pharmacodynamics, PK/PD)研究组、国际治疗药物监测和临床毒理 学协会(International Association of Therapeutic Drug Monitoring and Clinical Toxicology,IATDMCT)、 际抗菌药物化疗学会(International Society of Antimicrobial Chemotherapy,ISAC)组建指南撰写小组,通过在PubMed数据库使用(“anti-bacterial agents” OR “antifungal agents” OR “antiviral agents”)AND(“drug monitoring” OR “pharmacokinetics” OR “pharmacodynamics”)AND(“critical care” OR “critical illness” OR “intensive care units”)等关键词进行文献检索,同时对每种抗菌药物(如美罗培南)和相关的抗菌药物类别(如碳青酶烯类)进行检索,不限定检索期限。各小组对成人危重症患者使用抗菌药物的临床疗效及不良反应进行回顾分析和总结,评估每种抗菌药物是否适用于TDM,针对意见分歧之处进行协商讨论。最终采用李克特(Likert)七级量表法(1=强烈不推荐,2=不推荐,3=稍微不推荐,4=中立,5=弱推荐,6=推荐,7=强烈推荐)来评估专家组成员对于危重症患者应用TDM指导抗菌药物使用的立场。当1和2(消极共识)或6和7(积极共识)≥75%时达成共识。
2 危重症患者的PK/PD问题
2.1 PK的改变 PK主要运用数学原理和方法阐述药物在机体内代谢的动态规律,是定量研究药物在生物体内过程(包括吸收、分布、代谢和排泄)的一门学科。PK通过监测给药剂量和间隔时间,评估药物在其作用部位能否达到安全的有效浓度。药物在体内的代谢过程决定了药物在作用部位的浓度,危重症患者由于自身因素(如基础疾病和自身疾病)及治疗干预措施共同影响器官功能,可改变药物在患者体内的分布容积(volume of distribution,Vd)和(或)药物清除率(clearance rate,CL),显著影响抗菌药物的PK。
2.2 Vd的改变 Vd是当血浆和组织内药物分布达到平衡后,体内药物按此时的血浆药物浓度在体内分布时所需的体液容积。危重症患者体内稳态的改变显著影响抗菌药物的Vd,当出现血管内皮障碍时,亲水性抗菌药物(如氨基糖苷类、β-内 酰胺类、达托霉素和糖肽类)的Vd将增大[2];当发生低蛋白血症时,头孢曲松、达托霉素、厄他培南和替考拉宁等高蛋白结合率抗菌药物的游离(或未结合)部分增加,致使Vd增大[3]。此外,患者体质也会影响抗菌药物的Vd[4],如肥胖患者由于组织间液和肌肉含量增加,使亲水性药物的Vd明显增大,而过多的脂肪组织将显著影响亲脂性药物的Vd。
2.3 CL的改变 CL是机体清除器官在单位时间内清除药物的血浆容积,即单位时间内有多少体积的血浆中所含药物被清除。药物大多通过肾脏代谢清除,危重症患者因肾功能较差而影响CL。因此,人们开始关注肾清除增强(augmented renal clearance,ARC)对危重症患者的影响。ARC定义为收集8~ 24 h尿液测量肌酐清除率>130 mL·min-1·1.73 m-2, 即肾脏对循环溶质(如代谢废物和药物)的清除能力增强[5]。虽然其潜在机制尚不清楚且鉴别比较困难,但ARC对危重症患者体内抗菌药物的PK影响显著,增加的肌酐清除率与抗菌药物血药浓度呈负相关。当患者出现ARC时,可能需要增加给药剂量或延长输注时间来确保疗效。此外,一些重症监护病房(intensive care unit,ICU)常见治疗方法的使用也会影响CL,如肾脏替代疗法(renal replacement therapy,RRT)、体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)等。
2.4 PD的改变 PD主要研究的是药物对疾病疗效及剂量对疗效的影响,可通过联合抗菌药物的PK与致病病原体的最低抑菌浓度(minimum inhibitory concentration,MIC)进行描述。抗菌药物通常具有不同的PK/PD指数(见表1)[6],可分为:① 最大药物浓度(Cmax)与MIC比值(Cmax/MIC);② 给药间隔时间内游离药物浓度保持在MIC以上的时间 (fT>MIC);③ 24 h药物浓度-时间曲线下面积与MIC 的比值(AUC0-24/MIC)[7]。在体外抑菌试验中,通过 计算抑制50%或90%细菌的抗菌药物浓度(MIC50和MIC90)来反映抗菌药物对细菌抑制作用的强弱。因此早期的大多数研究中,主要用MIC50和MIC90等参数来描述PK/PD的关系,除此以外,还采用其他指标〔如获得50%最大抑菌效应所需的体外浓度(concentration for 50% of maximal effect,EC50)〕作为PK/PD指数的分母。这些指标的分母也是一个重要的考虑因素,因为当分母增加时,为确保PK/PD指数达到最佳,对应的PK暴露也需相应增加。这点在ICU患者中表现得更为明显。Monton等[8]强调,由于与MIC测定相关的检测结果不准确且具有高度变异性,单独使用MIC来指导抗菌药物的给药剂量并不合适。测量MIC的方法各不相同〔如微量肉汤稀释法(broth microdilution,BMD)和E-test〕,目前首选BMD。基于TDM调整药物剂量时,还应考虑MIC的变异,更应在试验变异、物种鉴定和野生型分布的基础上加以解释。对MIC分布进行测量,如病原菌MIC流行病学临界值(epidemiological cutoff,ECOFF),将细菌种群分为野生型菌群和耐药性低或高的菌群,可以更有效地指导抗菌药的用药剂量。同时,Mouton等[8]也提出了一些可行的方案来优化患者的抗菌药物剂量,如通过分析测定的细菌菌株与野生型分布范围之间的关系来指导抗菌药物剂量,其主要分为以下3种情况:① 测定的细菌菌株的MIC在野生型分布范围内,直接将ECOFF值作为目标药量的PD指标;② 测定的MIC略高于ECOFF,将MIC稀释两倍作为目标药量;③ 测定的MIC明显高于ECOFF和临床耐药临界值,不选择MIC进行指导治疗。

表1 药物代谢动力学/药物效应动力学(PK/PD)指数和抗菌药物临床疗效及毒性比较
3 治疗药物监测的四大基本原则
进行治疗药物监测时,只有按照特定的标准才能发挥抗菌药物的潜在疗效(见表2),因此本指南提出以下4点。
3.1 个体内与个体间显著的PK差异性 危重症患者的抗菌药物PK经常表现出极大的变异性,一部分可通过患者的协变量(如体质量和肾功能指标)来解释,但在不同患者之间(即个体间的变异性)和同一患者内部(即个体内的变异性)也存在无法解释的PK变异性。当无法解释的个体间PK变异性超过个体内PK变异性时,基于剂量调整的TDM可以最大程度发挥抗菌药物的疗效。反之,则只需要根据患者协变量(如体质量和肾功能指标)调整给药剂量。
3.2 确定与药理学反应(临床反应和毒性)相关的暴露范围 抗菌药物TDM的PK一般都是在每次给药间隔结束时获得谷浓度样本(给药间隔中的最小浓度,Cmin)。Cmin可获得有关药物CL的部分信息,但Vd测定需要在给药间隔早期额外取样。为了估算派生的PK参数(如AUC)和PK/PD目标(如 fT>MIC),提出了一个优化的PK抽样方案,即有限采样法(limited sampling strategy,LSS),该方法使用最具“信息性”的浓度时间点(通常为1~3个采样时间点)来描述药物PK,容易执行,也可以提供全面药物暴露的精准估算[46-47]。
3.3 制定相关的采样时间点 药物的最佳采样时间点可以在“有限取样”研究期间确定。该时间点可用于预测AUC0-24,因此这种方法对于一些主要决定因素是AUC0-24/MIC的抗菌药物来说是有益的(见表3)。如左氧氟沙星通常需10~15个时间点来计算总AUC的80%,但Alsultan等[48]研究表明,使用LSS时只需2个时间点(在给药后4 h和6 h采样)就可以对AUC进行估计。对于持续输注给药的抗菌药物,可在给药过程中的任何时间段采样。
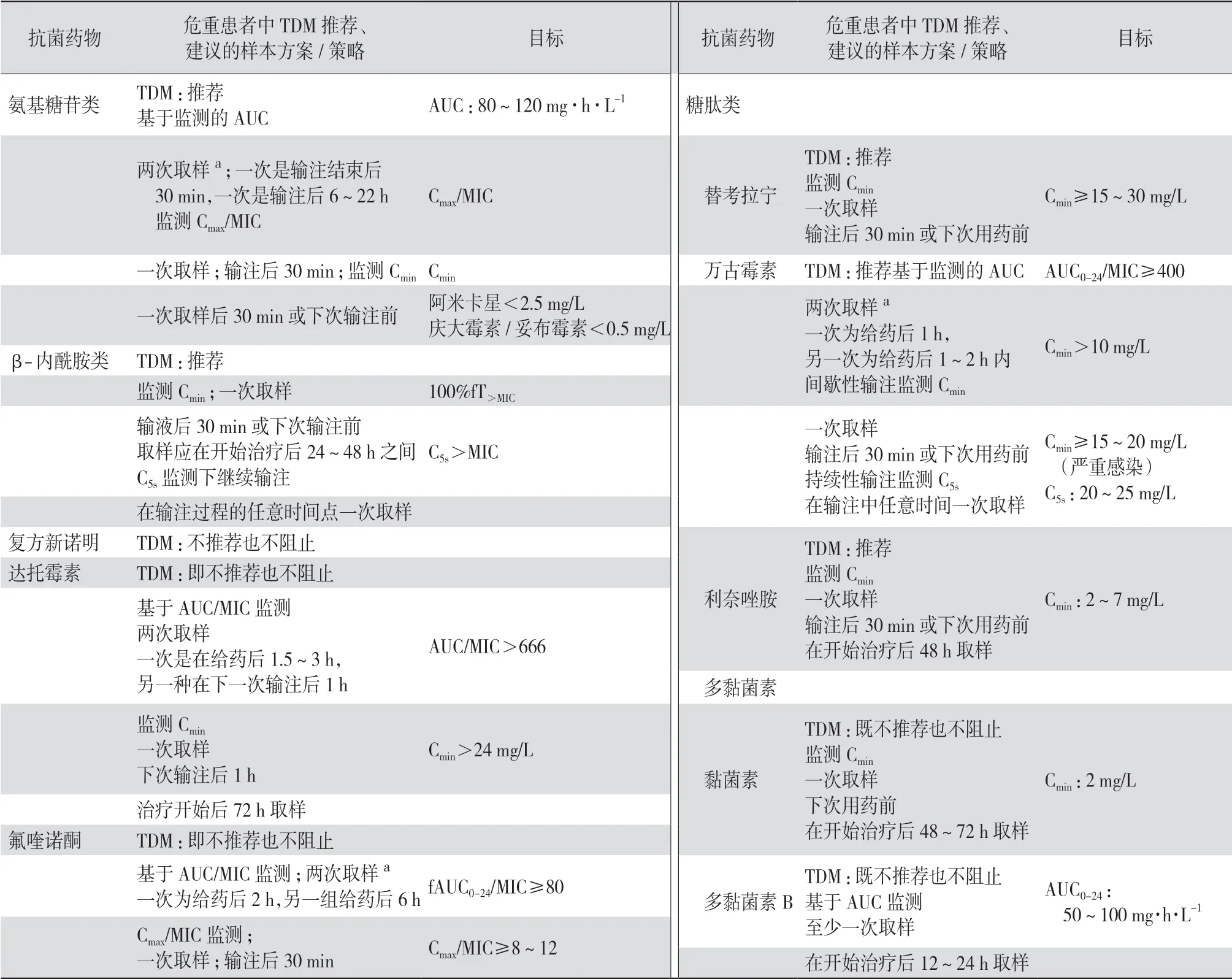
表3 对危重患者使用抗菌药物进行治疗性药物监测(TDM)的建议
大多数抗菌药物与病原体的相互作用都发生在感染部位。因此,应首选感染部位进行抗菌药物浓度检测(如肺炎患者的肺泡上皮细胞表面液和脑膜炎患者的脑脊液)。在实际情况中,大多数实验中心使用血浆药物浓度代替实际感染部位的药物浓度,其弊端是有些抗菌药物在体内分布不均,血浆药物浓度并不能直接反映感染部位的药物浓度。
3.4 准确而及时的药物监测生物分析方法 用于测量抗菌药物浓度的生物分析方法应精准,对特定药物具有高度选择性,测定方法应能及时提供结果,最好可以在采样的同天内进行测定。为确保检测方法对常规TDM和患者管理有充足的准确性、精密性和特异性,应定期对高效检验程序进行质控[49-50]。 理想情况下,游离药物浓度应在生理状态下测定[51];但实际临床工作中,大多数实验室只报告药物的总浓度。此外,某些药物只根据总暴露量来定义暴露目标(如万古霉素)。
基于TDM的剂量调整可通过几种方法进行,第一种是通过比较和评估单一药物浓度(如Cmin)与治疗范围目标进行调整,这种方法最常用且比较简单,但结果的准确性较差;第二种是通过剂量列线表进行调整,这种方法可以将PK/PD指数和器官功能测量值(如使用肌酐清除率描述肾功能)结合起来,使结果更准确,但使用单个剂量列线图不能实现分离PK变异性的来源并纳入>1个的协变量(如肌酐清除率和体质量)进行剂量调整。此外,如果未严格按照预先制定的PK采样/给药时间表进行,剂量列线图的预测结果将不准确;使用给药软件可克服这些不足[52]。并且上述方法已被证明优于万古霉素的传统抗菌药物剂量测定方法[53],尤其是在以下几种情况下:① 最初可使用蒙特卡洛模拟的方法,对患者进行个体化治疗;② PK变异性的来源可以分为个体内和个体间变异性;③ 可在达到稳定状态前进行PK采样;④ 用最佳采样时间来提供患者体内药物PK特性的大部分信息,并且选择与目标人群匹配的合适的PK模型作为贝叶斯先验模型时,贝叶斯定理是最准确的[54]。通过贝叶斯定理,可以从单个PK样本中估计算出抗菌药物的整个PK曲线。完成初次TDM后,应重复TDM(大多数药物在1~2 d 内)以确认已经达到治疗暴露,如PK有显著变化(如肠道吸收、肾功能指标),则应再次进行TDM。
4 结语
综上所述,该指南主要介绍了在成人危重症患者中以TDM为导向确定抗菌药物给药剂量,从而使抗菌药物剂量个体化并且确保所有危重症患者均可达到治疗性抗菌药物暴露。指南通过分析危重症患者的PK、CL、Vd及PD,结合TDM的基本原则探讨分析后明确表示,对于危重症患者使用氨基糖苷类、β-内酰胺类、替考拉宁、万古霉素、利奈唑胺等抗菌药物时,建议常规进行TDM;使用其他抗菌药物(如复方新诺明、达托霉素、氟喹诺酮类、黏菌素、多黏菌素B等)时既不推荐也不反对TDM。
目前,在我国主要开展的TDM有免疫抑制剂(如环孢素)、抗肿瘤药物(如甲氨蝶呤)、抗菌药物(如万古霉素)等。目前,国内TDM发展尚不均衡,开展TDM项目的主要是一些三甲医院,基层医院开展较少;其次,国内缺乏统一的TDM标准,造成了医院间检测报告存在一定差异。本文通过对指南中部分内容进行解读,以期为我国危重症患者抗菌药物的使用以及进一步开展TDM工作提供一定帮助。
利益冲突所有作者均声明不存在利益冲突

