TACE联合超声引导经皮微波消融治疗术后复发性肝细胞癌的临床研究
姜婷婷, 牟培源, 段伟宏, 刘全达, 白媛媛, 雷磊
(1.锦州医科大学 火箭军特色医学中心联合培养基地 肝胆外科, 辽宁 锦州 121000;2.中国人民解放军火箭军特色医学中心 肝胆外科, 北京 100088)
肝细胞癌(hepatocellular carcinoma,HCC)全球每年新发病例数及死亡病例数约84.11万人和78.16万人[1]。肝癌根治性切除术是早期及中期HCC的主要治疗方式,但由于肝硬化背景以及活动性肝炎等因素导致术后复发率高[2]。据报道手术切除后肝癌五年复发率高达70%[3]。目前,肝癌根治性切除术后复发性肝癌(recurrent hepatocellular carcinoma,RHCC)患者的治疗方式包括肝移植、二次切除、肝动脉化疗栓塞(transcatheter arterial chemoembolization, TACE)和热消融等治疗方式。肝移植为那些不能进行手术切除的病人提供了治愈的希望,但很大程度上受供体短缺的限制。考虑首次肝癌根治性切除术后,残留肝脏较少、肝功能储备差、术区与腹腔粘连加重和肝内结构改变导致二次手术难度加大等因素,仅有小部分RHCC患者能够进行二次手术切除[4]。TACE被认为是中晚期肝癌患者的一线治疗方式,但其治疗效果受肿瘤大小、位置、动脉血供的影响,疗效并不显著[5-6]。有研究指出,在肝癌的治疗中TACE联合射频消融或微波消融(transcatheter arterial chemoembolization combined with microwave ablation, TACE-MWA)比单独TACE、单独热消融的疗效更好[7-8]。TACE-MWA作为一种联合治疗策略,在治疗HCC中得到广泛应用,但在RHCC中的研究尚未见报道。本研究通过回顾性分析,比较TACE-MWA与单独TACE治疗RHCC的远期疗效。
1 资料与方法
1.1 一般资料
本研究获得中国人民解放军火箭军特色医学中心伦理审查委员会的批准(KY2022021)。回顾性分析2014年1月至2017年12月在我院接受治疗的RHCC患者的临床资料,所有经TACE或TACE-MWA治疗的患者均纳入研究。所有患者术前均经病理学或非侵入性肝癌诊断标准诊断为肝癌复发[9]。纳入标准:(1)肝癌根治性切除术后首次复发的肝癌;(2)因各种原因不能再次手术切除或肝移植;(3)Child-Pugh分级为A级或B级;(4)超声检查可见病灶,并存在可供消融的安全路径;(5)凝血功能正常。排除标准:(1)存在肝外转移;(2)合并有其他恶性肿瘤;(3)存在门静脉癌栓。所有患者治疗前均被告知治疗意义以及可能出现的并发症,并签署手术知情同意书。
1.2 试剂及仪器
超声诊断仪为Aloke-F75,探头为UST-2200;微波治疗仪为南京亿高ECO-100AI10,频率2 450 MHz,功率 40~65 W,微波针为ECO-100AI10;5F动脉导管或RH导管(泰尔茂,日本)及3F微型导管(ASKIA公司),空白栓塞颗粒(迈瑞通医疗器械公司)。
1.3 治疗方式
1.3.1 TACE治疗
TACE手术是经超声选择后进行肝动脉化疗栓塞。采用改良Seldinger技术穿刺右侧股动脉后行选择性动脉造影。明确肿瘤供血动脉后,将3F微型导管放入肿瘤供血动脉。根据肿瘤情况,将化疗药物(表柔比星20 mg、奥沙利铂60 mg)与碘化油1∶1混合后与2 mL空白栓塞颗粒(100~300 μm)形成混合乳剂注入肿瘤供血动脉(血流停滞时结束),最后应用明胶海绵颗粒进行栓塞治疗。
1.3.2 TACE-MWA治疗
MWA治疗在TACE治疗后2周内进行[10]。根据肿瘤的部位、大小、数目等确定微波消融的输出功率及消融时间,消融遵循由深到浅、多点消融的原则,其消融范围要超过肿瘤边缘0.5~1.0 cm,紧邻重要器官的肿瘤部分,保证安全的前提,尽可能实现病灶的完全消融。对于肿瘤靠近胃肠或膈肌等关键部位的患者,则使用人工腹水或人工胸水。对于直径大于5 cm的肿瘤,为达到一次灭活目的,可采用直接肿瘤双针消融。肿瘤消融结束前20 s,热针出针,即边消融边退针,防止针道止血以及肿瘤细胞经针道转移。消融结束后,再次对肝脏行超声检查,观察有无出血等并发症。
两组患者术后均行常规对症、保肝治疗措施。
1.4 观察指标
术后1个月行增强MRI或增强CT,根据实体肿瘤反应评估标准(mRECIST)评估肿瘤反应,分为完全缓解(complete remission, CR),部分缓解(partial remission, PR),疾病进展(progression disease, PD),稳定期疾病(stable disease, SD)[11]。客观缓解率(objective response rate, ORR)定义为CR和PR之和,肿瘤控制率(disease control rate, DCR)定义为CR、PR和SD之和。对于未完全缓解(增强CT或增强MRI呈现部分强化的患者),给予额外的抗癌治疗(TACE、MWA、索拉非尼等)。 住院期间,观察、记录患者术后并发症,并根据介入放射学学会临床实践指南进行分类[12]。
术后2年内每3~4个月随访一次,2~5年每6个月随访一次,5年后每12个月随访一次,每次均进行增强影像学检查,生化肝功能检查和血清AFP检查。主要观察指标为总生存期,次要观察指标为无进展生存期。
1.5 统计学方法
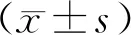
2 结果
2.1 病人基线资料
107例患者纳入研究对象,60例接受单独TACE治疗,47例接受TACE-MWA治疗。两组患者的基线情况见表1。两组患者在年龄,性别,病毒性肝炎,肿瘤大小等方面差异均无统计学意义,但两组肿瘤数目差异具有统计学意义(P=0.017)。经1∶1 PSM后,两组患者各38人纳入研究对象,所有变量在两组间不存在统计学差异。
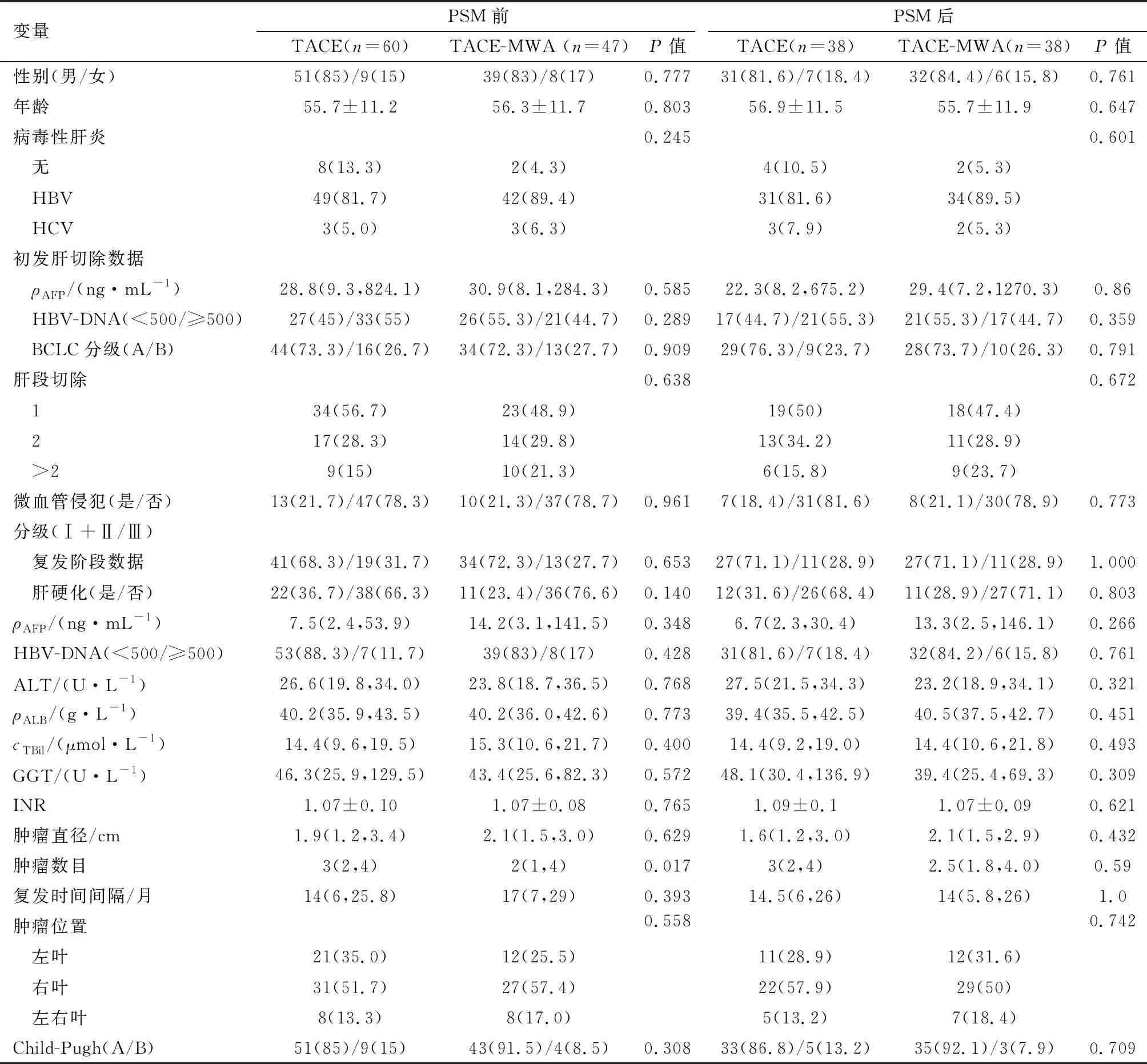
表1 病人基线资料
2.2 肿瘤反应
根据mRECIST标准,在治疗1个月后比较两组的肿瘤控制情况。CR,PR,SD,PD率在TACE组和TACE-MWA组分别为30%,28.3%,25%,16.7%和51.1%,23.4%,14.9%,10.6%(P=0.030)。ORR在两组分别为58.3%,74.5% (P=0.082),DCR在两组分别为83.3%,89.4%(P=0.373)。PSM后,CR,PR,SD,PD率在TACE组和TACE-MWA组分别为21.1%,28.9%,28.9%,21.1%和52.6%,23.7%,10.5%,13.2%(P=0.006)。ORR在两组分别为50.0%,76.3%(P=0.018), DCR在两组分别为78.9%,86.8%(P=0.361)。其中,1例患者(男,47岁,右叶5.9 cm复发性肝癌)接受治疗后的影像图如图1。

A:术前增强CT提示复发性肿瘤呈不均匀高增强;B:TACE术后,CT显示肝内弥漫性碘油摄取;C:MWA术后1 d增强MRI提示肿瘤未见明显增强;D:TACE-MWA治疗1个月后,MRI显示肿瘤完全缓解。
2.3 生存期和无进展生存期
两组患者中位随访期分别为24个月和36个月,中位生存时间分别为11个月和23个月。TACE组1,3,5年生存率分别为70%,33.9%,17.7%;TACE-MWA组1,3,5年生存率分别为80.9%,54.6%,35%(P=0.027,图2A)。TACE组1,3,5年无进展生存率分别为46.7%,19.4%,13.4%;TACE-MWA组1,3,5年无进展生存率分别为68.1%,35.9%,28.9%(P=0.029,图2B)。两组患者1,3,5年生存率及无进展生存率差异具有统计学意义。PSM后TACE组1,3,5年生存率为73.7%,33.4%,15.3%; TACE-MWA组1,3,5年生存率为78.9%,57.3%,39.5%(P=0.038,图2C)。PSM后TACE组1,3,5年无进展生存率为50%,18.4%,12.6%;TACE-MWA组1,3,5年无进展生存率为71.1%,39.5%,31.2%(P=0.049,图2D)。与PSM前两组患者生存率以及无进展生存率结果类似,差异具有统计学意义。
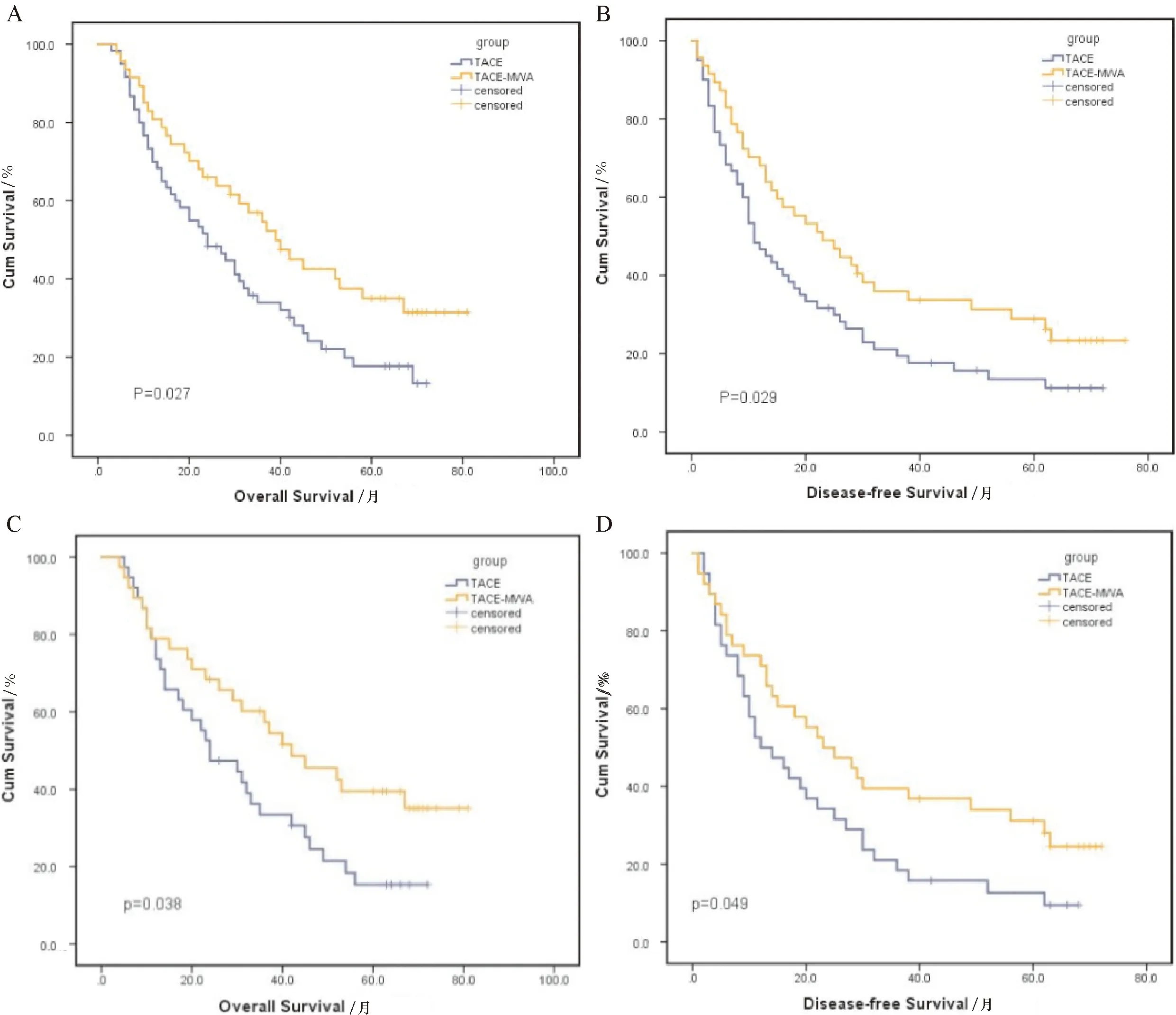
A:PSM前TACE组和TACE-MWA组生存曲线图;B:PSM前TACE组和TACE-MWA组无进展生存曲线图;C:PSM后TACE组和TACE-MWA组生存曲线图;D:PSM后TACE组和TACE-MWA组无进展生存曲线图
2.4 亚组分析
在亚组分析中,复发时间间隔(recurrent time, TTR)≤1年,TACE组(n=26)1,3,5年生存率分别为69.2%,21.4%,12.8%;TACE-MWA组(n=18)1,3,5年生存率分别为55.6%,27.8%,16.7%(P=0.959,图3A)。TTR>1年,TACE组(n=34)1,3,5年生存率分别为70.6%,43.2%,21.3%;TACE-MWA组(n=29)1,3,5年生存率分别为96.6%,71.2%,46.6%(P=0.020,图3B)。
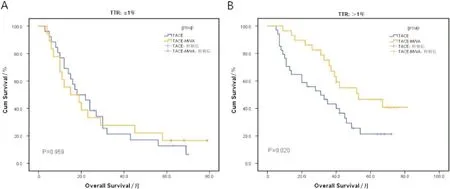
A:TTR≤1年,TACE组和TACE-MWA组生存曲线图;B:TTR>1年,TACE组和TACE-MWA组生存曲线图
2.5 预后影响因素
单因素分析显示,初发时AFP,初次肝切除后微血管侵犯(microvascular invasion, MVI),肿瘤分化程度,TTR,复发肿瘤直径,复发肿瘤数目,复发时AFP,复发时GGT以及复发后治疗方式的选择对患者的生存状态有显著影响。经Cox回归分析后,肿瘤分化程度低(HR,2.23;CI,1.29~3.854;P=0.004),MVI阳性(HR, 2.297;CI, 1.133~4.656;P=0.027)以及复发肿瘤直径>3 cm(危险比[HR], 2.532;95%可信区间[CI] 1.457~4.398;P=0.001)是影响总生存期的独立危险因素。初发时AFP,MVI,肿瘤分化程度,TTR,复发肿瘤直径,复发肿瘤数目,复发肿瘤位置,复发时AFP以及治疗方式的选择对无进展生存期有显著影响。经Cox回归分析后,肿瘤分化程度低(HR,1.851; CI, 1.087~3.154;P=0.023),MVI阳性(HR,2.143; CI,1.093~4.205;P=0.027)以及复发肿瘤直径>3 cm(HR,1.904;CI,1.087~3.335;P=0.024)是影响无进展生存期的独立危险因素(表2)。

表2 根据初发期和复发期的数据,对总体生存率和无进展生存率进行多因素分析
2.6 并发症
术后,TACE组中23例患者(38.3%)存在轻微并发症(发热、疼痛、呕吐等);TACE-MWA组中31例患者(66.0%)存在轻微并发症(P=0.005)。患者出院前所有症状均得到缓解。两组患者均未出现与TACE或MWA有关的死亡或严重并发症。
3 讨论
复发是肝癌患者治疗后观察到的最严重不良事件。重复肝切除是RHCC患者有效的治疗方式,然而由于不愿或不能二次手术,重复肝切除术概率仅为15.8%~22.8%[13]。且有报道称,反复肝切除会缩短无瘤生存时间[14]。尽管TACE-MWA治疗在总体生存率以及无进展生存率方面低于手术切除,但由于其具有高度可重复性和可行性,成为复发性肝癌的重要选择方式[15-16]。
在本研究中TACE-MWA组CR率明显高于TACE组,这与Liu等[17]和Wei等[18]的分析结果相类似,而较高的CR率可能延长局部肿瘤进展时间。首先,TACE对肿瘤供血血管进行栓塞,减少后续MWA治疗的热沉效应[19];其次,碘油的沉积使局部肿瘤组织水肿并增加其含水量,从而提高局部消融温度使得消融范围更为广泛[20]。再次,TACE后肿瘤组织内残留的化疗药物和碘油受消融的高温影响,增加其药物毒性;最后,残留的化疗药物可以增加肿瘤细胞的热敏效应[21]。另外,与HCC相比较,RHCC中的微小病灶更常见,而这些病灶在术前的影像学扫查时常不显影,TACE治疗期间进行的数字减影血管造影技术可以检测到这些微小病灶,并在后续治疗中进行化疗栓塞,减少肿瘤复发[8]。
最近的一项研究表明[22],TACE-MWA治疗RHCC的5年生存率和无进展生存率分别为49.1%和29.6%,优于本研究结果,可能是由于本研究纳入研究对象的肿瘤数目更多,肿瘤直径更大。也有研究表明肿瘤直径>3 cm,肿瘤数目较多是患者总体生存率和无进展生存率的重要影响因素[23]。在一项研究显示,对于TTR≤1年的患者,TACE与RFA的生存结果相似[24]。在Zhang等[25]的研究中,对于早期肝内复发,TACE可能与再次手术切除或RFA一样有效(P=0.253)。在另一项研究中,TTR是无进展生存期中唯一显著的独立危险因素[26]。与之前的研究结果一致,在本研究亚组分析中,TTR≤1年的两组患者的5年生存率相似(P=0.959)。有研究表明,早期复发多为手术切除不彻底,残余肿瘤细胞导致肝内复发和转移[27]。本研究认为早期复发肿瘤多为多发微小病灶,TACE的应用可以栓塞肿瘤动脉,并可以通过门静脉-肝动脉短路栓塞肿瘤周围门静脉,提高微转移病灶清除机率[28]。
既往研究表明,初次肝切除时MVI阳性不仅是患者术后早期复发的重要影响因素,对患者复发后的生存率也有显著影响[9,29]。Han等[30]的报道中,MVI阳性的患者1年内肿瘤复发率达80.9%。多项研究表明,TTR≤1年、MVI阳性和非解剖性肝切除的患者复发肿瘤多为单克隆起源,复发肿瘤单克隆起源代表着较高的肿瘤负担和更具侵袭性的肿瘤行为[31]。本项研究中,肿瘤分化程度,MVI和复发肿瘤直径,是影响患者总生存期和无进展生存期的危险因素,与之前的研究类似[10,25]。本研究中,经PSM后TACE-MWA组与TACE组的1年生存率相接近(78.9% vs. 73.7%),与这部分患者在初次肝切除时MVI阳性有关。
除此之外,本研究还对TACE-MWA治疗RHCC的安全性进行了评估,结果显示TACE-MWA组轻微并发症发病率明显高于TACE组,但经治疗后均得到有效缓解;两组患者均未发生与治疗相关的严重并发症,与Chen等[21]的研究结果相似。而在Wang等[7]的研究中,TACE-MWA治疗复发性肝癌的严重并发症发病率为6.9%,明显高于本研究,考虑与本研究术前充分评估可供消融的安全路径有关。
综上,TACE-MWA是一种安全有效的治疗复发性肝癌的方法,尤其在复发时间>1年的患者中,TACE-MWA的疗效明显优于单独TACE。肿瘤分化程度低,MVI阳性和复发肿瘤直径>3 cm 是影响患者无进展生存期和总生存期的独立危险因素。同时本研究也存在一些局限性,由于本研究为回顾性研究,结果会受到选择偏差的影响,尽管采用了PSM,但选择偏倚不可避免;另外,由于本研究对象数量较少,限制了分析的稳健性,在后续的研究中会加入更多的样本进行研究。
作者贡献声明
姜婷婷:设计实验、统计分析数据,撰写论文;牟培源,段伟宏,刘全达:提出研究思路和框架,修改论文;白媛媛,雷磊:数据收集。
利益冲突声明
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突。

