不同清洗用水对复用医疗器械清洗质量的影响
周 荣,吴利娜,王 芳,秦 香,姚 欣
(西北大学附属医院西安市第三医院消毒供应中心,陕西西安,710021)
医院消毒供应中心集中处置全院复用医疗器械,水在医疗器械的处理过程中起着至关重要的作用[1]。清洗水质是影响器械清洗质量的重要因素之一[2]。研究表明,清洗不彻底的医疗器械引发灭菌质量下降和潜在感染风险[3]。《WS 310-2016医院消毒供应中心》(以下简称WS 310.1—2016)中指出清洗用水要求应有自来水、热水、软水、经纯化的水供应[4]。在WS 310—2016术语和定义中表述,清洗的过程包括冲洗、洗涤、漂洗和终末漂洗,标准中对冲洗、洗涤、漂洗用水均没有明确水质要求,仅对终末漂洗明确应采用经纯化的水(电导率≤15μS/cm,25 ℃)[5]。其他清洗阶段用何种水质,行业标准没有给出具体的答案,全国内相关的研究也比较少,难以指导具体工作。Nakayama[6]等研究后认为,金属手术器械的日常维护必须监测清洗水质。也有学者调查发现,国内医院的全自动喷淋清洗消毒器用水标准不统一[7]。针对上述问题,本研究采用目测、带光源放大镜观察、ATP生物荧光检测技术,对比不同水质对于复用医疗器械的清洗效果差异,为消毒供应中心去污区用水标准提供参考。
1 资料与方法
1.1 一般资料
选取2019年12月—2020年6月消毒供应中心接收的360组服用手术器械为研究对象。纳入标准:①普通不锈钢器械,完整、无锈;②器械含有轴节、关节部分;③在完成手术1 h内能进行清洗处理。排除标准:①管腔器械;②特殊材质器械;③外来器械;④动力器械。
360组器械中,根据器械污染程度的不同进行分层便利抽样,其中重度污染76(21.11%)组,中度污染 127(35.28%)组,轻度污染 157(43.61%)组。不同污染程度的器械在不同清洗水质组按比例均衡分布,自来水组共计100组器械,软水组共计153组器械(原计划软水100组器械,因确认结果加做53组,加做软水处理53组与初始软水处理100组经统计学分析无差异),纯水组107组器械。本研究已获医院伦理委员会批准,符合WS 310-2016等相关行业标准的要求。
1.2 方法
为减少设备误差,以下操作均使用同一台设备,超声清洗机洗涤,煮沸消毒机消毒,热力干燥设备干燥,ATP检测仪、8倍放大镜检测清洗质量。
1.2.1 实验材料:自来水统一采用市政提供,硬度250~300 mg/L,电导率126~145μs/cm(25℃);软水为医院制备软水,硬度0,电导率130~145μs/cm(25℃);纯水为医院制备纯水,硬度0,电导率0~2μs/cm(25℃)。其他材料包括:水质硬度试剂、同一品牌进口清洗酶及器械润滑剂。
1.2.2 实验流程:采用不同组别清洗水质(分别为自来水、软水、纯水,软水和纯水的硬度经检测均应为0),首先对器械进行冲洗,冲洗时间约约1 min,至去除可见污染物。然后选择超声清洗(45 Hz,5 min),采用同上一步骤相同水质对超声清洗后器械进行初漂(2 min),然后流动纯水进行终末漂洗(2 min),消毒采用煮沸机湿热消毒(90℃,1 min),干燥采用机械热力干燥(90℃,20 min)。
1.3 观察指标
1.3.1 清洗前器械污染程度:重度污染为30%以上器械表面有肉眼可见血液及组织残留;中度污染为30%以下器械表面有肉眼可见血液及组织残留;轻度污染为器械表面没有肉眼可见血液及组织残留。
1.3.2 清洗质量评价:①目测法和带光源放大镜检测:采用目测法和带光源放大镜检测清洗干燥后的复用医疗器械,器械表面及其关节、齿牙处应光洁,无血渍、污渍、水垢等残留物质和锈斑[5]。②ATP生物荧光检测:取每组器械3把止血钳,按照ATP采样说明用采集棉拭子擦拭关节处,进行检测并记录结果数据。ATP生物荧光检测相对发光值(RLU)<4000为合格,≥4000为不合格。
1.4 统计学方法
采用SPSS 26.0软件,计量资料因不符合正态性,采用中位数(百分位间距)[M(P25,P75)]表示,3组组内差异采用K个独立样本秩和检验,组间比较采用两独立样本秩和检验;计数资料以百分率(%)表示,采用χ2检验;组内比较检验水准α=0.05,3组间两两比较α=0.05/3,P<0.05为差异有统计学意义。
2 结果
2.1 目测法和带光源放大镜检测结果
通过目测法和带光源放大镜检测,自来水组的合格率为95.00%,软水组合格率为94.77%,纯水组的合格率为98.13%,三组清洗质量合格率差异无统计学意义(P>0.05),见表1。
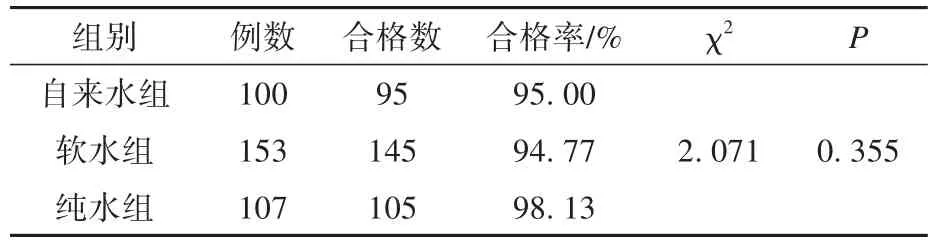
表1 三组目测法和带光源放大镜检测结果
2.2 不同污染程度器械清洗质量ATP测定结果
轻度污染器械清洗后ATP检测值的中位数为375.00,中度污染器械清洗后ATP检测值的中位数为675.00、重度污染器械清洗后ATP检测值为1518.50。采用非参数检验,轻度污染分别和中度污染、重度污染比较,差异有统计学意义(P<0.01);中度污染和重度污染比较,差异有统计学意义(P=0.015)。见表2。

表2 不同污染程度器械清洗质量ATP测定值比较[M(P25,P75)]
2.3 不同水质处理后器械ATP检测清洗合格率及ATP测定值的比较
2.3.1 不同水质处理后器械ATP检测清洗合格率:根据ATP检测合格值判定,自来水清洗合格率是92.00%,软水清洗合格率是90.20%,纯水清洗合格率是99.07%。纯水组清洗合格率和自来水组、软水组清洗合格率比较,差异有统计学意义(P<0.05),自来水组和软水组清洗合格率比较,差异无统计学差异(P>0.05)。见表3。

表3 不同水质处理后器械ATP测定值合格率比较[n(%)]
2.3.2 不同水质处理后器械ATP测定值的比较:自来水组、软水组、纯水组器械清洗后测定的ATP值组间比较,自来水组和软水组ATP测定值比较,差异无统计学差异(P>0.05);自来水组、软水组分别和纯水组ATP测定值比较,差异有统计学意义(P<0.01),其结果和3组水质清洗后合格率比较一致。见表4。

表4 不同水质处理后器械ATP测定值合格率比较[n(%)]
3 讨论
3.1 ATP生物荧光检测和目测法及带光源放大镜检测的比较
ATP为细胞内能量物质,普遍存在于微生物、植物和动物细胞中。ATP生物荧光技术利用荧光蛋白酶将ATP转换为光信号,仪器测量后得到荧光强度,以相对荧光强度RLU表示。ATP生物荧光技术具有ATP特异性,灵敏度高,是评估医疗器械和物体表面的清洁水平及潜在风险的一个客观指标。ATP荧光监测法可用于检测医疗器械的生物残留,为评估清洁水平、改善清洁程序提供一种客观、实时的手段[8]。通过ATP生物荧光检测,可反映器械有机物含量,为清洗质量判断提供依据[9]。相比其他检测方法,以ATP生物荧光检测评估手术器械清洗质量,准确性及科学性更高[10]。本研究采用ATP检测仪实时检测不同分组器械的清洗质量,能较科学的反映出其的清洗质量水平。目测法为传统的器械检查方法,容易受人为因素影响,相较ATP测定而言,ATP检测更具客观和一致性。本研究发现,目测法判定的器械清洗合格率差异小于ATP测定的差异,说明ATP测定能更有效地检测出目测或借助放大镜器械下不能发现的清洗问题。
3.2 使用科室对器械预处理质量影响消毒供应器械清洗质量
研究表明,医疗器械清洗不彻底易形成包含微生物的生物膜,从而对后期的灭菌效果产生影响[11]。也有研究表明,污染器械在使用科室进行及时预处理可最大限度保证器械的清洗质量和灭菌效果[12]。杨秀梅等[13]研究表明应用流水冲洗联合喷洒泡沫型多酶保湿剂预处理保湿方案,能更有效提高清洗质量。本研究结果显示,消毒供应中心回收的器械,清洗前污染程度越重的器械,其清洗质量越差;清洗前污染程度轻的器械,清洗效果越好。据此分析,使用科室预处理质量越好的医疗器械,其生物负载越低,在消毒供应中心的清洗效果越好。清洗的效果直接影响医疗器械的灭菌质量,高质量的清洗可保证患者的医疗安全。因此,医疗器械使用后预处理的重要性不言而喻。目前,多数使用医疗器械的科室对于医疗器械使用后预处理缺乏足够的认知和重视,消毒供应中心回收的使用后医疗器械,经常会沾有血液、体液和组织。建议加强科室使用器械后第一时间预处理的工作质量,减少严重污染器械的存放和送消,可提高消毒供应中心器械清洗处理的质量,保证医疗器械的灭菌效果,为患者提供安全医疗服务。
3.2 采用纯水进行冲洗、洗涤、漂洗的普通器械,其清洗质量优于其他水质清洗的器械
软水不含或含较少可溶性钙、镁化合物,自来水根据不同地区含有数量不等的可溶性钙镁化合物,纯水不含任何杂质。水中溶解的化学物质的风险包括对于医疗器械和设备损害,附着在器械或者设备表面的沉淀物转化为对患者有害的物质[14]。水中溶解的离子如氯离子(Cl⁻)和原硅酸根离子(SiO44-),尤其是 Cl⁻,令人担忧,因为随着时间的推移,其会导致点蚀,而SiO44-会导致结垢。考虑到手术室环境的典型水质,金属手术器械的一般维护必须监测其降解情况[6]。本次研究显示,采用三种不同的水质清洗后的器械,经目测法和带光源放大镜检测,纯水的合格率最高,自来水和软水差异无统计学意义(P>0.05)。ATP检测进一步客观验证了纯水清洗的效果优于自来水和软水的清洗效果。自来水和软水中富含的钙镁离子或其他微粒,会对于目前规范流程处置的医疗器械的清洗质量产生不好的影响,影响的方式可能与清洗剂的互相作用、终末漂洗后的微量残余有关系,具体原因需要进一步研究。就目前结果而言,医疗器械的清洗过程,采用纯水处置优于自来水、软水的处置。纯水处置可降低肉眼不能发现的微生物负载,使患者更加安全。自来水组与软水组处置差异并无统计学意义,说明在清洗与初漂阶段采用自来水或者软水,其清洗质量并没有显著区别。目前很多医疗机构清洗都采用软水清洗医疗器械,仅在终末漂洗阶段使用经纯化水(电导率≤15μS/cm,25℃)。建议区域医疗中心因开展的手术难度大、耗时长,无菌要求更高,其消毒供应中心优先选择纯水清洗处置医疗器械。对于基层、小型医疗机构,根据医院诊疗范围及控感要求,处理医疗器械时可灵活采用纯水、自来水或软水清洗。在采用自来水或软水清洗后,可合理增加终末漂洗的时间,尽量避免器械上有残余的杂质,在保证患者安全的前提下减少对于水资源的损耗。
本研究中,考虑到自来水硬度会随不同地区变化,并且也未涉及到硬水的结垢对医用器械和设备的影响,因此建议综合考虑多种因素,确保为消毒供应中心去污区选用符合自身医疗机构需求的最优的水质方案。
利益冲突声明:作者声明本文无利益冲突。

