枇杷花多酚纳米颗粒的制备工艺及其特性研究
谢子玉,薛 琛,文祖会,赵雯靓,徐丽珊,2*
(1 浙江师范大学化学与生命科学学院 浙江金华 321004 2 浙江省特色经济植物生物技术研究重点实验室 浙江金华 321004)
枇杷花为蔷薇科枇杷属植物枇杷【Eriobotrya japonica (Thunb.) Lindl】的花,富含萜类、多酚类和挥发油等成分[1],可药食两用。多酚类物质是植物体内的次生代谢物,具有抗氧化、抗肿瘤、抗炎和抗菌等生物活性[2-5],在食品添加剂、保健和医药等行业具有较大开发潜力。然而,多酚类物质对环境敏感度高,在高温、光照、氧气等条件下易失活[6],限制了其应用。
许多研究者发现蛋白质-多糖静电复合物经高于蛋白质变性的温度处理后能进一步暴露疏水基团,所形成的蛋白-多糖颗粒通过疏水、氢键等弱相互作用对多酚类物质进行包载[7-9],从而有效提高多酚类物质的稳定性和生物利用度。Li 等[10]通过热处理制得的表没食子儿茶素没食子酸酯(EGCG)-BSA-ι-卡拉胶纳米颗粒,对EGCG 的包埋率为78%,与未经热处理的天然BSA 和纯BSA体系相比,BSA-ι-卡拉胶体系令EGCG 具有更强的稳定性和DPPH·清除活性。多糖的存在不仅能够稳定蛋白质在热处理中构象变化和减少大集聚体的形成[7,11],也能进一步提高样品的包埋率。李阳[12]研究表明经热处理制得的β-乳球蛋白-阿拉伯胶纳米颗粒,对不同浓度EGCG 溶液的包埋率均高于纯β-乳球蛋白纳米颗粒。此外,关于制得的蛋白质-多糖纳米颗粒大小、Zeta 电位和稳定性与蛋白质浓度、蛋白质与多糖比例、多糖类型、缓冲液pH 值及浓度、热处理温度和时间等因素密切相关[13-14]。
目前有关蛋白质-多糖纳米颗粒包载多酚类物质的研究主要集中在以EGCG、姜黄素等常见多酚类物质为芯材,探究不同类型蛋白质-多糖体系对多酚的包埋效果和多酚与蛋白质的结合机理等方面。以植物多酚提取物为芯材,制备多酚-蛋白质-多糖纳米颗粒和优化制备工艺的研究较少。本研究以枇杷花多酚为芯材,以常见载体蛋白-BSA 和阴离子多糖-ι-卡拉胶为包埋材料,通过热处理制备枇杷花多酚纳米颗粒。以包埋率为指标,通过筛选纳米颗粒制备过程中的重要影响因素,设置单因素实验和响应面试验确定最佳制备工艺,并对最佳工艺下制得的枇杷花多酚纳米颗粒进行特性研究。本研究为多酚活性的保持和其它植物提取物中多酚类物质纳米颗粒的制备提供参考。
1 材料与方法
1.1 材料与试剂
枇杷花(早钟六号),中国福建漳州;牛血清白蛋白(BSA)、福林酚,国药集团化学试剂有限公司;ι-卡拉胶,上海源叶生物科技有限公司;1,1-二苯基-2-苦基肼自由基 (DPPH·)(纯度>97%),日本东京化成工业公司;其它试剂均为分析纯级,国药集团化学试剂有限公司。
1.2 设备与仪器
R-210 旋转蒸发仪,瑞士步琦有限公司;10Kd超滤离心管,法国密理博公司;Centrifuge 5427R台式高速冷冻离心机,德国艾本德股份公司;UV-2450 紫外-可见分光光度计,日本岛津公司;Zetasizer Nano ZS90 纳米粒度电位分析仪,英国马尔文仪器有限公司;S-4800 扫描电子显微镜,日立高科公司。
1.3 试验方法
1.3.1 枇杷花多酚的纯化 取适量枇杷花粉末,按料液比为1∶20 加入70%乙醇溶液,水浴60 ℃,提取2 h,抽滤。滤液经减压旋转蒸发,50 ℃烘干至恒重,得到多酚粗提物。将粗提物用适量去离子水溶解后,依此用石油醚、二氯甲烷、乙酸乙酯、正丁醇多次萃取(极性从小到大),萃取液和水相,经减压旋转蒸发,50 ℃烘干至恒重,得到石油醚相(PF)、二氯甲烷相(DF)、乙酸乙酯相(AF)、正丁醇相(BF)和水相(WF)萃取物。
1.3.2 多酚含量及DPPH·清除活性的测定 采用Folin-Ciocalteu 法[15],以没食子酸为标准品,测定各萃取物多酚含量;参考Islam 等[16]的方法测定各萃取物的DPPH·清除活性。将高含量且高活性萃取物作为芯材,置于4 ℃的冰箱中避光储藏,备用。
1.3.3 枇杷花多酚纳米颗粒的制备及包埋率的测定 参考Li 等[10]的方法并稍作修改。将BSA 及ι-卡拉胶溶于30 mmol/L 的磷酸缓冲液(PBS)中,混合均匀。芯材溶于50%乙醇中,现配现用。取1.9 mL 的BSA-ι-卡拉胶复合溶液水浴加热20 min,冷却至室温,加入0.1 mL 芯材溶液,快速漩涡混合20 s,得枇杷花多酚纳米颗粒。取一定量的枇杷花多酚纳米颗粒移入超滤浓缩离心管中,4 ℃下8 000 r/min 离心50 min,得到游离的枇杷花多酚溶液,测定游离多酚的量,按式(1)计算包埋率:

1.3.4 枇杷花多酚纳米颗粒单因素实验 基本工艺参数为:PBS 的pH 值为6.4、ι-卡拉胶与BSA的质量比为4∶15、BSA 与芯材质量比为7∶1、BSA质量浓度为2 mg/mL、水浴加热温度为80 ℃。在其它因素不变的情况下,选择PBS 的pH 值分别为5.6,6.0,6.4,6.8,7.2;ι-卡拉胶与BSA 的质量比分别为0∶15,2∶15,4∶15,6∶15,8∶15;BSA 与芯材质量比分别为7∶1,14∶1,21∶1,35∶1,42∶1;BSA 质量浓度分别为0.5,1,2,3,4 mg/mL;水浴加热温度分别为50,60,70,80、90 ℃,进行单因素实验,考察各因素对枇杷花多酚包埋率的影响。
1.3.5 枇杷花多酚纳米颗粒响应面试验 在单因素实验基础上,确定BSA 质量浓度为1 mg/mL,水浴加热温度为80 ℃,选取PBS 的pH(A)、ι-卡拉胶与BSA 的质量比(B)、BSA 与芯材质量比(C)为考察因素,以包埋率为响应值,根据Box-Behnken中心组合设计原理,设计三因素三水平响应面优化分析试验,以确定最佳包埋工艺,因素与水平设计见表1。

表1 响应面试验因素与水平Table 1 Factors and levels of response surface experiment
1.3.6 枇杷花多酚纳米颗粒特性研究
1.3.6.1 粒径和Zeta 电位的测定 利用纳米粒度电位分析仪测定枇杷花多酚纳米颗粒的粒径分布、平均粒径及Zeta 电位。检测条件:扫描波长633 nm,散射角90°,温度25 ℃,测量前样品在测量池中平衡2 min。
1.3.6.2 扫描电镜分析 利用扫描电镜观察枇杷花多酚纳米颗粒的微观形态。取适量样黏贴于载样台,进行电镜观察,加速电压为5 kV。
1.3.6.3 枇杷花多酚稳定性试验 将未经包埋的枇杷花多酚和多酚纳米颗粒(多酚浓度相同)分别于常温避光、常温光照、避光水浴60 ℃及避光水浴80 ℃的环境下,静置9 h。根据试验前、后对DPPH·清除活性的变化,判断包埋处理对枇杷花多酚稳定性的影响。
1.4 数据分析
所有试验重复3 次以上,采用IBM SPSS Statistics 21 软件对试验数据进行差异显著性分析(P<0.05),采用Design-Expert 8.0 进行响应面试验设计,采用Origin 9.0 作图。
其中SPO代表RDF三元组中的主体、谓词和客体。t是一个自然数,用来代表时间,表示在t时刻s的p属性值为o是有效的。
2 结果与分析
2.1 各萃取物多酚含量及DPPH·清除活性
枇杷花多酚粗提物各萃取物的多酚含量及DPPH·清除活性如图1所示。AF 的多酚含量为(424.49±1.54)mg GAE/g,在相同试验质量浓度下(25 μg/mL)对DPPH·的清除率为(90.50±0.44)%,两者均高于其它萃取物,故选择其作为后续试验芯材。

图1 各萃取物多酚含量及DPPH·清除活性Fig.1 Polyphenol content and DPPH· scavenging activity of extracts
2.2 枇杷花多酚纳米颗粒的单因素实验
2.2.1 PBS 的pH 值对多酚包埋率的影响 图2为PBS 的pH 值对多酚包埋率的影响。随着pH 值的增加包埋率显著增加,当pH 值为6.4 和6.8时,包埋率最大,两者无显著差异,继续增加pH值,包埋率显著降低。推测这是因为在PBS 的pH值逐渐接近等电点时,BSA 与ι-卡拉胶之间的相互作用加强,两者在热处理时不易解离,且易碰撞形成大聚集体,阻碍了样品与内部蛋白质疏水基团的结合。当PBS 的pH 值较大时,BSA 与ι-卡拉胶的吸引较弱,部分蛋白质以游离态存在,而形成蛋白质-多糖静电复合物的蛋白质在热处理过程中易被释放,易形成纯蛋白质的聚集体[17],因而减少了BSA-ι-卡拉胶颗粒的形成,令包埋率降低。

图2 pH 值对包埋率的影响Fig.2 Effects of pH value on the embedding rate
2.2.2 ι-卡拉胶与BSA 质量比对多酚包埋率的影响 图3为ι-卡拉胶与BSA 质量比对多酚包埋率的影响。当ι-卡拉胶与BSA 质量比为2∶15 及4∶15 时,包埋率最大,两者间无显著差异,进一步提高ι-卡拉胶与BSA 质量比,包埋率降低至与未添加卡拉胶试验组无显著差异。原因在于,适量的多糖有助于在热处理过程中防止BSA 折叠结构的过度展开,避免蛋白质间的聚集析出现象,提高BSA 溶解度[10]。徐乐颜等[9]的研究显示,姜黄素与BSA-К-卡拉胶、BSA-λ-卡拉胶间的结合常数均高于与纯BSA 间的结合常数,表现出更好的包载性能。随着ι-卡拉胶与BSA 质量比的进一步加大,推测多余的ι-卡拉胶在体系冷却过程中,更密集地结合在蛋白聚集体的表面或在小颗粒间起到连接作用,促进大集聚体的形成,从而阻碍多酚与内部蛋白质疏水基团结合,令包埋率降低。

图3 ι-卡拉胶与BSA 质量比对包埋率的影响Fig.3 Effects of mass ratio of ι-carrageenan to BSA on the embedding rate
2.2.3 BSA 与芯材质量比对多酚包埋率的影响 图4为BSA 与芯材质量比对多酚包埋率的影响。当BSA 与芯材质量比为14∶1 和21∶1 时,包埋率最大,两者间无显著差异。芯材投入量较高(BSA 与芯材质量比为7∶1)和较低(BSA 与芯材质量比为28∶1,35∶1) 的试验组对多酚的包埋率较低。原因在于,体系中较低浓度的芯材,不利于BSA-ι-卡拉胶颗粒对多酚的捕捉,而过高浓度的芯材存在包载饱和的问题,从而导致包埋率较低。

图4 BSA 与芯材质量比对包埋率的影响Fig.4 Effects of mass ratio of BSA to core on the embedding rate
2.2.4 BSA 质量浓度对多酚包埋率的影响 图5为BSA 质量浓度对枇杷花多酚包埋率的影响。当BSA 质量浓度为0.5,1 mg/mL 时,包埋率无显著差异,随着BSA 质量浓度的进一步增加,多酚包埋率逐渐降低。有研究表明,随着蛋白质质量浓度的增加,蛋白质集聚体成长的增速大于形成新集聚体的增速[18]。Jones 等[14]研究报道了蛋白质-多糖颗粒平均粒径随着蛋白质的质量浓度增加而增大,推测由更多BSA 及ι-卡拉胶所形成的大颗粒其内部疏水口袋不利于捕捉游离的多酚。综上,选择BSA 质量浓度为1 mg/mL 作为后续试验的固定条件。

图5 BSA 质量浓度对包埋率的影响Fig.5 Effects of mass concentration of BSA on the embedding rate

图6 热处理温度对包埋率的影响Fig.6 Effects of temperature of heat treatment on the embedding rate
2.3 枇杷花多酚纳米颗粒的响应面优化试验
响应面试验设计与结果见表2。通过软件进行多元回归分析,得到多酚包埋率(Y)对自变量pH(A)、ι-卡拉胶与BSA 质量比(B)和ι-卡拉胶与BSA 质量比(C)的二次多项回归方程:

表2 响应面试验设计与结果Table 2 Design and results of response surface experiment
Y=82.17+1.12A-0.90B+1.03C-0.063AB-0.27AC+1.53BC-1.41A2-2.59B2-2.56C2
回归方程的显著性检验及方差分析见表3。回归模型的P 值为0.0006<0.01,说明模型高度显著。失拟项为0.0896,没有达到显著水平,说明模型可以用来分析该工艺条件。独立变量A 和二次项变量B2、C2对包埋率的影响达到极显著水平;独立变量B、C 和二次项变量A2对包埋率的影响达到显著水平,表明这3 个因素与多酚包埋率有直接关系。

表3 回归模型的方差分析Table 3 Analysis of variance of regression model
通过响应面图形可以直观反映各因素以及两因素之间的交互作用对响应值的影响。图7为控制因素A 在0 水平,包埋率对因素B、C 所做的响应面图和等高线图。响应面图的陡峭程度和等高线图的轮廓形状反映了因素间不同程度的交互作用。因素B、C 之间存在明显的交互作用,并对多酚包埋率有极显著影响。

图7 因素B、C 交互作用对包埋率影响的响应面和等高线图Fig.7 Response surface and contour plots of interaction between factor B and C on the embedding rate
通过软件分析,枇杷花多酚纳米颗粒的最佳包埋条件为:pH=6.57,ι-卡拉胶与BSA 质量比3.75∶15,BSA 与芯材质量比14.95∶1,在此条件下多酚包埋率为82.52%。考虑实际,将最优工艺修正为:pH=6.6,ι-卡拉胶与BSA 质量比4∶15,BSA与芯材质量比15∶1,在此条件下进行验证试验,结果显示枇杷花多酚的包埋率为(82.12±0.48)%,与预测值无显著性差异,说明二次项回归模型具有较好的精确度与适用度,能够用于优化枇杷花多酚纳米颗粒的包埋工艺。
2.4 枇杷花多酚纳米颗粒的特性分析
2.4.1 粒径、电位及扫描电镜分析 在最佳制备工艺条件下所制得的枇杷花多酚纳米颗粒其粒径分布、Zeta 电位和微观形态分别如图8所示。测得其平均粒径为(126.0±5.38)nm,PDI 为0.43±0.02,属于适中分散分布。纳米颗粒的电位为(-31.1±0.42)mV,电位绝对值大于30 mV,表明所制备的纳米颗粒间具有较大斥力,稳定性较好[22]。扫描电镜下观察多酚纳米颗粒的微观形态,颗粒大致呈球形。
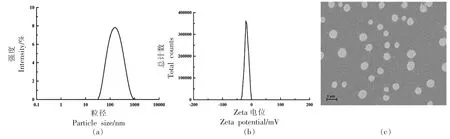
图8 枇杷花多酚纳米颗粒的粒径分布(a)、Zeta 电位(b)和扫描电镜图(c)Fig.8 Particle size distribution (a),Zeta potential (b) and scanning electron microscopy(c) plots of loquat flower polyphenol nanoparticles
2.4.2 枇杷花多酚稳定性试验 测定未经包埋的枇杷花多酚和多酚纳米颗粒在各处理试验前、后DPPH·清除活性的变化,结果见图9。未经包埋的多酚经各处理试验后与对照相比,其DPPH·清除活性均显著低于对照,加热处理相较于避光及光照处理对活性的影响更大,且随处理温度的增高清除活性显著减弱。而多酚纳米颗粒在常温避光、常温光照和避光60 ℃处理后,清除活性与对照无显著差异,经避光80 ℃处理后,清除活性略有降低。因此经包埋处理的枇杷花多酚纳米颗粒较未经包埋处理的枇杷花多酚,经各处理试验后均能更好的保持DPPH·清除活性,稳定性强。

图9 不同处理对未经包埋多酚(a)和多酚纳米颗粒(b)DPPH·清除活性的影响Fig.9 Effects of different treatments on the DPPH·scavenging activity of free polyphenols (a)and polyphenols nanoparticles (b)
3 结论
枇杷花醇提物各萃取物中,AF 多酚含量为(424.49±1.54)mg GAE/g,对DPPH·的清除率为(90.50±0.44)%,两者均显著高于其它萃取物,故选择其作为试验芯材。在单因素实验基础上,通过响应面试验优化枇杷花多酚纳米颗粒的制备工艺为:PBS 的pH=6.6,ι-卡拉胶与BSA 质量比4∶15,BSA 与芯材质量比15∶1,BSA 质量浓度1 mg/mL,热处理温度80 ℃,此时枇杷花多酚包埋率为(82.12±0.48)%。在最佳制备工艺条件下制备多酚纳米颗粒,其平均粒径为(126.0±5.38)nm,PDI 为0.43±0.02,粒径分布适中,Zeta 电位为(-31.1±0.42)mV,扫描件电镜下观察到多酚纳米颗粒大致呈球形。由稳定性试验可知,经包埋处理后的枇杷花多酚能更好的保持DPPH·清除活性,稳定性强。本研究为保持多酚稳定性和植物多酚相关产品的开发及应用提供了参考。

