复合虾青素增强免疫力功能评价
张梦麒,赵道强,柴琇瑛,颜 宏,周理强,吴德松*
(1 云南省药物研究所 昆明 650111 2 云南省中药和民族药新药创制企业重点实验室 昆明 650111)
雨生红球藻(Haematococcus pluvialis)是一种淡水单细胞绿藻,在特定条件下会积累大量的虾青素,含量可达细胞干重的1.5%~4.0%[1],为虾青素的主要天然来源之一。虾青素是一种酮式类胡萝卜素,化学名:3,3'-二羟基-4,4'-二酮基-β,β'-胡萝卜素[2],具有极强的抗氧化活性,比维生素E 高约500 倍,被认为是“超级维生素E”[3],在保健食品和动物饲料添加剂市场应用广阔。现代药理学研究表明,天然虾青素除具有极强的抗氧化活性外,还具有缓解视疲劳[4]、降血糖[5]、降血脂[6]、缓解体力疲劳[7]、增强免疫力[8-12]等多种活性。美藤果(Plukenetia volubilis L.)属大戟科美藤果属多年生木质藤本植物,2013年1月4日我国卫生部正式公告美藤果油被批准为新资源食品。现代药理学研究结果证实:美藤果油具有辅助改善记忆[13]、降血脂[14-16]、抗氧化[17]和增强免疫力[18-19]等功效。火麻仁为桑科植物大麻(Cannabis sativa L.)的干燥成熟果实,卫法监发[2002]51 号文件《卫生部关于进一步规范保健食品原料管理的通知》中规定,火麻仁属于既是食品又是药品的原料。现代药理学研究表明,火麻仁油具有治疗便秘[20-21]、抗氧化[22]、降血脂[23]、改善记忆[24]和增强免疫力[25-26]等功效。
文献调研结果提示,虾青素、美藤果油和火麻仁油在增强免疫力功能上存在一定的交叉和互补,它们的科学组合可能具有提升原有单一成分功效的效果。虾青素油为油状物,较为黏稠,具有对光敏感、遇热不稳定、易氧化等特性,在配方中添加食用油,可对虾青素油进行稀释,便于生产,提高成品得率;还可进一步提高虾青素在产品中的稳定性,防止虾青素在保存过程中过度氧化引发的生物活性下降。
基于上述考虑,本文以虾青素油、美藤果油和火麻仁油为原料制备复合虾青素,并参照《允许保健食品声称的保健功能目录 非营养素补充剂(2020年版)(征求意见稿)》[27]的相关要求,对其增强免疫力功能进行综合评价。
1 材料与方法
1.1 材料与试剂
1.1.1 供试品 复合虾青素,成人推荐每日用量为1 g/d;深红色油状物,主要活性成分为虾青素油、美藤果油和火麻仁油,由云南省药物研究所制剂研究室提供,4 ℃避光保存。
1.1.2 试验动物 SPF 级C57BL/6J 小鼠,体重18~22 g,由辽宁长生生物技术有限公司提供,实验动物生产许可证号:SCXK(辽)2015-0001。实验动物使用许可证:SYXK(滇)K2017-0004,发证单位:昆明市科技局。
1.1.3 细胞株 YAC-1 小鼠淋巴瘤细胞,购自中国科学院昆明动物研究所细胞库。
1.1.4 主要试剂 胎牛血清 (FBS)、RPMI 1640培养液,Gibco 公司;刀豆蛋白 (ConA)、噻唑蓝(MTT),Sigma 公司;2,4-二硝基氟苯 (DNFB),东京化成工业株式会社;印度墨汁、绵羊红细胞(SRBC)、琼脂糖,北京索来宝科技有限公司;乳酸脱氢酶(LDH)检测试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
SQP 型电子天平,赛多利斯科学仪器(北京)有限公司;JJ2000 型电子天平,常熟市双杰测试仪器厂;DMIL-LED 型荧光倒置相差显微镜,莱卡公司;AC2-6S1 型二级生物安全柜、CCL-170A-8 型CO2恒温培养箱,ESCO 公司;Multiskan Go 型全波长酶标仪,Thermo 公司;GNP-9270 隔水式恒温培养箱,上海精宏实验设备有限公司。
1.3 方法
1.3.1 溶媒对照 受试样品的溶媒为食用玉米油。
1.3.2 剂量设定 根据复合虾青素人体推荐剂量,即成人每日推荐剂量为16.7 mg/kg(成人体重以60 kg 计算),分别以成人每日推荐用量的10倍、20 倍和30 倍作为小鼠的饲喂剂量,分别为167,334 和501 mg/kg。
虾青素油的饲喂剂量根据复合虾青素高剂量进行设计,设定为300 mg/kg。
1.3.3 试验方法 参照《允许保健食品声称的保健功能目录 非营养素补充剂 (2020年版)(征求意见稿)》进行功能评价。其中,细胞免疫功能测定采用ConA 诱导的小鼠脾淋巴细胞转化试验(MTT法)和DNFB 诱导的小鼠迟发型变态反应(耳肿胀法);体液免疫功能测定采用抗体生成细胞检测(Jerne's 改良玻片法) 和血清溶血素测定 (血凝法);单核巨噬细胞功能测定采用小鼠碳廓清试验;NK 细胞活性测定采用乳酸脱氢酶(LDH)测定法。
1.3.4 动物分组、给药和指标测定 取SPF 级雄性C57BL/6J 小鼠,按体重分层,随后随机分为溶媒对照组、虾青素组、复合虾青素低、中、高剂量组,每组12 只。自分组后开始,受试组动物均以20 mL/kg 饲喂体积灌胃给予相应样品,溶媒对照组给予等体积玉米油,1 次/d,连续30 d。各项功能测定试验相关指标测定方法参照《允许保健食品声称的保健功能目录 非营养素补充剂 (2020年版)(征求意见稿)》进行,并对结果进行统计学分析。
1.3.5 评价标准 在细胞免疫功能、体液免疫功能、单核-巨噬细胞功能及NK 细胞活性4 个方面测定中,任2 个方面试验结果为阳性,可以判定该受试样品具有增强免疫力作用。其中细胞免疫功能测定项目中2 个试验的结果均为阳性,判定细胞免疫功能试验结果阳性。体液免疫功能测定项目中2 个试验的结果均为阳性,判定体液免疫功能试验结果阳性。单核-巨噬细胞功能测定项目中2 个试验的结果均为阳性,判定单核-巨噬细胞功能试验结果阳性。NK 细胞活性测定试验的一个以上剂量结果阳性,判定NK 细胞活性结果阳性。
2 结果与分析
2.1 对ConA 诱导的小鼠脾淋巴细胞转化的影响
试验结果显示,与溶媒对照组相比,虾青素油、复合虾青素334 mg/kg 和501 mg/kg 剂量组动物脾淋巴细胞细胞增殖水平明显升高(P<0.05 或P<0.01);与虾青素油组相比,复合虾青素334 mg/kg 和501 mg/kg 剂量组动物脾淋巴细胞增殖水平明显升高(P<0.01),结果见表1。
表1 复合虾青素对ConA 诱导的小鼠脾淋巴细胞增殖的影响(±s)Table 1 Effects of compound astaxanthin on splenic lymphocyte proliferation induced by ConA in mice (±s)

表1 复合虾青素对ConA 诱导的小鼠脾淋巴细胞增殖的影响(±s)Table 1 Effects of compound astaxanthin on splenic lymphocyte proliferation induced by ConA in mice (±s)
注:与溶媒对照组相比,*.P<0.05,**.P<0.01;与虾青素油组相比,▲.P<0.05,▲▲.P<0.01。
组别 剂量/mg·kg-1 体质量/g 脾淋巴细胞增殖△OD570nm给药0 d 给药30 d溶媒对照组-19.63±1.34 23.89±1.36 0.32±0.03虾青素油 300 19.54±1.27 23.28±1.20 0.35±0.04*复合虾青素 167 19.88±1.36 23.77±1.59 0.35±0.04 334 19.50±1.11 23.94±1.52 0.42±0.06**▲▲501 19.41±0.65 23.50±1.82 0.43±0.05**▲▲
2.2 对DNFB 诱导的小鼠迟发型耳肿的影响
试验结果显示,与溶媒对照组相比,虾青素油、复合虾青素167,334,501 mg/kg 剂量组动物耳肿胀度均明显增加(P<0.05 或P<0.01);与虾青素油组相比,复合虾青素167,334 mg/kg 和501 mg/kg 剂量组动物耳肿胀度均明显增加(P<0.05),结果见表2。
表2 复合虾青素对DNFB 诱导的小鼠迟发型耳肿的影响(±s)Table 2 Effects of compound astaxanthin on DNFB-induced delayed ear edema in mice (±s)

表2 复合虾青素对DNFB 诱导的小鼠迟发型耳肿的影响(±s)Table 2 Effects of compound astaxanthin on DNFB-induced delayed ear edema in mice (±s)
注:与溶媒对照组相比,*.P<0.05,**.P<0.01;与虾青素油组相比,▲.P<0.05,▲▲.P<0.01。
组别 剂量/mg·kg-1 体质量/g 耳肿胀度/mg给药0 d 给药30 d溶媒对照组-18.80±1.05 23.45±1.18 7.37±2.23虾青素油 300 18.99±0.85 23.04±1.17 9.25±1.83*复合虾青素 167 18.87±0.54 23.16±0.56 10.96±2.00**▲334 19.03±1.28 22.94±1.48 11.28±2.62**▲501 18.41±0.73 22.50±1.63 11.17±2.27**▲
2.3 对小鼠抗体生成的影响
试验结果显示,与溶媒对照组相比,虾青素油和复合虾青素167,334,501 mg/kg 剂量组动物溶血空斑数明显增加(P<0.05),结果见表3。
表3 复合虾青素对小鼠抗体生成的影响(±s)Table 3 Effects of compound astaxanthin on antibody production in mice (±s)

表3 复合虾青素对小鼠抗体生成的影响(±s)Table 3 Effects of compound astaxanthin on antibody production in mice (±s)
注:与溶媒对照组相比,*.P<0.05,**.P<0.01;与虾青素油组相比,▲.P<0.05,▲▲.P<0.01。
组别 剂量/mg·kg-1 体质量/g 溶血空斑数×103/全脾细胞给药0 d 给药30 d溶媒对照组-20.44±0.98 25.48±1.88 170.59±48.09虾青素油 300 20.23±1.23 25.16±1.78 233.25±80.17*复合虾青素 167 20.59±1.54 24.35±1.54 218.33±59.12*334 20.27±1.39 25.20±1.76 230.76±65.34*501 20.68±0.96 25.07±1.99 238.57±70.41*
2.4 对小鼠血清溶血素生成的影响
试验结果显示,与溶媒对照组相比,复合虾青素167 mg/kg 和334 mg/kg 剂量组动物血清抗体水平明显增加(P<0.01),复合虾青素501 mg/kg 剂量组动物血清抗体水平明显增加(P<0.01),结果见表4。
表4 复合虾青素对小鼠血清溶血素生成的影响(±s)Table 4 Effects of compound astaxanthin on serum hemolysin production in mice (±s)

表4 复合虾青素对小鼠血清溶血素生成的影响(±s)Table 4 Effects of compound astaxanthin on serum hemolysin production in mice (±s)
注:与溶媒对照组相比,*.P<0.05,**.P<0.01;与虾青素油组相比,▲.P<0.05,▲▲.P<0.01。
组别 剂量/mg·kg-1 体质量/g 抗体水平给药0 d 给药30 d溶媒对照组-19.23±2.38 24.12±2.36 36.58±9.10虾青素油 300 19.16±2.01 24.48±1.60 53.75±14.27**复合虾青素 167 19.30±1.11 23.99±1.40 64.58±9.86**▲334 19.22±1.22 24.11±1.97 71.33±13.26**▲▲501 18.97±0.98 24.30±1.25 67.17±7.69**▲▲
2.5 对小鼠碳粒廓清能力的影响
试验结果显示,与溶媒对照组相比,虾青素油和复合虾青素各剂量组动物吞噬指数α 均无明显变化(P>0.05),结果见表5。
表5 复合虾青素对小鼠碳粒廓清的影响(±s)Table 5 Effects of compound astaxanthin on carbon clearance in mice (±s)
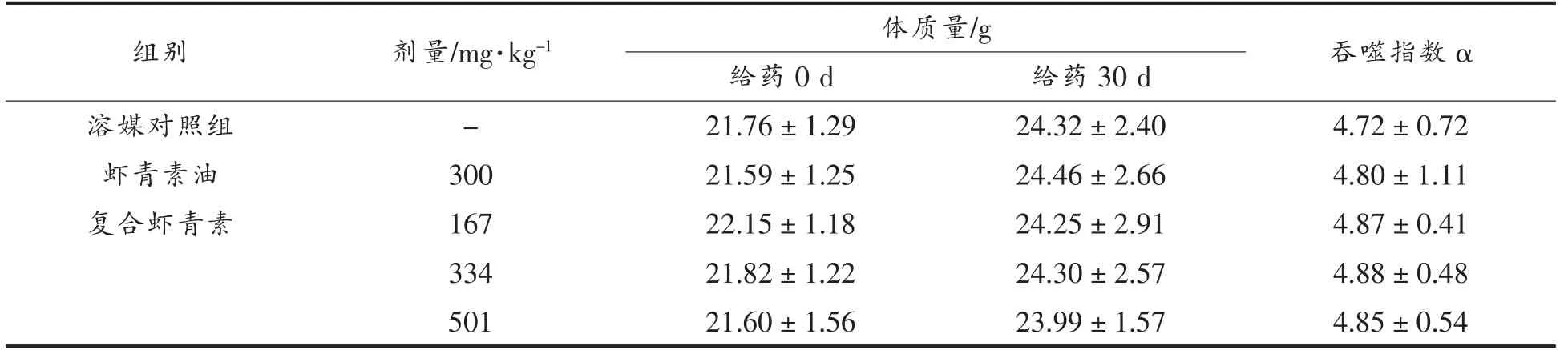
表5 复合虾青素对小鼠碳粒廓清的影响(±s)Table 5 Effects of compound astaxanthin on carbon clearance in mice (±s)
注:与溶媒对照组相比,*.P<0.05,**.P<0.01;与虾青素油组相比,▲.P<0.05,▲▲.P<0.01。
?
2.6 对NK 细胞活性的影响
试验结果显示,与溶媒对照组相比,虾青素油和复合虾青素各剂量组动物LDH 活力均无明显变化(P>0.05),结果见表6。
表6 复合虾青素对小鼠NK 细胞活性的影响(±s)Table 6 Effect of compound astaxanthin on the activity of mouse NK cells (±s)

表6 复合虾青素对小鼠NK 细胞活性的影响(±s)Table 6 Effect of compound astaxanthin on the activity of mouse NK cells (±s)
注:与溶媒对照组相比,*.P<0.05,**.P<0.01;与虾青素油组相比,▲.P<0.05,▲▲.P<0.01。
组别 剂量/mg·kg-1 体质量/g LDH 活力/U·L-1给药0 d 给药30 d溶媒对照组-20.01±1.05 23.49±1.38 287.73±38.20虾青素油 300 20.11±1.15 24.33±2.01 280.35±42.14复合虾青素 167 20.20±1.22 24.06±1.52 270.02±38.06 334 20.30±1.19 23.84±2.10 287.38±33.73 501 20.16±1.23 23.83±1.95 273.46±44.96
3 讨论
免疫是人体的一种正常的生理功能,机体依靠这种功能识别和清除进入人体的抗原物质(如病原微生物、寄生虫等) 或人体自身所产生的衰老、损伤、死亡和突变细胞等,以维持人体内环境的稳态,保持机体的健康。当人体免疫功能减退时,机体的识别和监视能力下降,导致机体无法及时、有效地清除有害因素,从而诱导疾病的发生。近年来,由于环境污染加剧、生活节奏的加快和不健康的生活方式等因素的影响,处于亚健康状态的人群范围逐渐扩大,机体免疫功能低下的人群有逐年增加的趋势,其年龄范围也逐渐从中老年人向年轻人扩散。人体免疫功能低下最直接的表现就是对疾病的抵抗力下降,导致部分疾病反复发作。由于免疫功能低下者经常患病,加重了机体的消耗,所以免疫功能低下者一般还有体质虚弱、精神萎靡、疲乏无力、食欲降低、睡眠障碍等表现,严重影响人们的生活和工作。因此,开发一款具有维持人体正常免疫功能的保健食品具有较好的现实意义和社会价值。
通过前期文献调研,本文在虾青素油的基础上添加了美藤果油和火麻仁油,制备成复合虾青素,并对其增强免疫力功能进行了综合评价,也与单独使用虾青素油的功效进行了对比。研究结果显示:虾青素油和复合虾青素均可明显提升小鼠脾淋巴细胞增殖水平、显著提升小鼠迟发性耳肿胀度,细胞免疫功能测定结果阳性,且复方虾青素的活性优于虾青素油单用。同时,虾青素油和复合虾青素均可明显提升小鼠抗体生成水平,体液免疫功能测定结果阳性,且复方虾青素的活性优于虾青素油单用。然而,在单核巨噬细胞吞噬能力和NK 细胞活性方面,虾青素油和复合虾青素均未表现出明显的活性,未达到前期配伍设计的预期。后续还需要对配方进行调整,以获得更高的活性。
综上所述,参照《增强免疫力功能评价方法(征求意见稿)》的评价标准,可判定虾青素油和复合虾青素均具有增强免疫力的功能,其中复合虾青素的活性优于虾青素油单用,具备进一步深入开发的价值。

