莲房原花青素对AGEs诱导的小鼠肠道组织损伤和微生物紊乱的改善作用
赵扩权,张 芬,罗 庆,冯莹娜,欧阳宇,肖 娟,吴 茜*
(1 湖北工业大学 发酵工程教育部重点实验室 湖北省工业微生物重点实验室细胞调控与分子药物“111”引智基地 武汉 430068 2 海南省食品营养与功能食品重点实验室 海口 570228)
美拉德反应主要发生在蛋白质的氨基和糖的羰基之间,是一种常见的非酶促褐变反应[1],其产物复杂,包括类黑精、还原酮、含N 和S 的杂环化合物等,它们赋予食品棕色色泽,同时也赋予食品各种浓郁芳香的风味。近来研究发现,一些美拉德反应产物还可以清除自由基,具有抗氧化活性[2]。其中,类黑精、还原酮等美拉德反应产物的抗氧化活性甚至与食品工业中常用的抗氧化剂不相上下。在关注美拉德反应及其产物的有利的一面时,也不应忽视美拉德反应对食品不利的一面,例如,影响食品的营养性,不利于必需氨基酸或矿物元素的吸收利用,以及伴生一些有害物质。晚期糖化终 末 产 物 (Advanced glycation end products,AGEs)作为美拉德反应的主要产物之一,是糖类和蛋白质、氨基酸在非酶促反应的情况下生成的产物,在美拉德反应在终期阶段产生[3]。而热加工方式、加工温度和加热时间对食物中AGEs 的生成有极大的影响。例如,加热温度越高,加工时间越长,食物中AGEs 的含量越高[4]。人体内的AGEs主要来源于膳食AGEs 的摄入,摄入量远远大于人体内自发形成[5]。高AGEs 食物摄入导致人体组织内AGEs 含量增加,造成人体肾脏等器官的损伤[6],升高人体氧化应激和炎症水平[7]。大量研究表明,人体内过多积累的AGEs 与一些人体慢性疾病的发病机理密切相关,如动脉粥样硬化、肾病、炎症反应等[8]。
原花青素(Proanthocyanidins,PC)是一大类酚类聚合物的总称,在日常食物中广泛存在,尤其是植物性食品中含量丰富,具有抗氧化、抗炎等生物学效益。其中,原花青素低聚体以游离态的形式存在,凭借良好的水溶性,易被人体吸收等特点在国内外被广泛关注。目前,对原花青素的开发已扩展到多个植物品种,包括苹果、荔枝、葡萄等水果,茄子、紫薯、紫甘蓝等蔬菜,种子、果皮、坚果、茶叶、红酒等食品,PC 在人类的膳食中占有重要地位[9]。莲是一种天然植物资源,在我国分布非常广泛,在食用和药用方面具有很高的研究价值。莲的成熟花托(莲房)中含有丰富的莲房原花青素低聚体 (Lotus seedpod oligomeric procyanidins,LSOPC),其具有抗氧化、免疫调节、降血脂、抗心肌缺血、抗肿瘤、抗辐射等多种生理功能[10-14]。目前LSOPC 的相关研究主要集中在食品加工过程中对AGEs 的抑制[15-17],而对机体内AGEs 诱导的组织损伤及肠道菌群紊乱的调节作用鲜见报道。
本文选用健康的雄性小鼠作为动物模型,对小鼠体质量、进食及进水情况、脏器指数、肠道的HE 病理染色情况、结肠紧密连接蛋白和寡肽转运蛋白的表达情况、结肠肠道内炎症因子及肠道菌群进行分析,探究LSOPC 对AGEs 诱导的小鼠组织损伤和肠道微生物紊乱的改善作用,为开发以LSOPC 为功能因子添加剂的食品,降低AGEs 引起慢性疾病的风险提供参考。
1 材料与方法
1.1 材料试剂
采摘洪湖蓝田种植区“武植2 号”莲房,去籽后按照本实验室前期已经确定的原花青素提取工艺(中华人民共和国专利CN 1169804C)进行提取[18],得到莲房原花青素粗提物粉末,再经乙酸乙酯3 次萃取,冷冻干燥后得到莲房原花青素低聚体(LSOPC)。用盐酸正丁醇法检测,LSOPC 中的原花青素含量相当于葡萄籽原花青素含量的(106.22±0.46)%;用液相-质谱联用分析LSOPC,发现聚合度为3.2,在末端单元中有74.2%的儿茶素和25.8%的表儿茶素;而扩展单位的儿茶素、表儿茶素和表没食子儿茶素分别占26.0%,43.1%和30.9%。
吐温-20,国药集团化学试剂有限公司;甲醇,美国Sigma 公司;DNA 试剂盒,赛默飞世尔科技有限公司;膜蛋白提取试剂盒,南京凯基生物技术有限公司;BCA 蛋白浓度测定试剂盒,上海索宝技术有限公司。
1.2 仪器与设备
RE-3000 旋转蒸发仪,上海亚荣生化仪器有限公司;高速冷冻离心机,德国CHRIST 公司;KQ-50B 型超声波清洗器,昆山市超声仪器有限公司;UV-1601 紫外-可见分光光度计,北京瑞丽分析仪器有限公司;全自动酶标分析仪,Thermo Fisher Co;Alliance e2695 高效液相色谱仪,美国Waters 公司;Q-trap 液相质谱联用仪,美国Agilent公司。
1.3 方法
1.3.1 动物模型的建立 ICR 4 周龄雄性小鼠【SPF 级,从三峡大学实验动物中心获得,许可证号:SCXK (鄂)2017-0012】,共36 只,体质量为16~20 g,实验动物分笼喂养,每笼饲养4~5 只。
控制的饲养环境条件为:温度为21~23 ℃,湿度55%~70%,12 h 白昼循环。
适应2 周,分为4 个实验组,每组随机选择9只。具体分组为:1)对照组(N):以标准的AIN-93G 饲料喂食,该饲料由美国营养学会推荐,广泛应用于啮齿类实验动物;2)H-AGEs 组(H):将配制好的AIN-93 饲料粉末,在150 ℃高温条件下烘焙2 h,压制成型,40 ℃烘干(维生素和矿物质在烘烤结束后,粉末降至室温再添加) 制成高AGEs AIN-93G 饲料喂养老鼠;3)H-AGEs+0.2%LSOPC 组(H2):向高AGEs AIN-93G 饲料添加质量分数0.2%的LSOPC 制成饲料喂养老鼠;4)HAGEs+0.5% LSOPC 组 (H5):向高AGEs AIN-93G 饲料添加质量分数0.5%的LSOPC 制成饲料喂养老鼠。
测定4 组饲料中的碳水化合物、脂肪、蛋白质、能量及总AGEs 的含量。4 组实验小鼠正常进食和进水,进食和进水量2 d 测定1 次,体质量1周测定1 次,4 d 更换1 次垫料,饲养12 周。最后1 周,将每只老鼠单独安置在代谢笼中,收集小鼠24 h 粪便,便于后期肠道微生物试验和粪便组学分析。收集的粪便立即放入无菌冷冻管内,液氮骤冷,-80 ℃冰箱保存备用。给小鼠腹腔注射水合氯醛(10%,300 mg/kg)麻醉,腹主动脉取血(麻醉前空腹12 h),摘除脾、肾脏、肝脏、肺、心、十二指肠、空肠、回肠、结肠,生理盐水清洗后,再用滤纸吸干,称重,用4%的多聚甲醛溶液浸泡十二指肠、空肠、回肠、结肠等部分组织,用于组织病理分析,其余组织置于-80 ℃保存。根据湖北工业大学动物保护和使用委员会的规定,所有的动物实验程序都遵循了实验室动物的护理和使用指南。
1.3.2 饲料AGEs 含量测定 于100 mL 离心管中加入1 g 粉末状饲料,再加入1.2 mg/mL 的链霉蛋白酶E(Pronase E)溶液3 mL 溶于含5 mg/mL SDS 和1.47 mg/mL CaCl2的Tris-HCl 中,pH 7.5)。漩涡振荡,置于摇床中40 ℃振荡消化36 h。消化后冷却,于4 500×g,4 ℃条件下离心10 min。取上清,0.45 μm 滤膜过滤,用PBS 稀释到适当浓度后,再用荧光分光光度计测定荧光值,激发波长(λex)为347 nm,发射波长(λem)为415 nm。荧光强度以AU/g 表示。
1.3.3 脏器指数的测定 准确测定各组小鼠的脏器质量,小鼠的脏器指数计算公式如下:
脏器指数 (g/kg)=(脏器质量/小鼠体质量)×1000
式中,脏器中肾脏的质量为双肾的总质量。
1.3.4 肠道组织病理的观察 用4%的多聚甲醛溶液将小鼠的十二指肠、空肠、回肠、结肠等组织固定24 h 以上,然后用梯度为75%~95%乙醇组织脱水,二甲苯清洗使组织透明。再进行石蜡包埋,切片和烤片,二甲苯脱蜡和95%~70%乙醇脱水。用苏木素对组织进行5~7 min 染色,1%盐酸酒精分化2~5 s,自来水浸洗返蓝后,再用1%伊红对组织进行2 min 染色,染色完成后用自来水浸洗、酒精脱水和二甲苯透明后进行镜检。
1.3.5 小鼠结肠组织免疫组化的测定 采用链霉菌抗生物素蛋白2 过氧氢化酶(Strep tavidin peroxidase,SP)免疫组化技术,测定结肠中紧密连接蛋白(ZO-1、Occludin)和寡肽转运蛋白(Pept-1)在肠道黏膜上皮细胞的表达。
将结肠石蜡切片置于(65±3)℃的烤箱烘烤10 min,让组织与切片紧密黏附;石蜡切片二甲苯脱蜡,梯度乙醇脱苯,水化;去离子水清洗,中性PBS缓冲液平衡;切片倾泡在pH=6,浓度为0.01 mol/L的枸橼酸盐缓冲液,加热使抗原修复,自然冷却,PBS 缓冲液清洗3 次;3%过氧化氢溶液孵育15 min,以消除内源性过氧化物酶的活性,PBS 缓冲液清洗3 次,每次3 min;山羊血清工作液孵育15 min,倾去,滴加ZO-1 溶液(1∶50,体积比)或者Occludin 溶液(1∶150,体积比),4 ℃条件下过夜;恢复至室温后PBS 缓冲液清洗3 次,每次3 min;滴加生物素化二抗工作液(IgG),在37 ℃条件下静置15 min,用二胺基联苯胺(DAB)显色,显微镜下控制显色反应程度,苏木精复染40 s,再用水冲洗5 min,梯度乙醇脱水,二甲苯透明,封片,镜检拍照,阴性对照为以磷酸盐缓冲液(PBS)代替一抗。ZO-1,Occludin,Pept-1 蛋白均为细胞质内表达,阳性细胞为细胞质内出现的棕黄色颗粒。
1.3.6 小鼠结肠组织内炎症因子和黏附分子表达的测定[19]采用RT-PCR 分析小鼠结肠组织内炎症因子和黏附分子表达情况。
1.3.6.1 RNA 提取 向结肠组织中加入1 mL Trizol,充分匀浆。再滴加200 μL 氯仿,摇匀后室温静置5 min。在4 ℃条件下离心15 min,转速为12 000 r/min,转上层水相(约400 μL)于新1.5 mL EP 管中,再滴加400 μL 异丙醇,摇匀后静置10 min。再次离心后弃上清,沉淀用预冷的70%无水乙醇洗3 次,空气干燥5~10 min,复溶于20 μL DEPC 水中。分光光度计测定RNA 浓度。
1.3.6.2 逆转录生成cDNA 反应体系包括RNA 3.689 μg、10 μmol/L Oligo (dT)2 μL、2.5 mmol/L dNTP 2 μL、Rnase free ddH2O 约14.5 μL。反应条件:70 ℃5 min,短暂离心后置于冰上。再取上述反应液14.5 μL、5×RT 缓冲液 4 μL、HRP(RRI)/RNase 抑制剂 0.5 μL、M-MLV 1 μL、Rnase free ddH2O 20 μL。反应条件:42 ℃60 min,95 ℃5 min。
1.3.6.3 RT-PCR 引物设计 RT-PCR 引物见表1,反应体系包括10 μmol/L β-actin F 0.5 μL、10 μmol/L β-actin R 0.5 μL、2.5 mmol/L dNTP 2 μL、Ex Taq 0.25 μL、10×Ex Taq E 缓冲液2.5 μL、cDNA 1 μL、ddH2O 约25 μL。反应条件:94 ℃4 min;94 ℃30 s,56 ℃30 s,72 ℃25 s(30 个循环);72 ℃4 min;4 ℃4 min。

表1 实时定量PCR 的引物设计Table 1 Primer sequences design for real-time PCR
1.3.7 小鼠肠道菌群的分析
1.3.7.1 粪便菌群基因组总DNA 的提取与检测粪便样本需置于-80 ℃冰箱内保存,提取DNA 前应避免反复冻融。总DNA 采用试剂盒提取,用酶标仪测定其浓度及纯度,结果表明粪便样本DNA可用于后续试验。为了检测DNA 完整性,在电压150 V 的条件下用1%琼脂糖凝胶电泳40 min。发现可见基因组DNA 主条带,符合后续PCR 试验要求。
1.3.7.2 16S rRNA V4 高变区PCR 扩增及Hiseq测序 以样本提取的总DNA 为模板,采用细菌16S rRNA V4 区通用引物 515F (GTGCCAGCMGCCGCGGTAA) 和 806R (GGACTACHVGGGTWTCTAAT) 扩增其中的16S rRNA V4 区基因。本试验PCR 反应体系为50 μL:30 ng模板DNA,4 μL 引物,25 μL PCR 预混合溶液,加ddH2O 至50 μL。PCR 扩增条件:98 ℃条件下预变性3 min,然后98 ℃变性45 s,55 ℃退火45 s,72℃延伸45 s,共30 个循环,72 ℃最终延伸7 min。所得PCR 产物使用Agencourt AMPure XP 磁珠进行纯化,用Agilent 2100 生物分析仪和实时定量PCR 对纯化后的PCR 产物进行定量和质量分析。用纯化后的PCR 产物构建文库,应用Illumina Hiseq 2500 测序平台对扩增的16S rRNA V4高变区进行双末端(Paired-end)测序,再进行生物信息学分析。
1.3.7.3 生物信息学分析 处理原始的下机数据时,先进行数据过滤,再利用每个样品引物的barcode 序列识别各自的序列,进行序列拆分。使用软件FLASH (Fast length adjustment of shortreads,v1.2.11)拼接经过处理和过滤的序列,利用重叠关系将每个样品双末端测序得到的成对序列(Pair end reads)组装成一条序列,得到最终的16S rDNA V4 高变区序列。将处理拼接后的序列通过软件USEARCH 聚类为分类操作单元(Operational taxonomy units,OUT)。得到OTU 代表序列后,通过RDP classifer(v2.2)软件将OTU 代表序列比对Greengene 数据库进行物种注释,将置信度阈值设置为0.6。过滤注释结果,确保后期分析用到的OTU 都有注释结果,再用选出的OTU 进行操作单元聚类分析、菌群多样性分析、稀释性曲线分析和菌群分类学分析。
2 结果与分析
2.1 饲料成分分析
4 组实验组饲料的营养成分及总AGEs 的含量如下表2所示。4 组饲料在碳水化合物含量、脂肪、蛋白质以及热量方面均没有显著差异,排除因为饲料营养成分不同对实验结果造成的影响。AIN-93G 饲料经过高温加热以后,AGEs 的含量显著提高(P<0.05),H-AGEs 组中总AGEs 的含量约为对照组的3.7 倍。研究表明,影响食物中AGEs 增加的因素有很多,如加热温度、加工时间、加工方式、pH 值及食物组成成分等。其中,加热时间和加工方式尤为重要,它能增加食物中AGEs的含量,促进食物中的糖氧化和脂质氧化[20]。

表2 饲料成分分析Table 2 Feed composition analysis
2.2 LSOPC 对不同组别小鼠进食、进水量和体质量的影响
小鼠实验周期中进食、进水量及体质量变化是反应生物学特征指标[21]。健康小鼠分别喂食4组饲料12 周后,分析不同组别小鼠的进食、进水量及体质量变化。如表3所示,喂食期间,进食和进水量呈动态波动趋势。第2 周到第10 周,HAGEs 实验组小鼠每日进食和进水量整体上低于其它组别,且差异显著(P<0.05)。加入LSOPC 后进食量有所改善,0.5% LSOPC 添加量组的改善效果好于0.2% LSOPC 添加量组,和正常组相当。高AGEs AIN-93G 饲料的口感可能不如标准的AIN-93G 饲料口感,进而影响了进食,其进食量低于其它3 组,而LSOPC 的添加,改善了高AGEs AIN-93G 饲料的风味,使得小鼠的进食量提高。然而,第10 周到第12 周,与对照组相比,另外3 个实验组进食量并无显著性差异(P>0.05)。

图1 4 种饲料形态Fig.1 The pictures of four feeds

表3 进食量和进水量Table 3 Food intake and water intake
图2所示,小鼠的体质量随实验时间的增加而增加,对照组小鼠的体质量在实验过程中均大于其它组别。从第5 周开始,组间差异显著(P<0.05),从第9 周开始,与前8 周相比,对照组小鼠的体质量增长极其明显(P<0.01),远远大于同期其它实验组,与进食量和进水量的量呈正相关关系。而H-AGEs、H-AGEs+0.2% LSOPC、H-AGEs+0.5% LSOPC 3 个实验组小鼠的体质量差异不显著,由于LSOPC 的添加使得小鼠的进食和进水量都高于H-AGEs 组,然而体重并无显著差异,表明LSOPC 对于小鼠体质量控制有一定程度的影响,这与王勇[22]在原花青素对肥胖小鼠脂解作用和机制中的研究结果一致。
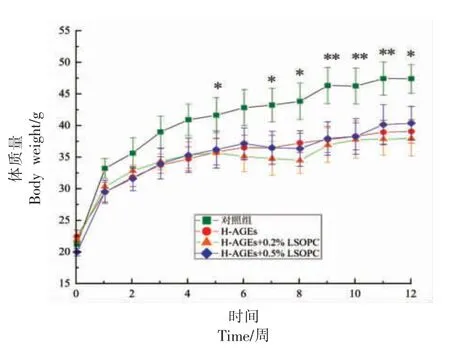
图2 饲养过程中4 组小鼠的体质量变化情况Fig.2 Weight changes of mice in four groups during feeding
2.3 LSOPC 对不同组别小鼠脏器指数的影响
动物的脏器指数是评价其在实验阶段的生物学特征指标之一[23]。正常小鼠体质量与脏器的比值,即脏器指数值较为恒定,而脏器指数的波动往往反应动物机体的变化。各实验组小鼠的脏器指数如表4所示:与对照组相比,除肺脏外,HAGEs、H-AGEs+0.2% LSOPC、H-AGEs+0.5%LSOPC 3 个实验组小鼠的心脏、肝脏、脾脏和肾脏的脏器指数均大于正常组。H-AGEs 组小鼠各器官脏器指数最大,其中脾脏的脏器指数约为其它组别的2 倍,且差异显著(P<0.05)。随着LSOPC的 添加,与H-AGEs 组相比,H-AGEs+0.2%LSOPC 和H-AGEs+0.5% LSOPC 实验组器官的脏器指数均降低,且脏器指数与LSOPC 的添加量呈负相关(P<0.05),表明H-AGEs 饲料的摄入导致小鼠脏器指数增大,而脏器指数的增加也反映出小鼠在实验过程中可能出现脏器充血、水肿或者肥大增生等健康问题[24]。实验结果提示LSOPC作为一种外源抗氧化剂的摄入能改善小鼠生长过程中器官的损伤。
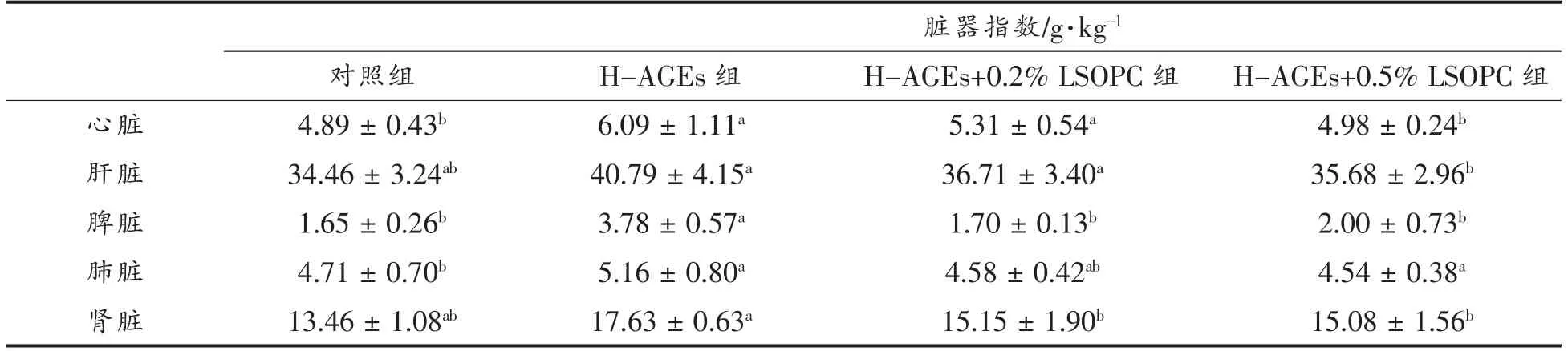
表4 小鼠脏器指数Table 4 Organ indexs of mice
2.4 小鼠肠道组织切片HE 染色分析
饲养12 周,通过检测不同实验组小鼠肠道组织的病变情况,发现摄入H-AGEs 饲料小鼠胃肠组织均出现不同程度的脂肪滴积累和病变,部分组织内部产生炎性细胞浸润。而在H-AGEs 饲料中添加不同质量分数LOSPC,能很大程度上降低小鼠的肠道组织表面的脂肪滴富集,减少炎性细胞浸润,对小鼠胃肠组织病变有很好的改善作用。
2.5 小鼠结肠内免疫组化分析
AGEs 分为游离态和结合态(肽结合态和蛋白结合态)两种类型。其中,游离态AGEs 的吸收与肠细胞紧密连接蛋白ZO-1 和Occludin 的表达密切相关,ZO-1 和Occludin 的表达越高则游离态AGEs 的吸收越低。寡肽转运蛋白Pept-1 的表达量越高则结合态AGEs 的吸收量越高[25]。如图4所示,与对照组相比,H-AGEs 组ZO-1 蛋白表达量显著降低(P<0.05),向H-AGEs 组中添加不同质量分数LSOPC,H-AGEs+0.2% LSOPC 和HAGEs+0.5% LSOPC 组ZO-1 的表达量均有提高,且表达量与添加LSOPC 质量分数呈正相关;Occludin 在对照组的表达量最大,与H-AGEs 和HAGEs+0.2% LSOPC 组相比,差异显著(P<0.05),而饲料中添加不同质量分数LSOPC 喂养的小鼠,结肠组织内Occludin 表达量均有显著增加 (P<0.05);Pept1 蛋白表达量在H-AGEs 组最大,在对照组小鼠结肠的表达量较少,LSOPC 的添加量与Pept-1 的表达量呈负相关(P<0.05)。

图3 小鼠肠道组织HE 染色结果Fig.3 HE staining results of mice gastrointestinal tissues

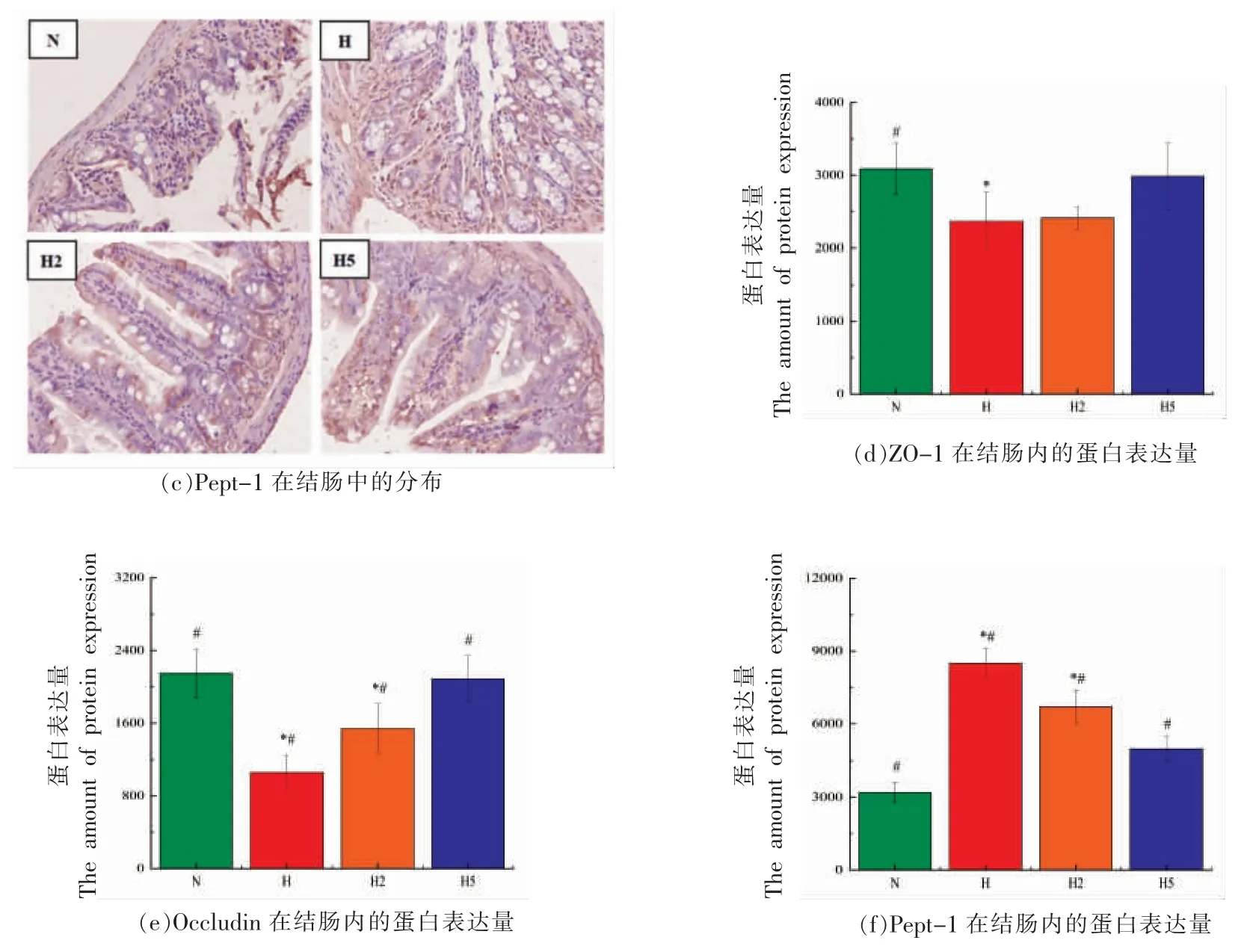
图4 小鼠结肠组织免疫组化结果Fig.4 Immunohistochemical results of mice colon tissue
2.6 小鼠结肠组织内炎症反应分析
膳食AGEs 的摄入,使得机体内氧化应激和脂质过氧化水平增加,加剧了自由基链反应,导致体内促炎因子的释放[26]。研究表明,肠道内AGEs的累计会导致炎症性肠病患者的炎症反应[27]。如图5所示,与对照组相比,3 组摄入H-AGEs 的实验组小鼠结肠内炎症细胞因子表达量均显著增加(P<0.05),其中H-AGEs 组小鼠结肠内TNF-α 表达量约为对照组的4.5 倍,IL-6 的表达量约为对照组的5.5 倍。不同质量分数LSOPC 的添加,均能改善小鼠结肠内炎症水平,且改善效果与LSOPC添加量呈正相关,与H-AGEs 组小鼠相比,0.2%LSOPC 的添加使小鼠结肠内TNF-α 和IL-6 的表达量分别下降了36.17%和40.86%(P>0.05),而0.5% LSOPC 的添加使结肠内TNF-α 和IL-6 的表达量分别下降了59.87%和54.86%(P>0.05)。膳食中AGEs 的摄入,上调了结肠内炎症细胞因子水平,减弱了肠道内抗氧化的防御,刺激了小鼠结肠内的炎症反应。血管细胞黏附因子(VCAM-1)和细胞间黏附因子(ICAM-1)在促进炎症部位的黏附性和调节机体免疫反应中起重要作用,影响小鼠结肠内炎症反应。H-AGEs 组小鼠体内的VCAM-1 和ICAM-1 的表达量均大于对照组组(P<0.05),而LSOPC 的添加,能下调小鼠结肠内VCAM-1 和ICAM-1 的表达量,且与LSOPC 的质量分数呈负相关(P<0.05)。
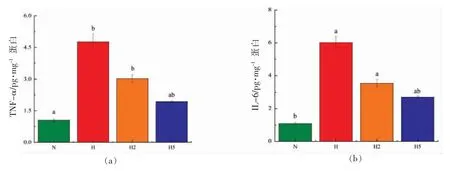

图5 小鼠结肠炎症因子表达情况Fig.5 Expression of inflammatory factors in mice colon
2.7 小鼠肠道微生物的Alpha 多样性分析
Alpha 多样性采用稀释曲线(Rarefaction curve)和香农指数曲线(Shannon Index)来分析,Shannon 和Simpson 指数反映了物种的丰富度,Chao1 和ACE 指数反应了物种数量的多少[28]。随着随机抽取的序列条数的增加,持续抽样下新物种出现的速率急剧上升,表明群落中有大量的新物种被发现。如图6所示,4 个实验组的稀释性曲线和香农指数曲线基本持平,说明4 个分组的样品中大部分的肠道菌群微生物已被发现。对照组OTU 数量明显大于其它3 个组,说明当测定序列条数充分的情况下,随着测序数量的增加,对照组中样品物种的丰富和均匀度最大。两者结合得出,抽样条件充分,可用于数据分析。与H-AGEs 组相比,对照组和添加LSOPC 组Shannon 指数、Simpson 指数、Chao1 指数和ACE 指数都较高(P<0.05),说明这3 组小鼠肠道微生物的种类和数量都更多。这表明LSOPC 的添加,能增加肠道微生物种类的均匀性和多样性。

图6 小鼠肠道微生物Alpha 多样性分析Fig.6 Analysis of Alpha diversity of intestinal microorganisms in mice

2.8 小鼠肠道微生物的Beta 多样性分析
在UniFrac 距离未加权与加权的基础上,图7中PCoA 图(a~f)直观的显示了4 个分组中的微生物群的结构差异[29]。4 个组别中的差别明显分离,且4 个实验组别中,33.15%和48.63%的变化由PC1 解释,17.80%和21.94%的变化由PC2 解释,10.58%和15.22%的变化由PC3 解释。基于UPGMA 构建的聚类树(g)显示了AGEs 依赖性的结构重排,H-AGEs+0.5% LSOPC,H-AGEs+0.2%LSOPC,H-AGEs 和对照组4 个分组中的小鼠完全聚集在各自的组中,相同分组内不同平行组间物种组成相似度较高。UPGMA 构建的聚类树显示,3 组小鼠粪便内的生物菌群明显区别于HAGEs。H-AGEs+0.5% LSOPC 组内物种相似匹配度与对照组较高,说明高质量分数LSOPC 的添加,对小鼠粪便内生物菌群的物种改善效果明显。


图7 小鼠肠道微生物的Beta 多样性分析Fig.7 Analysis of Beta diversity of intestinal microorganisms in mice
2.9 小鼠肠道微生物物种注释及分类学分析
正常人群的肠道微生物主要有厚壁菌门,拟杆菌门,变形菌门,梭杆菌门和放线菌门。如图8所示,对照组的肠道微生物主要是拟杆菌门和厚壁菌门,且厚壁菌门与拟杆菌门的比值约为1.00,其次为变形菌门,放线菌门及梭杆菌门所占比例较少。4 个实验组中,H-AGEs 组厚壁菌门所占比例最大,厚壁菌门与拟杆菌门的比值约为1.50。随着不同质量分数LSOPC 的添加,厚壁菌门相对丰度下降,拟杆菌门相对丰度增加,H-AGEs+0.2%LSOPC 组厚壁菌门与拟杆菌门的比值约为1.41,H-AGEs+0.5% LSOPC 组厚壁菌门与拟杆菌门的比值则下降到1.14。相关文献报道,厚壁菌门在肠道微生物中主要产丁酸[30],LSOPC 可降低肠道微生物产生的丁酸含量,这一结果可能与该组厚壁门菌占比减少有关。同时,这一结果也间接表明,肠道微生物可能是LSOPC 的靶点之一。

图8 小鼠肠道微生物生物物种注释及分类学分析Fig.8 Annotation and taxonomic analysis of intestinal microflora of mice
3 结论
本研究以健康小鼠为模型,比较不同质量分数LSOPC 对摄入膳食AGEs 后的小鼠体质量、肠道组织以及肠道菌群的影响。结果显示,H-AGEs饲料的摄入导致小鼠脏器指数增大,LSOPC 作为一种外源抗氧化剂的摄入能改善小鼠生长过程中器官的损伤;摄入H-AGEs 饲料小鼠肠道组织均出现不同程度的脂肪滴积累和病变,部分组织内部产生炎性细胞浸润。添加不同质量分数LSOPC,能很大程度上降低小鼠的胃肠组织表面的脂肪滴富集,减少炎性细胞浸润,对小鼠肠道组织病变有很好的改善作用;膳食AGEs 的摄入,增加了小鼠结肠内炎症细胞因子水平,减弱了肠道内抗氧化的防御,刺激了小鼠结肠内的炎症反应,LSOPC 的添加,能改善小鼠结肠炎症疾病,且与LSOPC 的质量分数呈正相关(P<0.05);膳食AGEs 的摄入能够导致肠道菌群的紊乱,LSOPC 的添加,能提高小鼠肠道微生物多样性,厚壁门菌占比减少,改善小鼠肠道菌群的紊乱现象,且与LSOPC 的质量分数呈正相关(P<0.05)。研究结果为开发以LSOPC 为基础的膳食营养补充剂改善AGEs 引起的慢性疾病提供支撑。

