紫薇与大花紫薇种间杂种子代倍性分析
李振芳,彭 婵,黄国伟,马林江,柯尊发,杨彦伶
(1.湖北省林业科学研究院,武汉 430075;2.湖北省太子山林场管理局,湖北 京山 431822)
紫薇(Lagerstroemia indica)培育新品种主要是通过杂交育种[1],种间杂交作为一种获取优良性状、提高抗性和拓宽遗传多样性的重要手段,国内外早已开展此项工作,将屋久岛紫薇(L.fauriei)、福建紫薇(L.limii)和南紫薇(L.subcostata)等种质资源引入紫薇杂交群体,且表现出良好的种间亲和性[2-4],而紫薇与尾叶紫薇(L. caudata)的种间亲和性则较低[5],表明紫薇不同种间杂交子代育性差异较大。大花紫薇(L.speciosa)作为紫薇属1 个花大、叶大、植株高大的特殊种质[1],Pounders 等[6]利用紫薇品种Tonto 与大花紫薇进行杂交获得的子代植株高度不育,胡杏等[7]发现紫薇与大花紫薇杂交子代中除1株植株外其余均高度不育,焦垚[8]发现大花紫薇与紫薇品种Sacramento、Dynamite 正反交的子代均高度不育,Purple Velet×大花紫薇的杂种子代中除3 个植株可结实外其余均高度不育,而这4 株可育子代性状均偏向紫薇品种性状[7,8],紫薇与大花紫薇杂种子代高度不育,阻碍了抗寒性等优良基因的继续渗入。
细胞遗传分化可能会干扰紫薇某些杂交组合育性的差异[1],紫薇染色体数目最近的报道均为2n=48[9-16],大花紫薇染色体数目最近的报道以2n=48 居多[1,6,17-19],但也有2n=50[20-23];采用流式细胞仪测定紫薇为二倍体[9,10,24-26],刘亚琼[27]测定大花紫薇为六倍体,而刘婷婷等[28]测定其为二倍体,因此,有必要确定紫薇与大花紫薇杂种子代的倍性。
目前倍性鉴定方法中,染色体计数准确性高但操作繁琐、技术要求也高,紫薇作为染色体小且数量众多的物种,难以取得满意的结果[24,25];流式细胞仪测定广泛适用于物种倍性鉴定,快速、准确,适合大量样本筛查,但采用外标法不能准确判定非整倍体[29,30];利用SSR 分子标记可快速准确分析大量样本,但成本相对较高[31,32]。本研究利用湖北省林业科学研究院紫薇育种课题组前期获得的一批紫薇与大花紫薇的种间杂种子代,采用流式细胞仪和SSR标记对其倍性进行评估,以期为推进紫薇与大花紫薇种间杂交育种工作提供参考和借鉴。
1 材料与方法
1.1 材料
2013—2015 年以大花紫薇为父本,紫薇品种Dynamite、鄂薇3 号(L.indica‘Ewei 3’)、D3-5、D3-7 4 个紫薇品种或无性系为母本进行杂交,获得4 个杂交组合的F1代实生苗植株。试验材料包括F1代实生苗植株、大花紫薇、紫薇品种Dynamite、尾叶紫薇、福建紫薇、屋久岛紫薇。各材料为扦插繁殖植株,分别保存于武汉九峰森林培育试验示范国家长期科研基地和湖北省太子山林管局仙女林场。
1.2 流式细胞仪检测
1.2.1 样品准备及上机分析 采用德国Partec 公司生产的流式细胞仪CyFlow Cube 进行紫薇样品倍性分析。选取扦插后刚萌发的新鲜嫩叶(约0.5 cm2),置于塑料培养皿内,加入400~500 μL 检测试剂盒的细胞核提取缓冲液,用刀片将其快速切碎,放置10~30 s 后加入1.5~1.6 mL 检测试剂盒的DNA 染色液缓冲液,最后用30 μm 的微孔滤膜将样品过滤到2.5 mL 的试管中,上样检测[33,34]。
检测试剂盒A 为抗氧化提取试剂盒CyStain UV OxProtect(Staining Buffer);检测试剂盒B 为Cystain UV Precise P(Nuclei Extraction Buffer、Staining Buffer),均购于Partec 公司。
1.2.2 倍性分析 流式细胞分析图中,横坐标为荧光强度,纵坐标为细胞数量,荧光强度反映了细胞内DNA 含量的多少[35]。测定样本倍性的公式如下[36]。

评判分析效果一般用变异系数(CV)值,富含酚类等物质的样本,当CV<5%时,所测数据是理想的;当CV<10%时,所测数据是比较理想的[37]。
1.3 分子标记鉴定
3—4 月取待测紫薇植株的幼嫩叶片2~4 片,二氧化硅干燥后,保存于-80 ℃冰箱。叶片总DNA 提取采用生工生物工程(上海)股份有限公司试剂盒B518261。DNA 纯 度 和 浓度 采 用NanoDrop 2000 紫外分光光度计检测,稀释至20 ng/μL,4 ℃冰箱保存备用。从彭婵等[38]筛选出的15 条扩增条带单一、目的带型清晰的标记中,选择PIC指数大于0.5 的8 条SSR 引物进行鉴定[32](表1),引物序列由生工生物工程(上海)股份有限公司合成,PCR 扩增反应体系具体参照彭婵等[38]的方法进行,扩增产物用美国ABI 3730XL 测序仪检测。判读每个SSR 标记在每个样品中扩增位点的等位基因数,若等位基因数为1~2,则待测样品为二倍体,等位基因数为1~4,则待测样品为四倍体,等位基因数为1~6,则待测样品为六倍体[32,39-42]。
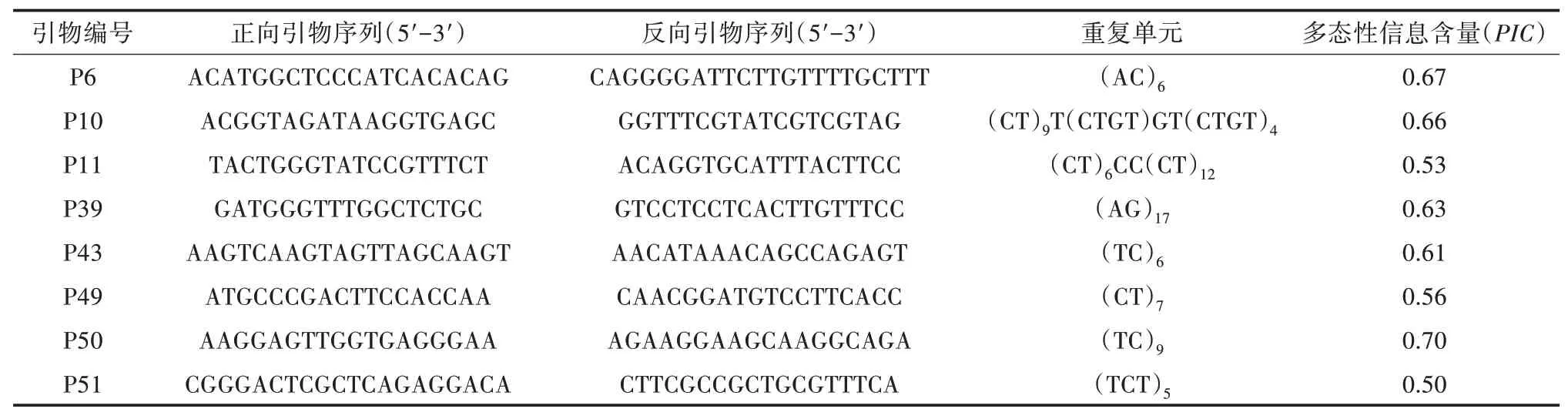
表1 SSR 引物信息
2 结果与分析
2.1 不同提取试剂盒对流式细胞仪检测紫薇出锋效果的影响
紫薇叶片含有大量的蛋白质、糖和酚类化合物,不利于细胞核的提取,倍性检测时容易出现峰形较差、较小的情况[24,43]。以大花紫薇、屋久岛紫薇为材料,比较Cystain UV Precise P 和CyStain UV OxProtect 2 种不同提取试剂盒对流式细胞仪出锋效果的影响,结果见图1。由图1 可以看出,抗氧化试剂盒(CyStain UV OxProtect 试剂盒)的结果图中背景碎片少,主峰明显集中,且屋久岛紫薇的结果中可以看到明显的G2 峰,G1 峰细胞核数量明显增多;另外,大花紫薇的提取效果较差,抗氧化试剂盒的结果中背景碎片也很多。
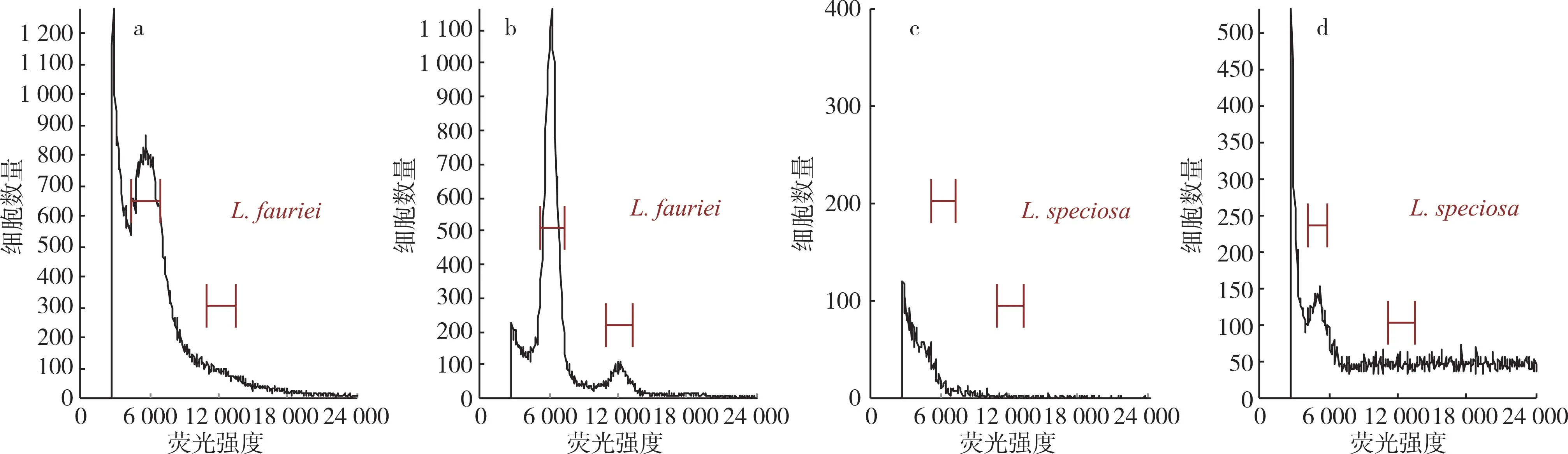
图1 流式细胞仪不同提取试剂盒提取紫薇的出峰结果比较
2.2 紫薇属植物流式细胞仪倍性分析
以已知染色体倍性的尾叶紫薇[44](二倍体,2n=48)为对照,采用检测试剂盒A 对屋久岛紫薇、福建紫薇、大花紫薇进行倍性检测,结果(图2、表2)表明,屋久岛紫薇、福建紫薇、大花紫薇3 个品种的倍性与尾叶紫薇相同,均为二倍体,变异系数为8.08%~9.45%,流式细胞仪分析结果见图2。
图2 紫薇属紫薇流式细胞仪分析结果
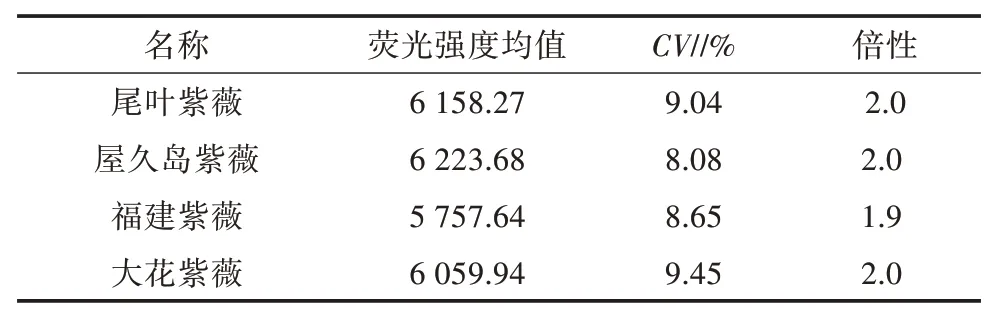
表2 紫薇属植物流式细胞仪倍性
2.3 紫薇×大花紫薇杂交F1代植株流式细胞仪倍性鉴定
以尾叶紫薇为对照,采用检测试剂盒B 对紫薇×大花紫薇杂交F1代植株、Dynamite、大花紫薇、福建紫薇进行倍性检测,结果(表3)表明,整体变异系数为5.80%~7.88%,紫薇×大花紫薇杂交F1代植株的倍性与尾叶紫薇相同,均为二倍体,同时检测亲本Dynamite、大花紫薇的倍性也为二倍体,福建紫薇的倍性也为二倍体,流式细胞仪分析结果见图3。
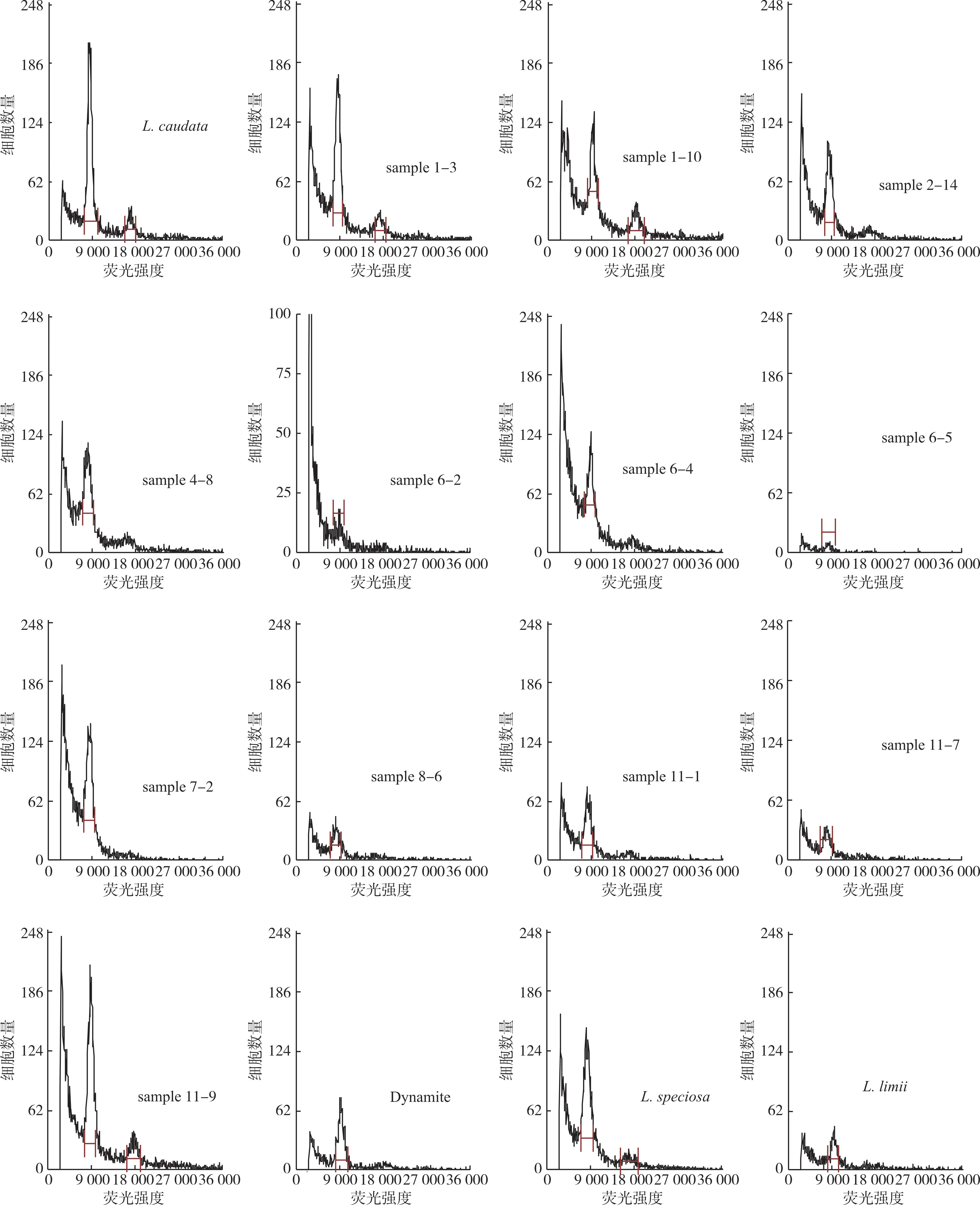
图3 紫薇样品植株流式细胞仪倍性检测结果
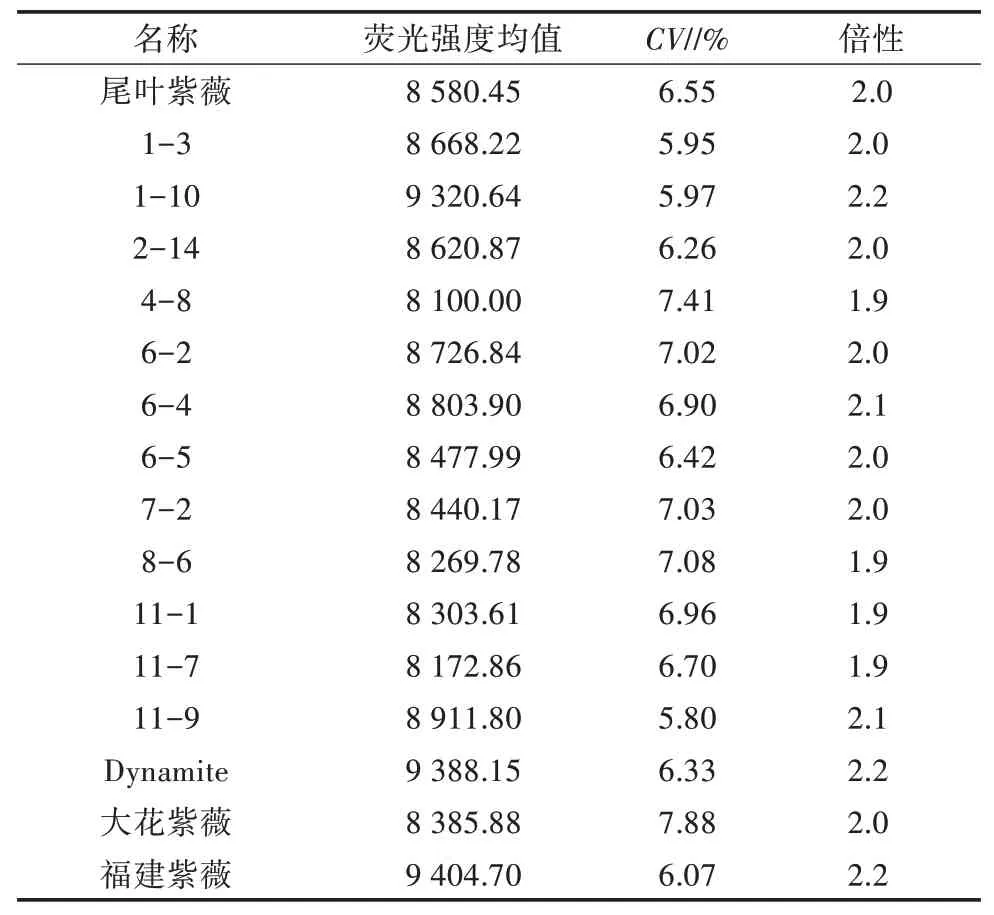
表3 紫薇×大花紫薇杂交F1代植株流式细胞仪倍性检测结果
由图3 可知,有些紫薇样品的结果有2 个峰,分别是突出的G1 峰和较小或有时无法检测到的G2峰,分别代表了不同细胞周期的细胞核,采用新鲜叶片样品进行检测通常会得到这样的结果[30,45]。
2.4 利用SSR 分子标记进行倍性分析
利用SSR 分子标记进行倍性分析,获得引物扩增谱带后,如图4 所示,以引物P10 为例,统计8 对SSR 引物在紫薇品种Dynamite、大花紫薇、福建紫薇、26 株紫薇×大花紫薇种间杂种F1代植株的等位基因数(表4)。由表4 可见,29 份紫薇样品在每个引物位点的等位基因数均为1~2 个,说明所有检测样品的倍性均为二倍体。
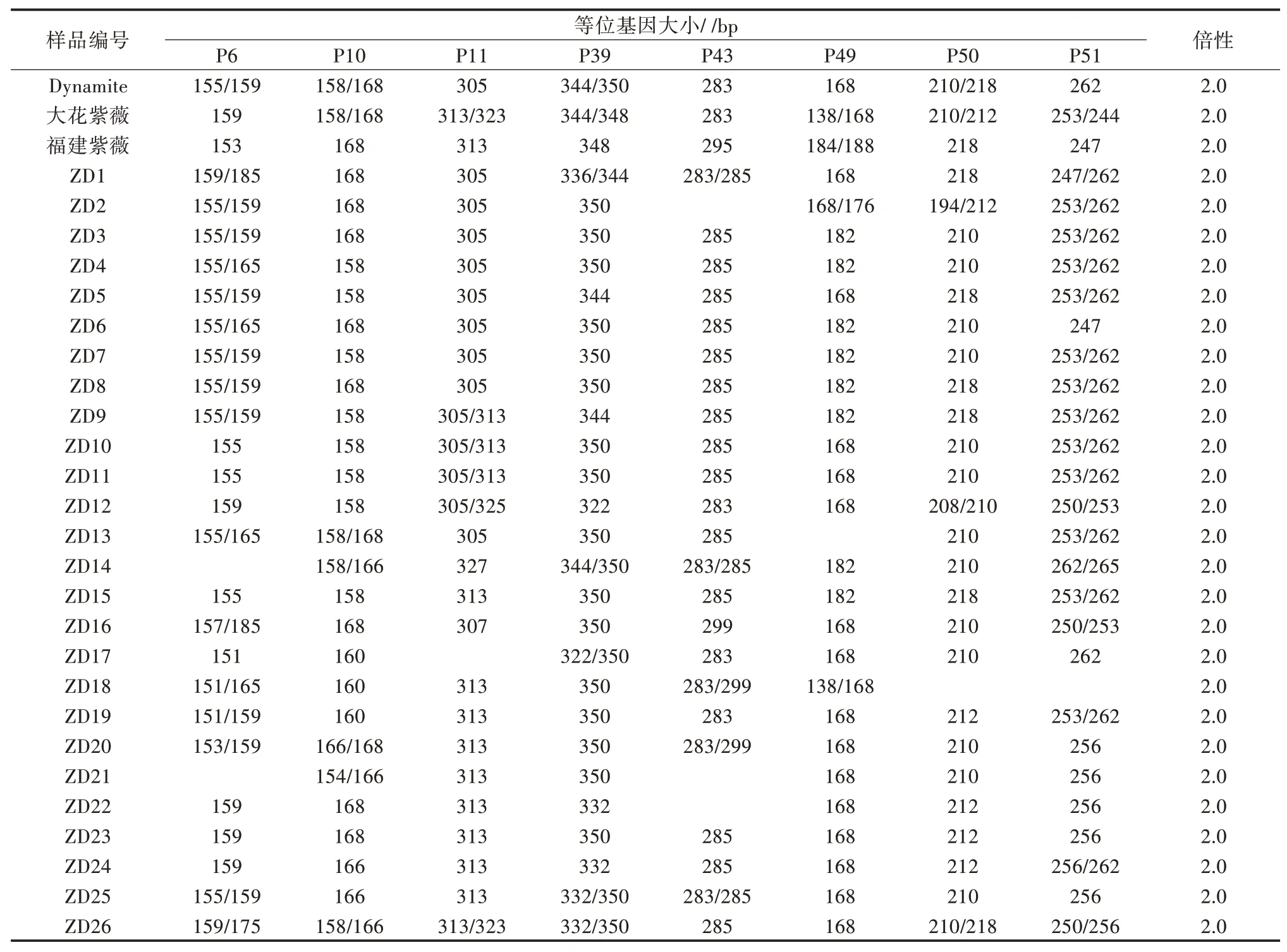
表4 8 对引物的等位基因大小和倍性估计
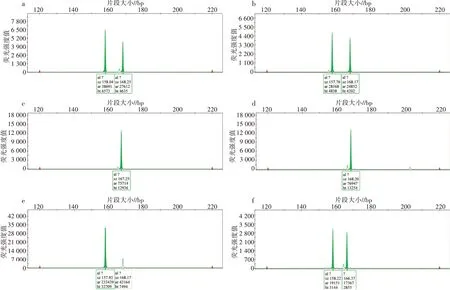
图4 引物P10 的扩增图谱
3 小结与讨论
合适的细胞核提取液对于获得理想的核悬浮液至关重要,也是流式细胞仪获得较好结果的关键,但目前还未发现一种适用于植物的通用解离液[45]。木本植物因为叶片中含有多酚、单宁、花色素苷和黏性物质而使其提取效果相对较差[46],本研究采用Cystain UV Precise P 和CyStain UV OxProtect 2 种不同提取试剂盒在紫薇叶片的提取上都有较好的效果,抗氧化试剂盒CyStain UV OxProtect 在尾叶紫薇、屋久岛紫薇上都有相对不错的改善效果,表现出碎片减少、细胞核数更高,峰图质量提高,但在大花紫薇、福建紫薇以及紫薇×大花紫薇子代植株上未见到明显效果,对比试验时甚至未检测到明显的峰。推测可能与叶片状态有关,建议选取更为幼嫩的叶片材料来进行检测。紫薇叶片含有多糖、多酚类物质,聂硕[43]在提取缓冲液中加入1%PVP 也不能完全消除杂质对细胞核提取效果的影响,可考虑添加PVP-40 或PVP-360 减少多酚和其他次生代谢物的影响[36]。
流式细胞仪常规的倍性分析多采用外标法[47],Pellicer 等[36]建议已知倍性的对照样本应为该物种已知的最低倍性水平,杨冰洁等[11]用染色体计数法统计紫薇、屋久岛紫薇和福建紫薇的染色体数目均为2n=48,杨冰洁[44]用染色体计数法和FISH 技术确定紫薇、屋久岛紫薇、福建紫薇和尾叶紫薇的染色体数目为2n=48,刘亚琼[27]用流式细胞仪检测紫薇、屋久岛紫薇、福建紫薇、尾叶紫薇等11 个品种为二倍体,刘婷婷等[28]采用流式细胞仪测定尾叶紫薇、屋久岛紫薇、大花紫薇、南洋紫薇、网脉紫薇、川黔紫薇、桂林紫薇、紫薇、紫薇‘粉精灵’、紫薇‘Pocomoke’等紫薇属10 个种或品种均为二倍体。本研究以尾叶紫薇作为对照,选取扦插后刚萌发的新鲜嫩叶,检测了屋久岛紫薇、福建紫薇、大花紫薇等紫薇属植物的倍性均为二倍体,紫薇品种Dynamite、12 份紫薇×大花紫薇种间杂种子代植株也均为二倍体。流式细胞仪检测结果中有些样品表现出明显的双峰,其中G2 峰表现为较小的峰,有些样品甚至没有检测到,这与Doležel 等[30]的结论相符。混倍体或嵌合体植株分析结果也表现出明显的双峰,但其G2 峰相比新鲜叶片二倍体的G2 峰细胞核数量更多、峰更高,在结果中表现为G1 峰、G2 峰高度差距不大[24,30]。宋新红等[48]研究发现,紫薇二倍体与人工诱导四倍体植株流式细胞仪检测结果中都有3 个峰且第1 个峰位置相同,认为有核内多倍性发生,Doležel 等[30]认为内多倍体的存在可以通过额外的具有更高DNA水平的峰来证明。
贾会霞等[49]研究证实了SSR 标记能较好地反映植物的倍性情况,可以作为检测植物倍性的重要依据,目前结合流式细胞仪已在康乃馨[40]、油茶[39]、枣树[50]、美洲黑杨[32]等树种的种质资源倍性鉴定上成功应用。本研究采用8 条SSR 标记判定紫薇品种Dynamite、大花紫薇、福建紫薇、26 株紫薇×大花紫薇种间杂种F1代植株的倍性均为二倍体,这与流式细胞仪的结果一致,证实了SSR 标记结合流式细胞仪反映植物倍性的可行性,为紫薇种间杂交育种工作奠定了基础。

