猪流行性腹泻病毒N-E.coliOmpA融合基因构建、表达及其免疫原性评价
沈学怀,汪洁茹,尹 磊,周学利,赵瑞宏,潘孝成,戴 银,殷冬冬,张丹俊,胡晓苗,侯宏艳
(1.安徽省农业科学院畜牧兽医研究所,安徽省畜禽疫病研究中心,安徽 合肥 230031;2.畜禽产品安全工程安徽省重点实验室,安徽 合肥 230031)
猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)可感染不同日龄和品种的猪,引发以剧烈腹泻、呕吐和脱水为特征的腹泻病,肥育猪和成年猪对该病毒有一定的抵抗力,常呈隐形感染,但仔猪尤其是哺乳期仔猪感染可引起大规模的死亡,严重危害养猪产业的健康发展[1]。PEDV是线性单股正链RNA病毒,分别编码4个结构蛋白(N、S、E和M蛋白)和2个非结构蛋白(ORF3和lab蛋白)[2]。PEDV N蛋白是一种磷酸化的核衣壳蛋白,在不同的PEDV毒株中N蛋白的基因序列高度保守,并且猪只在感染PEDV的早期,体内就会产生高水平的N蛋白抗体[3],因此可以作为PEDV的亚单位疫苗和诊断治疗的靶蛋白。大肠杆菌外膜蛋白A(E.coli Omp A)是大肠杆菌菌体外膜的重要组成部分,包括4个由ß折叠组成的外环状结构,在不同血清型的大肠杆菌Omp A蛋白结构保守,免疫原性好,因此也被作为大肠杆菌感染的亚单位疫苗的候选蛋白[4]。单一表达的纯化蛋白由于分子量较小,结构简单,免疫原性往往较差。研究发现,多基因融合表达蛋白的免疫原性显著高于单一蛋白[4-6]。本研究探索将PEDV N蛋白和E.coli Omp A蛋白基因进行融合表达,并对表达的复合蛋白进行免疫原性评价,以期为PEDV结构蛋白研究和不同病原基因融合表达系统建立提供理论基础。
1 材料与方法
1.1 试验材料
Nde I酶、Xba I酶、T4连接酶、DH5α感受态细胞、异丙基-β-D-硫代半乳糖苷(IPTG)、pCold I质粒、DNA Marker、蛋白Marker、蛋白纯化柱、ECL发光液、质粒提取试剂盒均为宝生物工程(大连)有限公司。组蛋白抗体、羊抗兔和羊抗鼠HRP标记抗体为abcom产品;OmpA抗体和PEDV N抗体为安徽省农业科学院畜牧兽医研究所保存;PEDV重组N蛋白抗体ELISA检测试剂盒由安徽省农业科学院畜牧兽医研究所提供;弗氏完全佐剂为碧云天生物技术有限公司产品。本试验实施期为2021年6—11月,试验地点在安徽省农业科学院畜牧兽医研究所。
1.2 融合基因修饰和质粒构建
从NCBI数据库选取PEDVN基因序列(JN601062.1)和大肠杆菌OmpA基因序列(CP041416.1),采用SignalP在线工具预测基因信号肽,去除序列的信号肽序列和终止密码子,并在序列两端添加酶切位点。将经过修饰的OmpA的DNA序列和PEDV N的DNA序列通过柔性联接序列(linker)进行联接,构成OmpA-linker-PEDV N的DNA序列,在联接序列后引入一个酶切位点;OmpA-linker-PEDV N序列通过DNA序列全合成的方式构建;并将构建序列插入pCold I质粒,构建为pCold I-OmpA-linker-PEDV N质粒。采用DNAStar软件分析融合基因OmpA-linker-PEDV N编码蛋白的抗原性与亲水性;采用I-TASSER在线工具对融合蛋白OmpA-linker-PEDV N进行同源建模,预测编码蛋白的三级结构。
1.3 重组质粒的原核表达
将pCold I-OmpA-linker-PEDV N质粒转入BL21感受态细胞,通过在培养基中加入氨苄青霉素和氯霉素筛选得到携带pCold I-OmpA-linker-PEDV N质粒的阳性感受态细胞;加入终浓度为0.1 mM IPTG,并在15 ℃条件下继续培养24 h以诱导融合蛋白表达。
1.4 SDS-PAGE检测与Western blot鉴定
收集诱导表达后的菌液,超声波破碎菌体,收集离心上清液和菌体沉淀保存备用。分别取20 μL收集的样品,加入5 μL上样缓冲,煮沸10 min,进行SDS-PAGE电泳观察融合蛋白表达。SDS-PAGE电泳凝胶通过转膜仪将蛋白转移至PVDF膜上通过常规Western blot操作:膜封闭、一抗孵育(组蛋白标记抗体)、二抗孵育、显色等过程鉴定融合蛋白的表达。
1.5 融合蛋白的纯化
将融合蛋白样品加入Ni-NTA亲和层析柱,4 ℃过夜孵育。用低浓度的咪唑缓冲液洗脱杂蛋白,采用高浓度的咪唑缓冲液洗脱下目的蛋白。用透析袋透析去除高浓度的咪唑和盐,SDS-PAGE检测蛋白纯化效果。
1.6 Western blot检测融合蛋白体的免疫原性
分别采用OmpA蛋白多抗和PEDV N蛋白单抗对融合蛋白进行Western blot检测。蛋白样品经变性、电泳、转膜和封闭后,4 ℃过夜孵育PEDV N(1∶2 000稀释)蛋白单抗和OmpA(1∶1 000稀释)蛋白多抗,HRP标记山羊抗兔二抗(1∶5 000)和兔抗鼠二抗(1∶8 000)与PVDF膜在常温孵育1~2h,显色后拍照。
1.7 融合蛋白免疫原效果评价
将纯化后的融合蛋白样品和PEDV N蛋白经浓度测定后,调整蛋白浓度均为1 mg/mL。将两种蛋白溶液与弗氏完全佐剂按照1∶1的比例混合乳化,制备免疫抗原。采用ELISA方法从60日龄仔猪中挑选10头PEDV血清抗体阴性仔猪进行试验。将10头仔猪分成两组,每组5头,预试期5 d,预试期过后分别颈部肌肉接种制备的融合蛋白和PEDV N蛋白的免疫抗原。免疫程序为:65日龄首免,1.5 mL;75日龄二免,2 mL;90日龄三免,2 mL。分别在85日龄和100日龄采血,ELISA测定血清PEDV N蛋白抗体水平。
2 结果
2.1 融合基因修饰与质粒构建
SignalP软件预测发现OmpA基因序列 5'端的63个核苷酸为信号肽;PEDV N基因无信号肽序列。将OmpA基因的5'端的信号肽序列去除,并加入“CAT” 3个核苷酸序列,和原有“ATG”序列合成5'端Nde I酶切位点(CATATG),经过修饰的OmpA的DNA序列长度为981 bp。将PEDV N基因3'终止密码子去除,插入一个Xba I酶切位点(TCTAGA),经过修饰的PEDV N的DNA序列长度为1 329 bp。OmpA和PEDV N基因通过linker序列(3×GGTGGTGGTGGCAGC)进行连接,并在linker序列后插入Xho I酶切位点,通过基因全合成方式构建了OmpA-linker-PEDV N融合基因;将融合基因插入pCold I表达质粒,构建了pCold I-OmpA-linker-PEDV N重组表达质粒,其结构如图1所示。重组表达质粒大小为6 708 bp的环状结构,采用Xho I和Hind III对双酶切鉴定重组质粒,结果显示得到了完整的重组表达质粒(图2)。
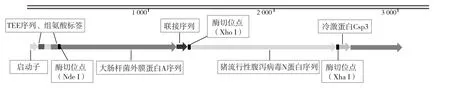
图1 重组质粒pCold I-OmpA-linker-PEDV N结构
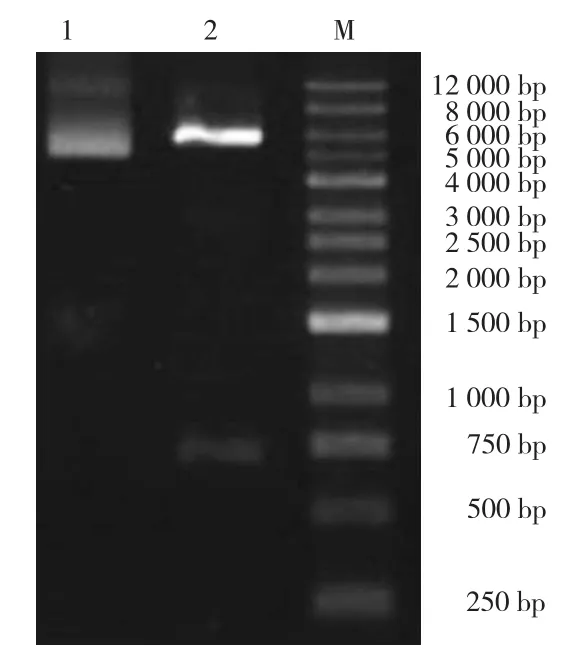
图2 重组质粒pCold I-OmpA-linker-PEDV N酶切鉴定
2.2 融合蛋白的表达与结构分析
SDS-PAGE检测融合基因的表达如图3所示,与未诱导表达的细菌裂解上清液相比,在IPTG诱导条件下,细菌裂解上清液中出现了相对分子质量约为88 ku的目的条带,与重组融合蛋白大小相符。与细菌裂解上清液相比,细胞沉淀中的相应的蛋白含量较低,说明表达的复合蛋白为融合表达蛋白。结果表明,重组质粒在BL21感受态细胞中成功表达出大小为88 ku的融合蛋白。融合基因OmpA-linker-PEDV N编码蛋白的抗原性与亲水性经DNAStar软件分析可见(图4),融合基因编码的蛋白包含787个氨基酸,其二级结构、抗原性和亲水性均未发生明显变化,linker区域具有一定的亲水性和抗原性。采用I-TASSER在线工具对融合蛋白OmpA-linker-PEDV N进行同源建模,预测了编码蛋白的三级结构。结果表明,融合蛋白可以折叠成正确的空间结构,说明融合基因的设计是合理的。

图3 融合蛋白OmpA-linker-PEDV N表达鉴定
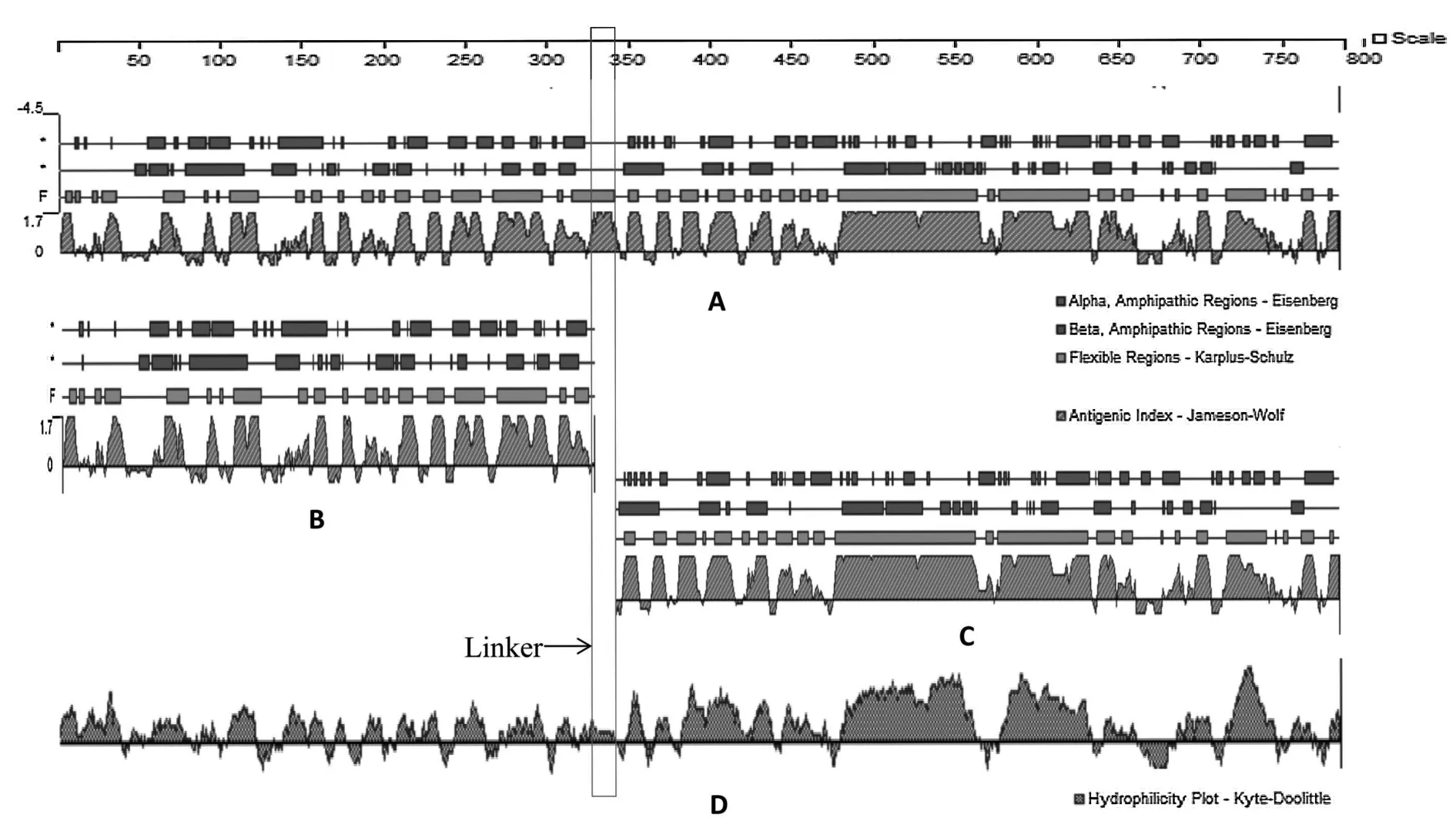
图4 融合蛋白OmpA-linker-PEDV N的二级结构、抗原性和亲水性分析
2.3 融合蛋白的鉴定与纯化
将未诱导表达以及诱导表达的裂解上清液和沉淀样品采用组蛋白抗体进行Western blot鉴定,结果如图5所示,诱导表达的裂解上清液和沉淀样品在目标蛋白位置出现特异性发光条带,而未诱导表达样品则出现一些杂带。通过Ni-NTA亲和层析柱洗脱和透析得到纯化较高的融合蛋白(图6)。
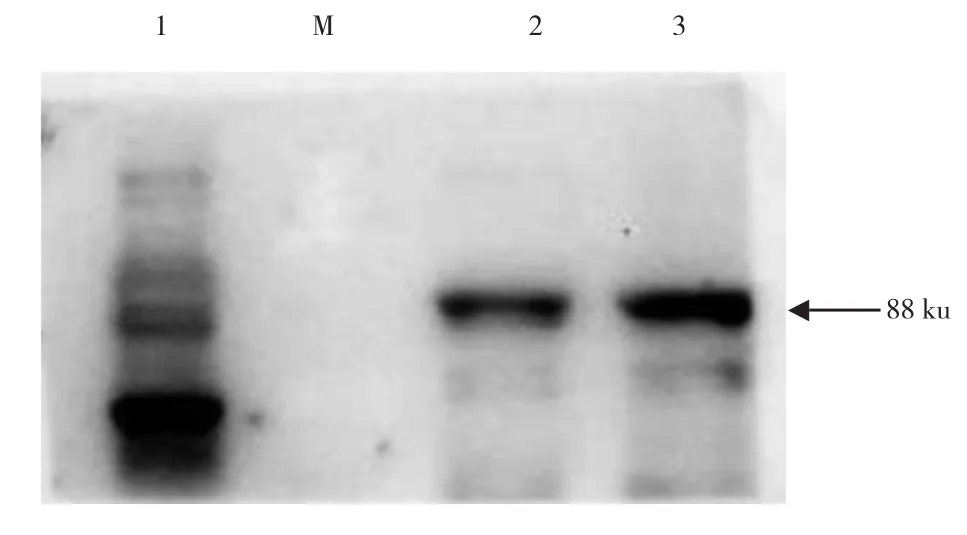
图5 Western blot鉴定融合蛋白OmpA-linker-PEDV N
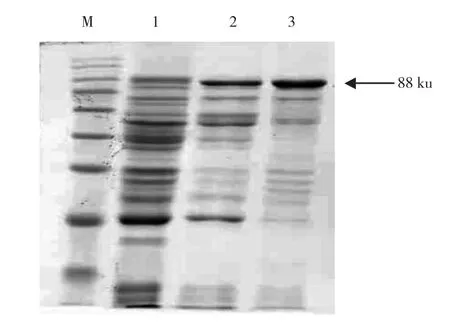
图6 融合蛋白OmpA-linker-PEDV N的纯化
2.4 融合蛋白免疫原性检测
采用Omp A蛋白多抗和PEDV N蛋白单克隆抗体检测融合蛋白的免疫原性。结果如图7所示,Western blot检测显示融合蛋白可以分别与Omp A蛋白抗体和PEDV N蛋白抗体产生特异性免疫反应,表明融合蛋白同时具有Omp A蛋白和PEDV N蛋白的免疫原性。
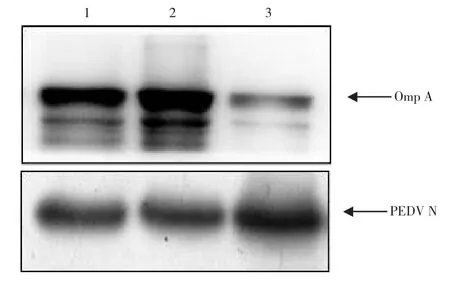
图7 融合蛋白的OmpA和PEDV N免疫原性
2.5 融合蛋白免疫效果评价
将纯化的融合蛋白与原核表达的PEDV N蛋白加入弗氏完全佐剂制备免疫抗原,免疫65日龄仔猪。ELISA检测融合蛋白与PEDV N蛋白接种后的血清抗体水平,结果如图8所示,接种前两组血清PEDV N蛋白抗体水平均为阴性;在85日龄两组血清PEDV N蛋白抗体水平均转变为阳性,其中融合蛋白接种组的血清抗体水平显著高于单一PEDV N蛋白接种组(P<0.05);100日龄融合蛋白组的血清抗体水平显著高于PEDV N蛋白接种组(P<0.05),且两组血清抗体水平均高于85日龄水平。结果表明,融合蛋白的免疫原性高于单一PEDV N蛋白。
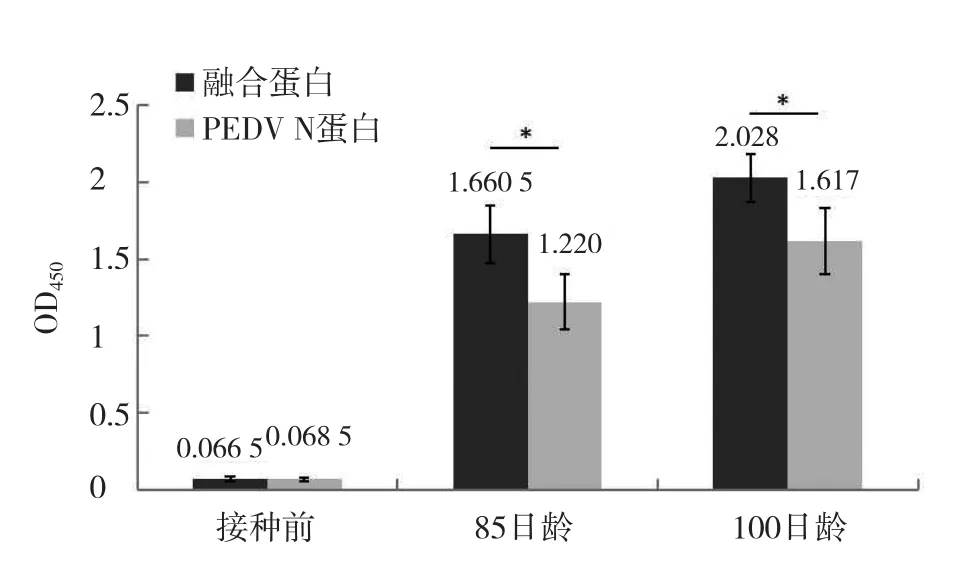
图8 ELISA检测猪血清中PEDV N抗体水平
3 讨论
PEDV感染是造成仔猪严重腹泻甚至死亡的重要因素,给养猪业造成巨大的损失。PEDV N蛋白基因高度保守,并且在感染后会很快出现相应的血清抗体,是PEDV诊断的常用靶基因或靶蛋白[3]。国内外均有报道以N蛋白为基础研制的PEDV抗原或抗体检测方法。最近的研究发现PEDV N蛋白具有促进PEDV在细胞内增殖的作用[7],研究人员进一步探索以N蛋白为基础的亚单位疫苗[8]和以N蛋白为靶向蛋白的抗病毒药物研发[9-10]。以上研究都证明了PEDV N蛋白在防控PEDV感染方面的应用价值。E.coli Omp A是与细菌黏附作用有关的重要蛋白,可通过Toll样受体(Toll-like receptor)激活抗原提呈细胞并释放免疫相关的活性因子以激发免疫系统产生非特异性和特异性免疫,同时能够诱导淋巴细胞增殖,是一种天然的免疫佐剂[11]。
近几年,多基因融合表达技术越来越受到科技人员的关注[12-13],与单一表达的蛋白相比,多基因融合表达的复合蛋白具有两个主要的优势:一是增加蛋白的免疫原性,提供更多的抗原表位,起到蛋白之间互为免疫佐剂的作用[5,14];二是可以同时表达不同活性或用途的蛋白,使蛋白的生物学功能更加多元化[15-16]。金蕾等将甲型副伤寒沙门氏菌spa O和Omp A基因串联后进行融合表达,得到spa O-Omp A融合蛋白对小鼠的攻毒保护率显著高于单独免疫spaO或Omp A蛋白[5]。针对牛源多杀性巴氏杆菌建立pm0979-Plp E的融合基因表达质粒,其表达的融合蛋白发挥了协同增效作用,对不同血清型的多杀性巴氏杆菌提供了交叉保护作用,其保护率好于单独蛋白免疫的效果[14]。马德星等将鸡堆形艾美球虫子孢子表面抗原3-1E基因片段(Ea3-1E)与编码鸡白细胞介素15成熟蛋白基因片段(mChIL-15)进行串联连接表达,在二次免疫后可提供明显的抗球虫免疫保护效果[17]。以上研究均表明,融合基因表达产物在蛋白功能研究、亚单位疫苗研制等方面具有独特的优势。
本研究选取PEDV N蛋白和Omp A蛋白基因构建融合基因,通过原核表达载体实现复合蛋白的融合表达。其中在两个基因之间插入柔性连接,在保证两个基因融合表达以及保持独立构像的重要因素[18]。甘氨酸(Gly,G)分子质量小、柔性好,丝氨酸(Ser,S)亲水性极强,因此这两个氨基酸广泛应用于融合蛋白的联接结构[19]。本研究采用3×GGGGS的柔性氨基酸序列作为连接结构,从而保证了复合蛋白中PEDV N蛋白和Omp A蛋白保持了各自的空间构像。融合蛋白的免疫原性检测也表明,原核表达的融合蛋白具有PEDV N蛋白和Omp A蛋白的双重免疫原性。目前,关于多基因融合表达研究多是采用将同一物种的多种抗原基因进行融合表达或者将抗原基因与免疫调节基因进行串联表达的策略[5,14-17]。本研究探索将病毒抗原与细菌抗原进行基因融合表达,以此来增强表达蛋白的免疫原性。通过比较单一PEDV N蛋白和融合蛋白免疫后血清抗体水平,结果表明融合蛋白的免疫原性显著高于单一蛋白。本研究得到的复合蛋白可以为PEDV N蛋白功能研究、特异性抗体制备以及PEDV亚单位疫苗的研制提供材料和研究基础。
——一道江苏高考题的奥秘解读和拓展

