猪胸膜肺炎放线杆菌血清15型的分离鉴定与药敏试验
李 国,张垚垚,王嘉珍,李 郁
(安徽农业大学动物科技学院,安徽 合肥 230036)
猪传染性胸膜肺炎(Porcine contagious pleuropneumoniae, PCP)是由猪胸膜肺炎放线杆菌(Actinobczcillus pleuropeumonicze, APP)引起的猪高度致死性呼吸道传染病,主要临诊特征为肺出血、坏死和纤维素性渗出。PCP传染性强,任何生长阶段的猪均有易感性,世界范围内各养猪场PCP发病率不断上升,对养猪业造成的危害不容忽视。根据APP荚膜多糖(CPS)和脂多糖(LPS)抗原性差异,可将其分为18种血清型;依据生长是否需要烟酰胺腺嘌呤二核苷酸(NAD),又分为两个生物型,即生物Ⅰ型(NAD依赖型)和生物Ⅱ型(非NAD依赖型),其中血清13、14型为生物Ⅱ型,血清17型菌株生物Ⅰ型和Ⅱ型都有,其他血清型均为生物Ⅰ型。不同国家和地区的APP优势血清型存在差异,但随着种猪交流日益增多,一些非典型菌株逐渐流行,其中血清15型菌株分离率呈现上升趋势[1-2]。不同血清型或同一血清型不同菌株之间临床致病力不尽相同,且不同血清型之间没有或仅有较弱的交叉保护力,尤其是目前市场上存在的商品化疫苗仅涉及血清1、2、3和7型,致使疫苗免疫效果常不确实或免疫失败,从而使该病的防治难度进一步增大。
2021年9—10月,某集团公司在GX、SD地区部分猪场70~300日龄猪只出现疑似PCP疫情,临床表现为呼吸困难、咳嗽、急性死亡等,剖检变化均为肺脏淤血,部分为肺脏肿大、肺间质增宽、肺表面有纤维素性渗出,脾脏淤血,发病率为5.0%~30.0%,病死率为1.1%~19.0%。为确定致病原,本试验采用常规细菌学方法对病料组织进行细菌分离培养与生物型鉴定,PCR技术进行APP及其血清型鉴定、毒力基因型检测及分离菌株之间的亲缘关系鉴定,Kirby-Bauer纸片琼脂扩散法(简称K-B法)测定分离菌株的药物敏感性。试验结果不仅为猪场有效防治PCP提供了技术支撑,也为了解区域性APP流行动态提供了参考依据。
1 材料与方法
1.1 病料来源
病料为某集团公司在GX、SD地区部分猪场疑似PCP的11份病料组织(1份病死猪脾脏和10份病死猪肺脏),相关试验于2021年9—10月在安徽农业大学动物传染病研究室开展。
1.2 主要试验材料
0.6%酵母浸膏胰酪胨大豆琼脂(TSA-YE)、0.6%酵母浸膏胰酪胨大豆肉汤(TSB-YE)购自杭州微生物试剂有限公司;新生小牛血清购自上海羽哚生物科技有限公司;无菌脱纤维兔血购自南京茂捷微生物科技有限公司;革兰氏染液购自南京建成生物工程研究所;琼脂糖、烟酰胺腺嘌呤二核苷酸(NAD)购自生工生物工程(上海)股份有限公司;2×Taq PCR Master Mix、DL 2 000 DNA Marker购自莫纳(武汉)生物科技有限公司;17种抗生素(新霉素、环丙沙星、庆大霉素、头孢唑林、氧氟沙星、复方新诺明、甲氧苄啶、氨苄西林、氟苯尼考、阿奇霉素、头孢曲松、丁胺卡那、诺氟沙星、链霉素、红霉素、四环素和林可霉素)购自杭州天和微生物试剂有限公司。
1.3 质控菌株
肺炎链球菌(菌种保藏编号为ATCC49619)和大肠杆菌(菌种保藏编号为ATCC25922)均由安徽农业大学动物传染病研究室保存,作为测定APP分离株耐药表型的质控菌株。
1.4 细菌的分离培养及形态学观察
无菌采取1份病死猪脾脏和10份病死猪肺脏接种于TSA-YE培养基(含5%小牛血清及1.5%NAD)、TSA-YE培养基(含5%小牛血清)、5%兔血琼脂培养基,置37 ℃条件下培养18~24 h,观察细菌的生长情况,并挑取单个可疑菌落进行革兰氏染色,镜检,观察其形态特征。
1.5 引物合成
参照文献[3-4]设计PCR鉴定APP及其血清型、毒力基因型引物(表1)。引物均由合肥通用生物科技有限公司合成。

表1 PCR鉴定APP及其血清型、毒力基因型引物序列
1.6 分离菌的PCR鉴定
利用煮沸法提取分离菌基因组DNA作为模板,用于PCR鉴定APP。PCR反应体系(25 μL):2×Taq PCR Master Mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 5 μL,ddH2O 5.5 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,57 ℃ 90 s,72 ℃ 1 min,3个循环;95 ℃ 20 s,57 ℃1 min,72 ℃ 1 min,30个循环;72 ℃ 10 min。PCR产物经琼脂糖凝胶电泳后在凝胶成像仪上进行观察,并记录结果。
1.7 NAD依赖试验
将鉴定为APP的分离菌分别接种于NAD阳性(含5%小牛血清及1.5% NAD)和NAD阴性(只含5%小牛血清,不含NAD)的TSA-YE培养基上,置37 ℃条件下培养18~24 h后观察其生长情况。
1.8 血清型鉴定
参照1.6提取APP模板DNA,用于PCR鉴定血清型。PCR反应体系(25 μL):2×Taq PCR Master Mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 5 μL,ddH2O 5.5 μL。PCR反应条件:95 ℃ 10 min;95 ℃ 15 s,57 ℃ 1 min 30 s,72 ℃2 min 30 s,30个循环;72 ℃ 10 min。PCR产物经琼脂糖凝胶电泳后在凝胶成像仪上进行观察,并记录结果。
1.9 毒力基因鉴定
ApxⅠ、ApxⅡ、ApxⅢ和ApxⅣ基因PCR反应体系(总体积15 μL):2×Taq PCR Master Mix 7.5 μL,ddH2O 6.5 μL,上、下游引物(10 μmol/L)各加0.5 μL,挑取菌落放入配好的PCR体系中,用移液枪吹打均匀,作为DNA模板。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,ApxⅠ65 ℃退火30 s,ApxⅡ63 ℃退火30 s,ApxⅢ、ApxⅣ61 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸7 min。PCR产物经琼脂糖凝胶电泳后在凝胶成像仪上进行观察,并记录结果。
1.10 毒力基因分析
将含目的基因片段的PCR产物纯化后测序,采用DNAStar(Version 7.10)软件对获得的毒力基因序列进行序列同源性分析,用MEGA 11.09软件构建APP的毒力基因序列系统发育树进行遗传进化分析。
1.11 药物敏感性试验
参照美国临床和实验室标准化协会(Clinical Laboratory Standards Institute, CLSI, 2016)推荐的方法,采用Kirby-Bauer纸片琼脂扩散法测定分离株对17种药物的敏感性。
2 结果与分析
2.1 细菌的分离培养及形态学观察
自11份病死猪组织脏器中各分离1株菌,共计11株。其中,7株于2021年9—10月分离自GX地区部分猪场病死猪脾脏、肺脏,编号为1—7号,4株于2021年10月分离自SD地区部分猪场病死猪肺脏,编号为8—11号。分离菌在TSA-YE培养基(含5%小牛血清及1.5% NAD)上培养24 h后,均呈圆形、表面光滑、灰白色半透明的水珠样菌落。对TSA培养基(含5%小牛血清和1.5% NAD)上可疑菌落涂片染色镜检,分离菌镜检结果均为革兰氏阴性菌,显微镜下观察均呈细小短杆状、球杆状或长丝状,两端钝圆,符合APP的形态学特征(图1)。
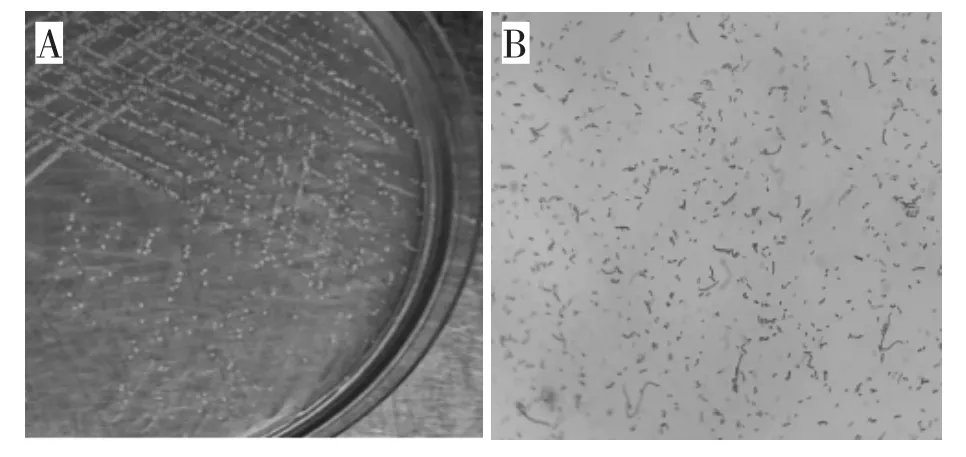
图1 分离菌培养特性及形态学特征
2.2 分离菌的PCR鉴定
利用APP特异性引物对分离菌进行PCR扩增和琼脂糖凝胶电泳检测,阳性对照出现342 bp扩增条带、阴性对照无条带出现,试验结果成立。11株分离菌PCR扩增产物与阳性片段大小均相符,确定为APP,分别命名为GXgg21-1、GXgg21-2、GXgg21-3、GXgg21-4、GXgg21-5、GXgg21-6、GXgg21-7、SDdz21-1、SDdz21-2、SDdz21-3、SDta21-1,编号为1—11号(图2)。
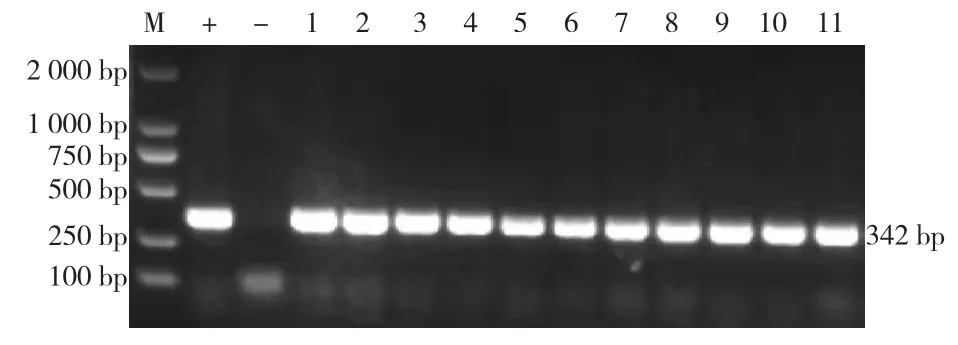
图2 分离菌的PCR扩增结果
2.3 NAD依赖试验
分离菌在NAD阳性的TSA-YE培养基上均生长良好,在NAD阴性的TSA-YE培养基、5%兔血琼脂培养基上均不生长,均符合生物Ⅰ型APP特征(图3)。

图3 分离菌NAD依赖试验结果
2.4 血清型鉴定
利用APP血清15型特异性引物对APP分离菌进行PCR扩增。结果显示,生物Ⅰ型APP分离菌均获得1 575 bp目的片段,与预期片段的大小相符,确定为血清15型(图4)。
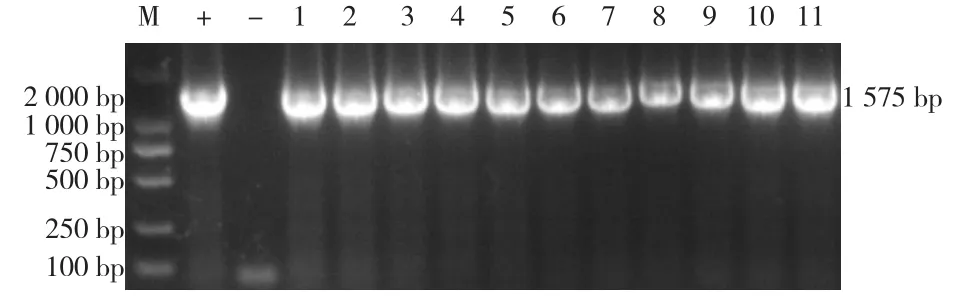
图4 分离菌的血清型PCR扩增结果
2.5 毒力基因鉴定
对11株APP分离菌的ApxⅠ、ApxⅡ、ApxⅢ和ApxⅣ毒力基因进行PCR检测,结果显示,分离菌共有3种毒力基因谱,1—5号、8—10号分离菌的毒力基因谱一致,均检测到ApxⅡ、ApxⅢ和ApxⅣ基因,而均未检测到ApxⅠ毒力基因;6、7号分离菌的毒力基因谱一致,均检测到ApxⅢ和ApxⅣ基因,而均未检测到ApxⅠ和ApxⅡ毒力基因;11号分离菌检测到ApxⅠ、ApxⅡ和ApxⅣ基因,而未检测到ApxⅢ基因(表2、图5)。
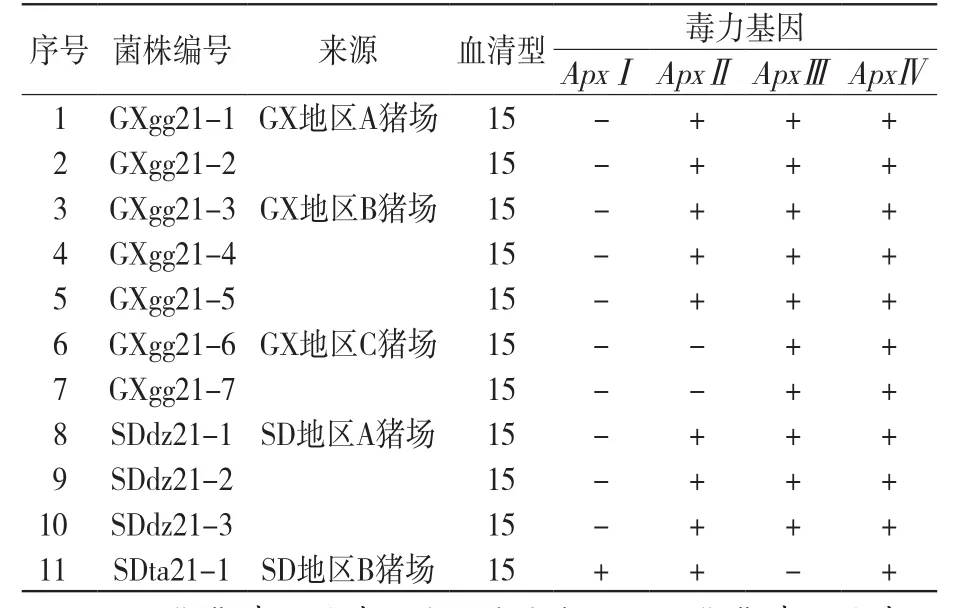
表2 APP分离菌血清15型毒力基因检测结果
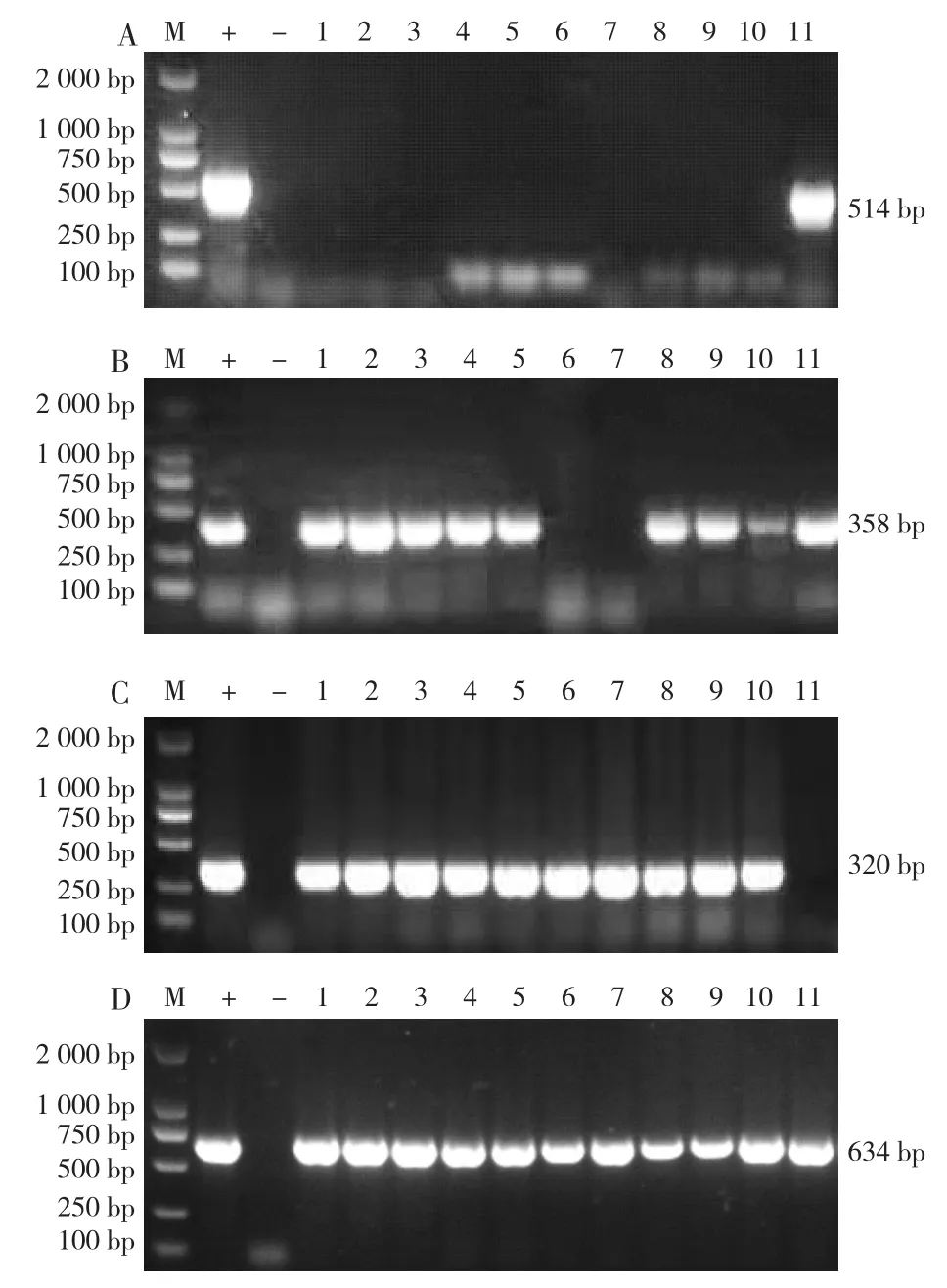
图5 11株APP分离菌毒力基因的PCR鉴定
2.6 毒力基因分析
利用DNAStar(Version 7.10)软件对APP分离菌的ApxⅠ、ApxⅡ、ApxⅢ和ApxⅣ基因序列进行比对。结果显示,9株APP分离菌(1—5号、8—11号分离菌)的ApxⅡ基因相似度为97.1%~100.0%,其中1、2号,5、11号,8、9号分离菌的ApxⅡ基因相似度为100.0%,高度同源;10株APP分离菌(1—10号分离菌)的ApxⅢ基因相似度为99.0%~100.0%,其中1、2、7号,3、5号,4、6号,8、9号分离菌的ApxⅢ基因相似度为100.0%,高度同源;11株APP分离菌(1—11号分离菌)的ApxⅣ基因相似度为96.5%~100.0%,其中1号、2号、5—10号分离菌的ApxⅣ基因相似度为100.0%,高度同源(图6)。

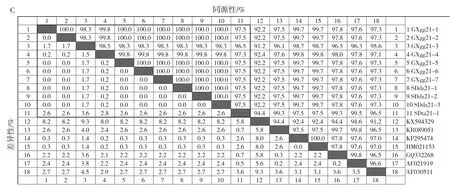
图6 ApxⅡ、ApxⅢ、ApxⅣ毒力基因核苷酸序列
用Maximum Likeihood tree方法分别构建APPApxⅡ、ApxⅢ和ApxⅣ毒力基因核苷酸序列系统进化树。结果显示9株APP分离菌ApxⅡ基因序列分为两个分支,1、2、4、10号分离菌同处于分支一,其中1、2、4,10分别处于同一分支的2个水平上;3、5、8、9、11号分离菌同处于分支二,其中5、11,3、8、9分别处于同一分支的2个水平上。10株APP分离菌ApxⅢ基因序列分为两个分支,其中1、2、7号分离菌同处于分支一;3—6、8—10号分离菌同处于分支二,4,3、5、10,6、8、9分别处于同一分支的不同水平上;11株APP分离菌ApxⅣ基因序列同处于分支一,其中1—10号,11号分离菌分别处于同一分支的2个水平上(图7)。
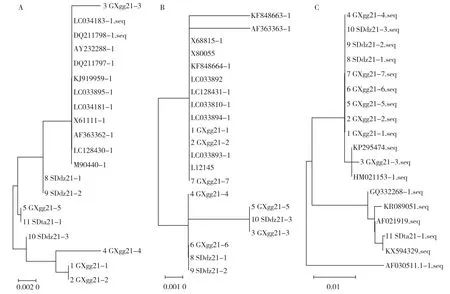
图7 11株APP分离菌毒力基因核苷酸序列系统发育树分析
综上可见,1—11号APP分离菌具有极近的亲缘关系,与目前国内外部分APP流行菌株同源性高,亲缘关系较密切,其中1、2号,8、9号分离菌分离自同一场区,且1、2号,8、9号分离株的ApxⅡ、ApxⅢ和ApxⅣ基因核苷酸序列相似度均达100%,并处于系统发育树的同一分支,高度同源,为同一菌株。
2.7 药物敏感性试验
根据CLSI执行标准判断,质控菌株的抑菌圈大小在规定范围内。1—11号APP分离菌对氧氟沙星和甲氧苄啶的敏感率最高(81.8%),其次是环丙沙星、头孢唑林和阿奇霉素(敏感率为72.7%),对氨苄西林、复方新诺明、头孢曲松、庆大霉素和诺氟沙星的敏感率为63.6%~54.5%,对丁胺卡那、新霉素、链霉素、氟苯尼考、林可霉素、红霉素和四环素的耐药率为45.5%~90.9%(表3)。
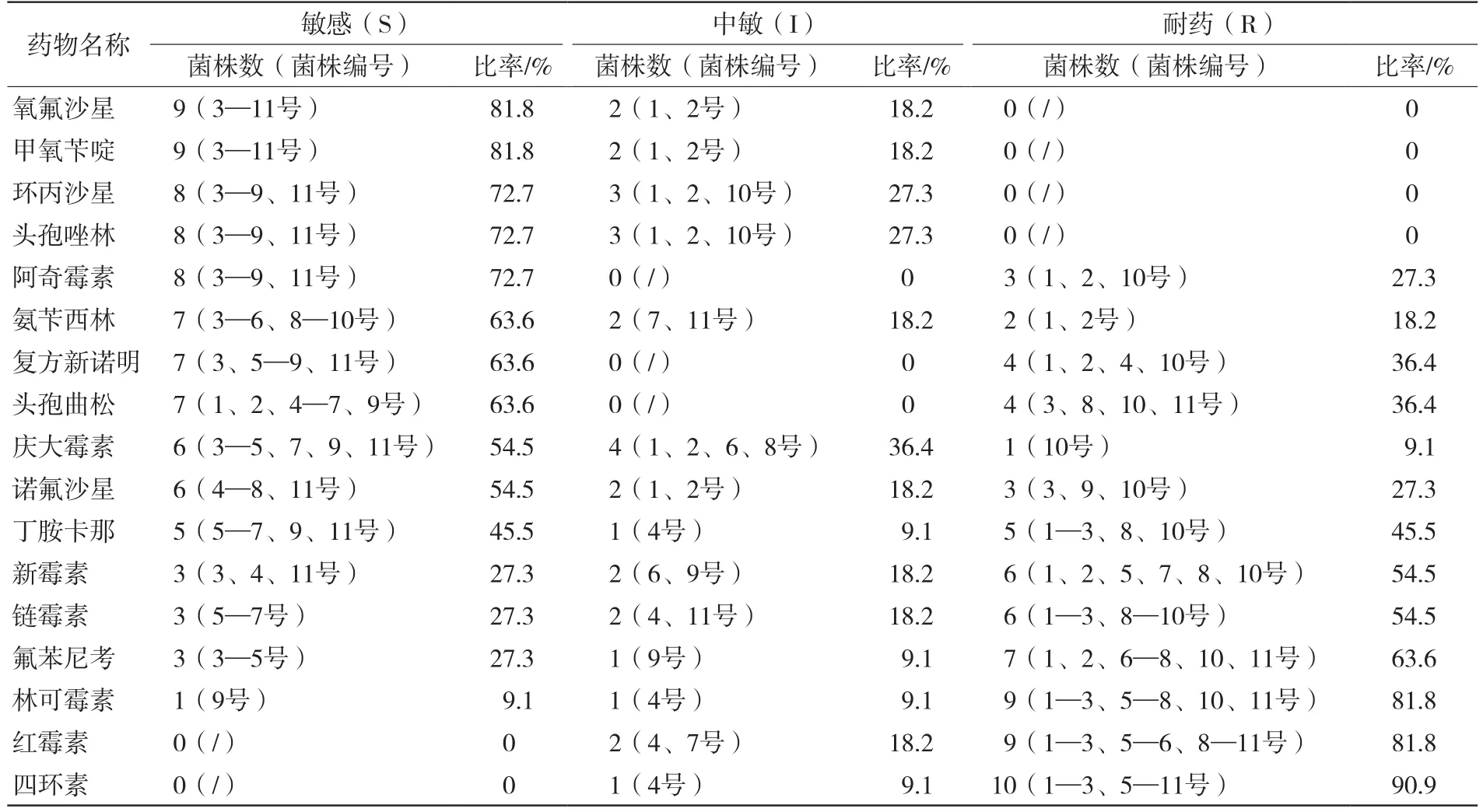
表3 1—11号APP分离菌药物敏感性试验结果
3 讨论
APP主要定居于猪的呼吸道并且具有高度宿主特异性,各个生长阶段的猪均可感染。PCP具有较强的季节性,多发生在春夏交接的4~5月和秋冬交接的9~11月,饲养密度、湿度、舍内氨气和粉尘过高、气温骤变、饲养环境的突然改变、混群、转群、拥挤、长途运输等应激因素是猪群发病的原因。随着现代化养猪生物安全措施加强、管理理念提升、生产工艺的改进、温控条件的改善,由天气突变造成的影响可能越来越小。每年1~2月是生猪的消费旺季,导致存栏猪减少;而3~5月与10~12月发病报道数增多的原因,可能与年后生猪滞销造成存栏增多,年前销售压栏待价有关,导致栏舍密度、氨气浓度、粉尘等增多,PCP死亡案例数报道增多。
本试验针对2021年9—10月,某集团公司在GX、SD地区部分猪场70~300日龄猪只出现的疑似PCP疫情,在掌握相关信息的基础上,包括饲养数量、饲养方式、免疫接种、发病时间、病程进展、用药情况、发病率与病死率等,以及发病时的临床表现和病理剖检变化,通过常规细菌学鉴定方法,采集病料组织进行细菌分离培养与生物型鉴定,应用PCR技术对分离菌进行APP及其血清型鉴定、毒力基因检测以及分离菌之间亲缘关系的确定。结果显示,从疑似APP感染的11份(GX地区7份,SD地区4份)病死猪组织中均分离获得归属于生物Ⅰ型、血清15型的APP。APP分离菌共有3种毒力基因谱,为ApxⅠ-ApxⅡ+ApxⅢ+ApxⅣ+、ApxⅠ-ApxⅡ-ApxⅢ+ApxⅣ+和ApxⅠ+ApxⅡ+ApxⅢ-ApxⅣ+。APP的一种血清型只能产2种或3种Apx毒素,能同时产生ApxⅠ和ApxⅡ毒素的毒性最强[5],由此毒力基因谱为ApxⅠ+ApxⅡ+ApxⅢ-ApxⅣ+的11号APP分离菌毒力可能较强。11株APP分离菌之间具有极近的亲缘关系,同时也与国内外部分APP流行菌株同源性高,关系较密切,其中1、2号,8、9号APP分离菌为同一菌株。目前,国外以血清1、5和7型最为流行,国内优势血清型虽主要为血清7、1和3型,其次为血清5、11、10和13型,然而血清5、11、15和1型菌株分离率呈现逐年增高的趋势[6]。这不仅表明不同地区流行的APP优势菌株不同,同时也提示APP流行血清型处于动态变化中,现存的商品化疫苗可能并不与各地流行的优势菌株相契合。因此,实时监测生产实际中APP流行血清型动态变化是猪场实施长期防治的重要参考。
对PCP的综合防制措施主要包括加强饲养管理、药物防治、预防接种等。免疫接种是预防PCP的有效方法,但APP血清型众多,且相互间交叉保护力弱,因此疫苗中所含APP血清型的选择,要根据具体情况确定。对受威胁但未发病的猪群,可以进行预防性给药。对于发病猪群,早期及时治疗是有效的降低损失的方法。本次试验药敏结果显示,1—11号APP分离菌对氧氟沙星和甲氧苄啶的敏感率最高(81.8%),可作为首选治疗药物,其次是环丙沙星、头孢唑林和阿奇霉素(敏感率为72.7%),对氨苄西林、复方新诺明、头孢曲松、庆大霉素、诺氟沙星的敏感率为63.6%~54.5%,对丁胺卡那、新霉素、链霉素、氟苯尼考、林可霉素、红霉素和四环素则具有不同程度的耐药率(45.5%~90.9%)。据国内外研究报道,源自美国和加拿大的312株APP分离菌对头孢噻呋和氟苯尼考的敏感率均为100%,对托拉菌素和恩诺沙星的敏感率分别为99%和90%,对四环素类药物耐药率为94%~100%[7]。源自塞尔维亚的148株APP分离菌对头孢噻肟、恩诺沙星、氟苯尼考敏感率均为100%,75%分离菌对一种或多种药物具有耐药性,对四环素和链霉素的耐药率分别为34%和31%[8]。我国11株APP四川分离菌呈多重耐药现象,对四环素和多西环素耐药率为90.90%;对盐酸林可霉素、复方新诺明和链霉素耐药率为54.55%[9]。31株APP贵州分离菌对头孢噻吩和头孢拉定敏感率分别为29.03%和22.58%,对青霉素、氨苄西林等10种抗生素耐药率均为100%,呈10重耐药[10]。表明不同来源APP分离菌的耐药性呈现区域耐药、多重耐药特点,因此应通过药敏试验确定行之有效的临床治疗药物,同时应注意使用现行敏感抗菌药物也要谨慎,轮换、穿梭用药结合,关注耐药性变化趋势,防止药物选择压力加重APP多重耐药程度,给PCP的防治带来困难。此外,8、9号APP分离菌虽鉴定为同一菌株,但对包括头孢曲松、庆大霉素等在内的7种抗生素的药物敏感性存在差异,推测可能是由于人类、动物和环境之间的活动与联系,加强了耐药细菌及耐药基因的传播,致使耐药差异性的出现[11]。

