抗反流术后并发胃肠道功能紊乱的影响因素
张岚岚 梁红霞


[摘要] 目的 分析抗反流術后患者并发胃肠道功能紊乱的影响因素,探讨预防抗反流术后并发胃肠道功能紊乱的对策。方法 回顾性分析2017年2月至2019年1月浙江省人民医院收治的行内镜下抗反流手术(EART)治疗的138例胃食管反流(GERD)患者临床资料,将术后未发生胃肠道功能紊乱的84例患者设为对照组,术后发生胃肠道功能紊乱的54例患者设置为观察组;对两组患者的人口学资料、疾病资料、治疗护理资料进行整理分类,并行单因素分析,将差异有统计学意义的因素行多因素logistic分析。结果 ①54例GERD患者行EART术后并发胃肠道功能紊乱以便秘症状为主,其次为腹胀、腹泻。②经单因素分析,两组患者年龄、BMI、术前烧心症状评分、术前泛酸症状评分、术前高血压、合并食管裂孔疝、术前对PPI药物敏感、社会支持度评分、汉密尔顿焦虑评分、汉密尔顿抑郁评分、术前LSP、UESP、手术医师年资、术后下床时间差异有统计学意义(P<0.05);③多因素logistic显示,BMI>24 kg/m、合并食管裂孔疝、社会支持度评分<20分、术后下床时间>48 h为胃食管反流病患者EART术后并发胃肠道功能障碍高危因素。结论 胃食管反流病行EART手术治疗的患者术后并发为肠道功能障碍影响因素多,临床应加强患者心理情控制及术后干预以改善其并发胃肠道功能紊乱。
[关键词] 胃食管反流病;内镜下抗反流手术;术后胃肠道功能障碍;相关因素;危险因素;预防对策
[中图分类号] R656 [文献标识码] B [文章编号] 1673-9701(2022)14-0184-05
Influencing factors of the complication of gastrointestinal dysfunction after anti-reflux surgery
ZHANG Lanlan LIANG Hongxia
Department of Gastrointestinal and Pancreatic Surgery, Zhejiang Provincial People′s Hospital, Hangzhou 310014, China
[Abstract] Objective To analyze the influencing factors of the complication of gastrointestinal dysfunction after anti-reflux surgery, and to explore the countermeasures to prevent gastrointestinal dysfunction after anti-reflux surgery. Methods The clinical data of 139 patients with gastroesophageal reflux disease (GERD)admitted to Zhejiang Provincial People′s Hospital to undergo endoscopic anti-reflux therapy (EART) were retrospectively analyzed. A total of 84 patients without postoperative gastrointestinal dysfunction were set as the control group, and 54 patients with postoperative gastrointestinal dysfunction were set as the observation group. The demographic data, disease data, treatment and nursing data of the two groups of patients were sorted and classified, univariate analysis was performed, and multivariate logistic analysis was performed on the factors with statistically significant differences.. Results ①A total of 54 cases of patients with GERD undergoing EART had postoperative gastrointestinal dysfunction mainly featured by constipation,followed byabdominal distension and diarrhea. ②According to the univariate analysis, there were statistically significant differences between the two groups of patients in age, body mass index (BMI), preoperative heartburn symptom score, preoperative pantothenic acid symptom score, preoperative hypertension, complications of esophageal hiatal hernia, preoperative sensitivity to proton pump inhibitors (PPI), social support score, Hamilton anxiety score, Hamilton depression score, preoperative LSP, UESP, seniority of surgeon, and postoperative out-of-bed time (P<0.05). ③Multivariate logistic analysis showed that BMI >24 kg/m, complications of esophageal hiatal hernia, social support score <20 points, postoperative out-of-bed time >48 h were high risk factors for gastrointestinal dysfunction in patients with GERD after EART. Conclusion There are many influencing factors of the postoperative complication of intestinal dysfunction for patients with GERD undergoing EART surgery. The clinical psychological control for patients and postoperative intervention should be strengthened to improve their complication of gastrointestinal dysfunction.
[Key words] Gastroesophageal reflux disease; Endoscopic anti-reflux therapy; Postoperative gastrointestinal dysfunction; Related factors; Risk factors; Preventive measures
胃食管反流病(gastroesophageal reflux disease,GERD)是指胃内容物反流到食管甚至咽喉部及口腔而导致的烧心、反流、胸痛、上腹痛、上腹部灼烧感、嗳气、咽喉异物感等一系列临床症状的一组疾病。目前临床治疗GERD的有效手段为手术[1]。内镜下抗反流手术(endoscopic anti-reflux therapy,EART)是首选手术方案。EART术创伤小、患者疼痛感较轻、术后恢复快并发症少,临床数据显示其缓解患者临床症状率高达90%以上。但患者术后并发胃肠道功能障碍率高,严重者可能导致患者营养不良、免疫功能下降、延长住院时间、增大后续治疗的成本、患者痛苦感受及对EART手术的不良体验[2-3]。如何制订GERD患者EART术后胃肠道功能障碍早期识别系统[4-5],并在现有护理路径中适当增加延续性护理内容,提升防治效果,是临床面临的重要课题[6]。本方案对影响患者术后胃肠道功能紊乱的因素进行分析,为延续性护理方案完善提供参考,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2017年2月至2019年1月在浙江省人民医院行EART治疗的138例胃食管反流患者的临床资料,根据其术后是否发生胃肠道功能紊乱将其分为两组,未发生胃肠道功能的84例患者设为对照组,术后发生胃肠道功能紊乱的54例患者设置为观察组。纳入标准:①所有患者均符合GERD诊断标准[7],年龄18~65岁,性别不限;②均符合EART手术指征并顺利完成手术治疗;③均随访观察至术后至少1个月,方案所需调查资料收集完整。排除标准:①术前合并有其它胃腸道功能障碍疾病者如癔球症、心理性呕吐、神经性嗳气、神经性厌食、肠易激综合征等可能影响术后胃肠道功能障碍判断者;②合并其它胃肠道严重疾病者如结直肠癌者;③认知功能障碍者、既往有精神病史者,无法正确反馈胃肠道功能障碍临床表现者;④调查资料未收集完整者。
1.2 方法
①对两组患者的人口学资料、疾病资料、治疗护理资料进行整理分类,并行单因素分析,总结可能影响患者术后并发胃肠道功能紊乱的相关影响因素,将差异有统计学意义的因素纳入到多因素logistic系统行高危影响因素分析,总结可能影响胃食管反流患者EART术后并发胃肠道功能紊乱的高危因素。②制订GERD患者EART术后发生胃肠道功能障碍相关影响因素调查方案。以“GERD”“EART”“胃肠道功能障碍”等为关键词,查询万方、知网、维普、Pumbed等学术期刊,对收集到的文献进行整理分析,找出相关文献中与GERD患者EART术后发生胃肠道功能障碍相关的内容,结合临床实际工作经验,制订可能影响术后胃肠道功能障碍的因素调查方案:姓名、性别、年龄、学历、职业、体质量指数(BMI)、家庭经济收入、术前烧心症状评分、术前泛酸症状评分、术前血压、合并食管裂孔疝、术前对PPI药物反应情况、社会因素(社会支持度评分、汉密尔顿焦虑评分、汉密尔顿抑郁评分)、术前食道测压参数(LSP、UESP、LES残余压、LES长度)、手术医师年资、手术时间、术后下床时间、术后排气时间、术后进食时间、术后住院时间等。对上述因素根据其对术后胃肠道功能影响的危险程度赋值。见表1。
1.3 观察指标及评价标准
1.3.1 术后胃肠道功能障碍判断方法 所用患者均于术后3 d、术后5 d由主治医师及护士查房时询问排气、进食、排便、胃肠道感受等情况,并根据患者是否出现上述临床表现判断是否出现胃肠道功能障碍,术后1个月患者随访时了解患者胃肠道功能情况,或者当患者出院后出现胃肠胀气、腹泻、便秘等临床症状时回院随访。上述时间点患者若出现胃肠胀气、腹泻、便秘则判断为术后胃肠道功能障碍[8]。
1.3.2 BMI计算公式 患者清晨空腹称重记录,测量患者身高,BMI指数(kg/m)=体质量(kg)/身高2(m2)。
1.3.3 术前烧心症状评分、术前泛酸症状评分 参照《中药新药临床研究指导原则》[8]中的中医症候症状评分标准制订烧心、泛酸症状评分,根据严重程度将其分为0、2、4、6、8、10分,最高分10分,得分越高说明症状越严重。
1.3.4 社会支持度评分(SS) 该量表包括3个维度共10个条目,包括客观支持(1~22分),主观支持(4~16分)和对支持的利用度(3~12分)3个分量表,总得分和各分量表得分越高,说明社会支持程度越好。
1.3.5 汉密尔顿焦虑评分(HAMA)、汉密尔顿抑郁评分(HAMD) HAMD测评:由两名经过培训的医师对孕妇入组时、临产时进行HAMA及HAMD测评,两位测评医师共同与被调查者交谈并观察其过去一周的情绪情况,按照测评表的项目逐一了解测评,各自独立评分,所有项目采用0~4分的5级评分法,各级的标准为:0级:无症状;1级:轻;2级:中等;3级:重;4级:极重。测评结束后,两位医师的总评分差异不超过5%则取两位测评结果的均值作为报告值。HAMA总分超过14分为焦虑,HAMD总分超过17分为抑郁。
1.4 统计学方法
对文中所得数据采用SPSS 21.2统计学软件处理,计数资料以[n(%)]表示,采用χ检验,然后将具有差异性的因素纳入多因素logistic并分析,P<0.05为差异有统计学意义。
2 结果
2.1 GERD患者EART术后胃肠道功能障碍临床表现
54 例胃食管反流EART患者术后并发胃肠道功能紊乱以便秘症状为主,其次为腹胀、腹泻。
2.2 可能影响GERD患者EART术后胃肠道功能障碍相关因素分析
经单因素分析,GERD患者EART术后并发胃肠道功能障碍的相关因素有:年龄、BMI、术前烧心症状评分、术前泛酸症状评分、术前高血压、合并食管裂孔疝、术前对PPI药物敏感、社会支持度评分、汉密尔顿焦虑评分、汉密尔顿抑郁评分、术前LSP、UESP、手术医师年资、术后下床时间(P<0.05)。见表2。
2.3 可能影响GERD患者EART术后胃肠道功能障碍多因素logistic分析
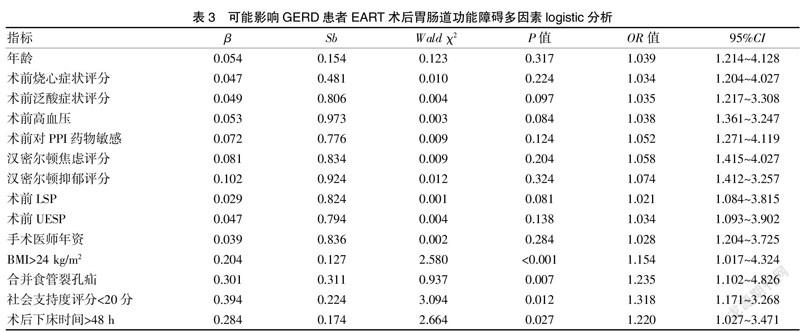
经多因素logistic分析显示,BMI>24 kg/m、合并食管裂孔疝、社会支持度评分<20分、术后下床时间>48 h为GERD患者EART术后并发胃肠道功能障碍的高危因素。见表3。
3 讨论
GERD在我国的发病率约在5%左右,近年来,世界范围内胃食管发病率均呈上升趋势。GERD是由于食管和胃交界处的下食管括约肌、膈肌及其附近肌束所形成的的高压带所形成的的反流屏障找到破坏而致病。患者大多数在术后3~5 d出现上述胃肠道功能障碍症状,但此阶段已接近EART术后康复的尾声阶段,若无特殊的情况出现,大部分患者已停止治疗与护理措施。使得医护人员、患者对早期的胃肠道功能障碍未引起足够的重视而使症状持续进展,GERD患者烧心、反流及其它症状使得患者长期处于不适状态,影响其心理情绪及生活质量[8-9]。目前临床治疗GERD患者的方法以药物和手术为主,大多数患者首先采用PPI制剂治疗,约30%的患者对PPI制剂不敏感或者不耐受或未能严格遵医治疗导致疗效较差。部分患者长期使用PPI制剂也存在不同程度的毒副作用,因此手术方法是很多长期药物治疗好GERD患者及上述药物治疗疗效较差的患者的选择[10]。手术治疗分为内镜EART和外科抗反流手术,其中腹腔镜下抗反流术(EART)由于创伤小、术后恢复快、患者身心及经济负担小儿广受患者青睐。但由于EART手术后胃肠道功能障碍成为EART手术难以客服的难题[11]。术后胃肠道功能障碍严重者出现进食困难,腹泻腹痛,胀气等,轻则延长患者术后康复时间,重者可能造成营养不良、免疫力低下,是严重影响患者术后康复效率和质量的并发症。目前临床对于EART术后胃肠道功能障碍的形成原因、解决方法研究较少[12-13]。在常规护理基础上实施延续性护理,增加术后胃肠道功能障碍发生风险评估、相关症状观察等措施,以期早期发现、早治疗,提高患者术后康复。上述措施的基础是明确临床可能导致患者术后胃肠道功能障碍的相关因素及危险因素[14]。基于此,本方案对浙江省人民医院近年来实施EART术治疗的GERD临床资料进行回顾性分析,并根据结果制订延续性护理方案,对比分析其对GERD患者EART术后胃肠道功能障碍的早期发现、临床症状恢复时间及其它并发症的影响进行对比分析。
结果显示,GERD患者EART患者术后并发胃肠道功能紊乱以便秘症状为主,其次为腹胀、腹泻。经单因素分析,GERD患者EART术后并发胃肠道功能障碍的相关因素有:年龄、BMI、术前烧心症状评分、术前泛酸症状评分、术前高血压、合并食管裂孔疝、术前对PPI药物敏感、社会支持度评分、汉密尔顿焦虑评分、汉密尔顿抑郁评分、术前LSP、UESP、手术医师年资、术后下床时间;经多因素logistic分析显示,BMI>24 kg/m2、合并食管裂孔疝、社会支持度评分<20分、术后下床时间>48 h为GERD患者EART术后并发胃肠道功能障碍的高危因素。上述结果提示临床,对于GERD患者在实施EART手术前应对其进行全面的身心及疾病评估,了解其可能发生术后胃肠道功能的风险,根据风险程度,制定延续性护理方案,风险高者应强化患者术后并发症相关知识健康宣教,使患者重视,及时反应术后胃肠道恢复进度,常规恢复期内尚未恢复者或者术后出现明显的腹胀、腹痛、腹泻、便秘等臨床症状者应及时与医护人员沟通,以便及早采取措施予以改善[15-16]。医护人员在对术后胃肠道功能障碍高风险者应强化相关指标观察,并针对患者存在的风险因素进行针对性的护理措施,如强化心理干预,发动患者家属力所能及为患者提供温馨的亲情环境,鼓励患者积极乐观面对疾病,提升患者的社会支持度感受[17]。缓解患者的负性情绪,术后配合医护人员及早协助患者下床活动等,提升患者术后胃肠道功能恢复效率和质量,降低胃肠道功能障碍风险[18]。
综上所述,GERD行EART手术治疗的患者术后并发为肠道功能障碍的相关影响因素多,提示临床可加强患者心理情控制及术后干预改善其并发胃肠道功能紊乱。
[参考文献]
[1] 陈嘉伟,范志宁.抗反流手术在治疗胃食管反流疾病中的应用[J].医学研究生学报,2019,32(6):580-585.
[2] 贺德志,王小彤,刘冰熔,等.抗反流黏膜切除术治疗胃食管反流病的临床疗效观察[J].中华消化内镜杂志,2019, 36(9):682-685.
[3] 吴继敏.胃食管反流病外科治疗相关问题探讨[J].临床荟萃,2017,32(1):28-32.
[4] 王乔.近端胃切除后食管-管形胃前壁吻合对患者生存质量的影响及抗反流效果的机制研究[D].西安:空军军医大学,2018.
[5] 王方平,刘纪炎,严富国,等.腹腔镜抗反流手术在基层医院的应用[J].中国内镜杂志,2018,24(11):28-31.
[6] 魏舒纯,姜柳琴,李璇,等.内镜下抗反流黏膜切除术治疗难治性胃食管反流病的临床价值初探[J].中华消化杂志,2019,39(11):774-777.
[7] 中華医学会消化病学分会.2014年中国胃食管反流病专家共识意见[J].中华消化杂志,2014,10:649-661.
[8] 郑筱萸.中药新药临床研究指导原则[M].北京:中国医药科技出版社,2002.
[9] ; 王新波,刘斌,罗冰清,等.顽固性复杂胃食管反流腹腔镜手术治疗效果评价[J].临床误诊误治,2018,31(3):35-38.
[10] 吴继敏,陈冬.胃食管反流病外科治疗术式的演变和展望[J].中华外科杂志,2020,58(9):677-682.
[11] 麦麦提艾力·麦麦提明,阿力木江·麦斯依提,陈建德,等.迷走神经完整性对抗反流手术的影响[J].中华胃食管反流病电子杂志,2019,6(4):216-218.
[12] 王志斌,王凯斌,贺伯伟,等.食管贲门癌不同吻合方法对胃食管反流作用的影响[J].贵州医药,2020,44(1):41-42.
[13] 岳斌.LINX抗反流系统治疗胃食管反流病的研究进展[J].中国临床新医学,2019,12(8):929-932.
[14] 胡志伟,李侁,汪忠镐,等.腹腔镜Nissen胃底折叠术对胃食管反流病患者食管动力学的影响[J].中华疝和腹壁外科杂志(电子版),2018,12(2):99-104.
[15] 于涛,于磊,张葆勋,等.腹腔镜Ⅴ型胃底折叠术治疗食管裂孔疝合并胃食管反流病[J].中国医师杂志,2020, 22(6):857-860,865.
[16] 刘培培,王洛伟.胃食管反流病的最新治疗进展[J].中华消化内镜杂志,2018,35(12):950-954.
[17] 柳笛,王洪涛,李怡,等.Stretta微量射频和腹腔镜Nissen胃底折叠术治疗胃食管反流病的疗效比较[J].中国实用医刊,2018,45(6):15-19.
[18] 龚万军,田铭,邱红根,等.腹腔镜下胃底折叠术不同术式治疗胃食管反流病的效果比较[J].现代仪器与医疗,2018,24(4):36-38.
[19] 刘佳.腹腔镜抗反流手术治疗胃食管反流病的临床效果回顾及影响因素分析[D].上海:海军军医大学,2018.
[20] 李航宇.腹腔镜手术治疗胃食管反流病的临床效果及分析[D].大连:大连医科大学,2019.
(收稿日期:2020-12-25)

