四重逆转录重组酶聚合酶等温扩增技术快速联检四种难鉴别蚊媒病毒的效果观察
韩明月 林源吉 吴新新 魏晨星 董学妍 王晓明 万海同 余道军
蚊虫是地球上对人类健康危害最为严重的动物之一,作为疾病的传播媒介可引起多种蚊媒传染病[1]。流行于亚洲、非洲及南美洲地区的登革热[2]、寨卡、基孔肯雅热、黄热病[3]等蚊媒传染病在我国亦时有发生,这4种典型蚊媒传染病临床症状相似,均可表现为发热、头痛、肌肉疼痛、厌食、乏力等[4],给临床诊断和鉴别诊断带来一定困难。因此对蚊媒传染病中登革病毒(dengue fever virus,DENV)、黄热病毒(yellow fever virus,YFV)、基孔肯雅病毒(chikungunya virus,CHIKV)、寨卡病毒(Zika virus,ZIKV)4种临床难鉴定病原体进行快速联合检测及鉴别诊断意义重大。近年来,除了传统的诊断方法,如血清学、病毒分离培养等外,分子生物学方法在病毒性疾病的诊断中得到了广泛应用,常见的分子生物学方法主要有聚合酶链式反应(polymerase chain reaction,PCR)、核酸分子杂交、DNA测序、等温扩增技术等,近年来等温扩增技术因其简便、快速、精确、低成本的优势,在分子生物学诊断技术中越来越重要[5-10],重组酶聚合酶扩增(recombinase polymerase amplification,RPA)技术是一种建立较晚的等温扩增方法,被认为是一种可以替代PCR的技术[11-12]。目前,基于等温扩增技术同时检测多种蚊媒病毒的研究报道较为少见[13-14]。本研究以登革热、黄热病、基孔肯雅热、寨卡的病原体为研究对象,基于RPA技术实现4种典型输入性蚊媒病毒联合检测[15-17],建立针对DENV、YFV、CHIKV、ZIKV的四重逆转录重组酶聚合酶扩增(quadruple reverse transcription-recombinase polymerase amplification,RT-RPA)检测方法,旨在加快检测速度,提高检测灵敏度、特异度和准确度,现将结果报道如下。
1 材料和方法
1.1 样本、仪器和试剂 本研究使用的临床血清样本均由杭州市疾病预防控制中心提供,包含DENV-1型5例、DENV-2型 5例、DENV-3型5例、DENV-5型5例,所有标本均由杭州市疾病预防控制中心确认为DENV阳性。含有DENV、YFV、CHIKV和ZIKV靶基因的质粒DNA标准品和体外合成RNA样本由杭州邦唯生物科技有限公司合成。ABI 7500实时荧光定量PCR仪(型号:7500)购自美国 ABI公司,TwistAmp Liquid Exo Kit(批号:153689)购自英国TwistDX公司,WarmStart RTx(批号:M0380L)购自美国NEB公司。所有引物和探针均由上海生工生物工程股份有限公司合成。本研究经杭州市第一人民医院医学伦理委员会审查通过(批准文号:KY-20211105-0083-01)。
1.2 方法
1.2.1 引物及探针设计 在NCBI上检索DENV、YFV、CHIKV、ZIKV的基因序列,应用Clustalw软件对所有序列比对分析,选取各自同源性高的保守序列,根据TwistAmpRDNA Amplification Kits Assay Design Manual进行引物和探针设计,作为待检靶基因特异性核酸序列的引物和探针,登录NCBI通过BLAST程序比对分析,每种病毒设计3对不同的引物和相应的特异探针,见表1。

表1 引物和探针序列
1.2.2 单重RT-RPA体系建立及引物筛选 50 μl RT-RPA 反应体系包括:2×反应缓冲液 25 μl,dNTPs 5 μl,10×Probe E-mix 5 μl,正向引物 F(10 μmol/L)2.1 μl,反向引物 R(10 μmol/L)2.1 μl,探针(10 μmol/L)0.6 μl,20× Core Reaction Mix 2.5 μl,50×Exo(每个反应)1 μl,WarmStart RTx 1 μl(当模板为RNA时加入),MgOAc(280 mmol/L)2.5μl,模板1 μl(质粒标准品DNA或体外合成RNA),ddH2O补至50 μl。反应条件:40 ℃,30 min。采用上述建立的反应体系对DENV、YFV、CHIKV及ZIKV的引物进行筛选,DENV、YFV及ZIKV的引物有9种不同的排列组合方式,CHIKV的引物有6种不同的排列组合方式(预实验显示R1不适用),根据荧光信号和扩增曲线的变化确定最合适的引物组合。
1.2.3 四重RT-RPA体系的建立 在上述建立的RT-RPA体系基础上建立四重RT-RPA体系,通过正交设计对四重RT-RPA体系进行了优化,包括引物浓度、反应温度、Mg2+浓度、Core Reaction Mix浓度和 50×Exo浓度、10×Probe E-mix浓度、探针浓度、模板浓度,每个因素设置高低不同的4个水平,所有因素分成3组进行正交实验,根据统计分析结果及荧光信号和扩增曲线的变化确定最佳反应条件和最合适的反应体系(WarmStart RTx按照试剂说明书加入1 μl后,四重RT-RPA荧光信号强、扩增曲线良好,故WarmStart RTx用量未做优化)。
1.2.4 单重及四重RT-RPA的特异度、灵敏度试验将已知拷贝数的含DENV、YFV、CHIKV、ZIKV目的扩增片段的质粒标准品或体外合成RNA进行连续10倍倍比稀释至浓度在 1×101~1×108Copies/ml作为单重RT-RPA 的模板;将 DENV、YFV、CHIKV、ZIKV 质粒标准品或体外合成RNA按1∶1∶1∶1混合后进行10倍倍比稀释成 1×101~1×108Copies/ml,作为四重 RT-RPA的模板。取不同载量的模板1 μl(质粒标准品或体外合成RNA),用灭菌注射用水做对照实验,按照上述确立的反应体系和扩增条件对各稀释度模板进行单重及四重RT-RPA检测,所有检测标本至少检测3次,确定该方法的检测灵敏度。同时应用上述建立的4种病毒各自的单重及四重反应体系及反应条件,以临床巨细胞病毒、EB病毒、HBV、丙型肝炎病毒、流感病毒、呼吸道合胞病毒核酸及DENV、YFV、CHIKV、ZIKV病毒质粒标准品或体外合成RNA为模板,同时设置阴性对照和空白对照,对上述建立的单重及四重RTRPA反应体系的特异度进行验证。
1.2.5 四重RT-RPA的重复性试验 将已知拷贝数的DENV、YFV、CHIKV、ZIKV质粒标准品混合液或体外合成RNA混合液(1×105Copies/ml)平均分成10份,-20℃冷冻保存作为模板,按上述实验建立的四重RT-RPA反应体系和扩增条件进行扩增,最后分析检测结果[阈值时间(threshold time,TT)]的重复性,以变异系数(coefficient of variation,CV)表示[19]。
1.2.6 临床标本验证 取经RT-PCR确认的临床确诊登革热患者的20份血清样本和30份阴性血清样本,使用单重RT-RPA及四重RT-RPA方法对标本进行检测,并与临床实验室在用的实时荧光RT-PCR方法的检测结果相比较,进一步验证该方法的可靠性。
1.3 统计学处理 采用 SPSS 18.0统计软件,计量资料以表示,组间比较采用两独立样本t检验,计数资料组间比较采用χ2检验;采用方差分析计算反应体系优化结果;计算单重RT-RPA和四重RT-RPA与RT-PCR法的诊断灵敏度、特异度、阳性预测值(positive predictive value,PPV)和阴性预测值(negative predictive value,NPV)。
2 结果
2.1 引物筛选结果 根据单重RT-RPA的扩增曲线,DENV、YFV、CHIKV和ZIKV的最佳引物组合分别为:DENV-F2/DENV-R1,YFV-F2/YFV-R3,CHIKV-F2/CHIKV-R3和 ZIKV-F2/ZIKV-R1。
2.2 四重RT-RPA反应体系优化结果
2.2.1 引物加入量的优化结果 DENV引物加入量的不同对四重RT-RPA扩增结果的影响不同(FDENV=9.976,P<0.05),而 YFV、CHIKV、ZIKV 引物加入量的不同对四重RT-RPA扩增结果的影响不明显(FYFV=0.431、FCHIKV=0.416、FZIKV=1.644,均 P >0.05)。
2.2.2 反应温度、Mg2+浓度、Core Reaction Mix及50×Exo加入量的优化结果 DENV、YFV、CHIKV、ZIKV不同反应温度、Mg2+浓度、Core Reaction Mix 及 50×Exo加入量对四重RT-RPA扩增结果TT值的影响不同(FDENV=4.883、FYFV=6.873、FCHIKV=20.746、FZIKV=15.293,均P<0.05)。
2.2.3 核酸模板量、10×Probe E-mix加入量及探针浓度的优化结果 核酸模板量、10×Probe E-mix加入量、探针浓度对四重RT-RPA扩增结果TT的影响不明显(F=1.083、3.453、1.191,均 P >0.05)。
2.2.4 确定四重RT-RPA反应体系 结合2.2.1至2.2.3的结果,确定最终的60 μl的四重RT-RPA反应体系:2×反应缓冲液 25 μl,dNTPs 4.8 μl,10× Probe E-mix 5 μl,正向引物 F(10 μmol/L)2.1 μl,反向引物R(10 μmol/L)2.1 μl,探针(10 μmol/L)0.6 μl,20×Core Reaction Mix 2.5 μl,50×Exo 1.5 μl,WarmStart RTx 1 μl(当模板为 RNA 时加入),MgOAc(280 mmol/L)3.0 μl,模板 1 μl,ddH2O 补至 60 μl;反应条件:42 ℃,30 min。
2.3 单重及四重RT-RPA的特异度 DENV、YFV、CHIKV、ZIKV之间以及与其他多种常见病毒之间不存在交叉反应,只有DENV、YFV、CHIKV和ZIKV产生了阳性扩增曲线,且扩增曲线较为平滑。巨细胞病毒、EB病毒、HBV、丙型肝炎病毒、流感病毒、呼吸道合胞病毒等均未产生阳性扩增曲线,呈阴性反应,见图1-2。
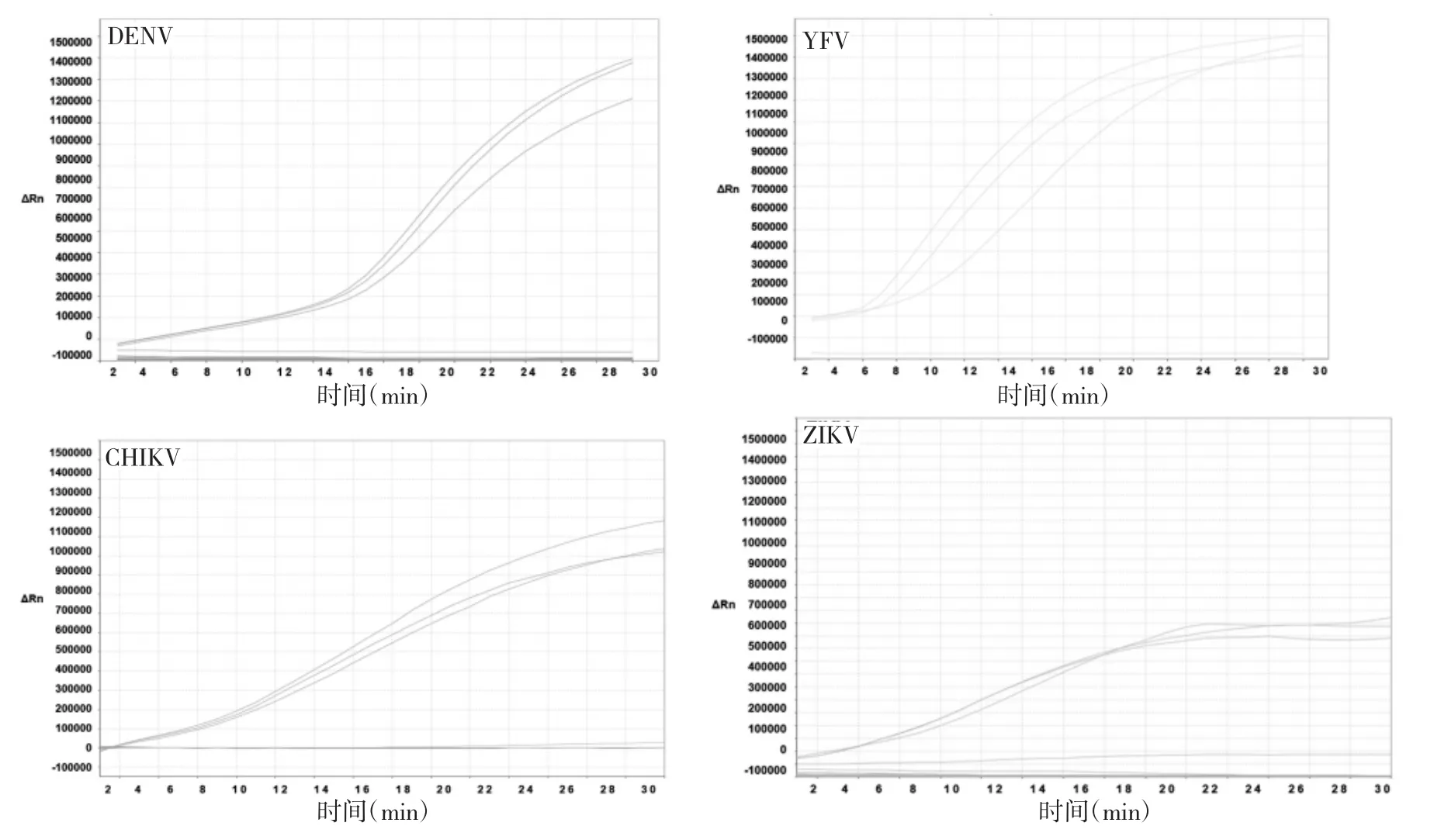
图1 单重RT-RPA特异性试验图

图2 四重RT-RPA特异性试验图(a、b、c、d分别为四重RT-RPA仅加入DENV、YFV、CHIKV、ZIKV中的一种时的特异性试验图;e为四重RT-RPA同时加入DENV、YFV、CHIKV、ZIKV时的特异性试验图)
2.4 单重及四重RT-RPA的灵敏度 RT-RPA对DENV、ZIKV、CHIKV 质粒标准品的检出限分别为 1×102、1×102、1×102Copies/ml,对YFV质粒标准品的检出限<1×102Copies/ml,对 DENV、YFV、CHIKV 和 ZIKV 体外合成 RNA 的检出限分别为 1×102、1×102、1×102、1×102Copies/ml,见图 3-4;四重RT-RPA对DENV、YFV、CHIKV和ZIKV质粒标准品的检出限分别为1×102、1×102、1×102、1×102Copies/ml,对体外合成 RNA 标本的检出限分别为 5×102、5×102、5×102、5×102Copies/ml,见图5-6。
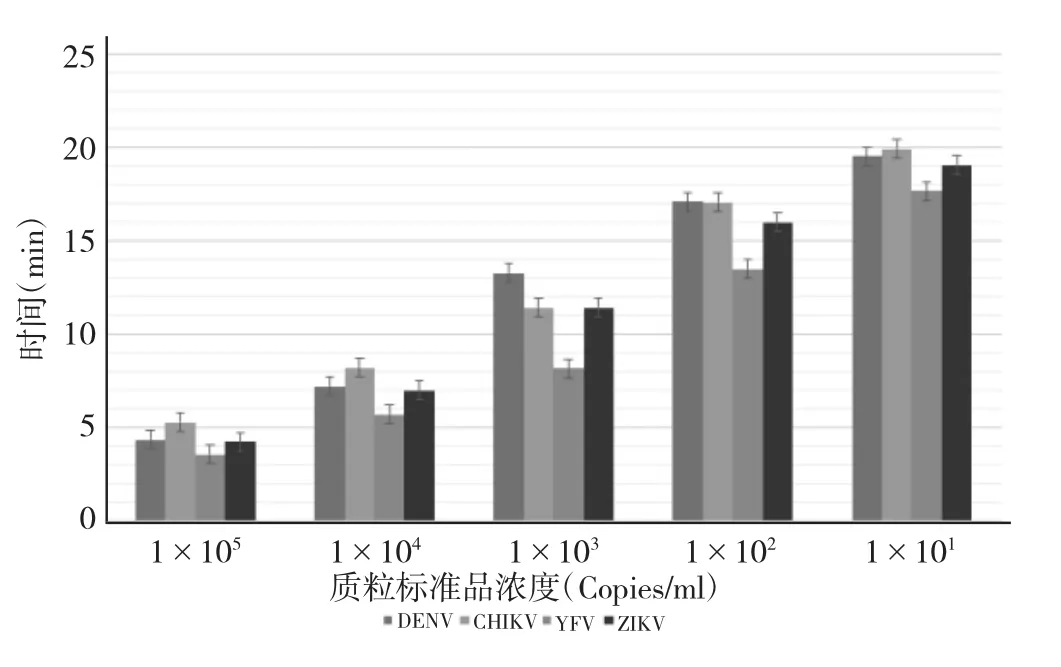
图3 单重RT-RPA检测质粒标准品灵敏度试验
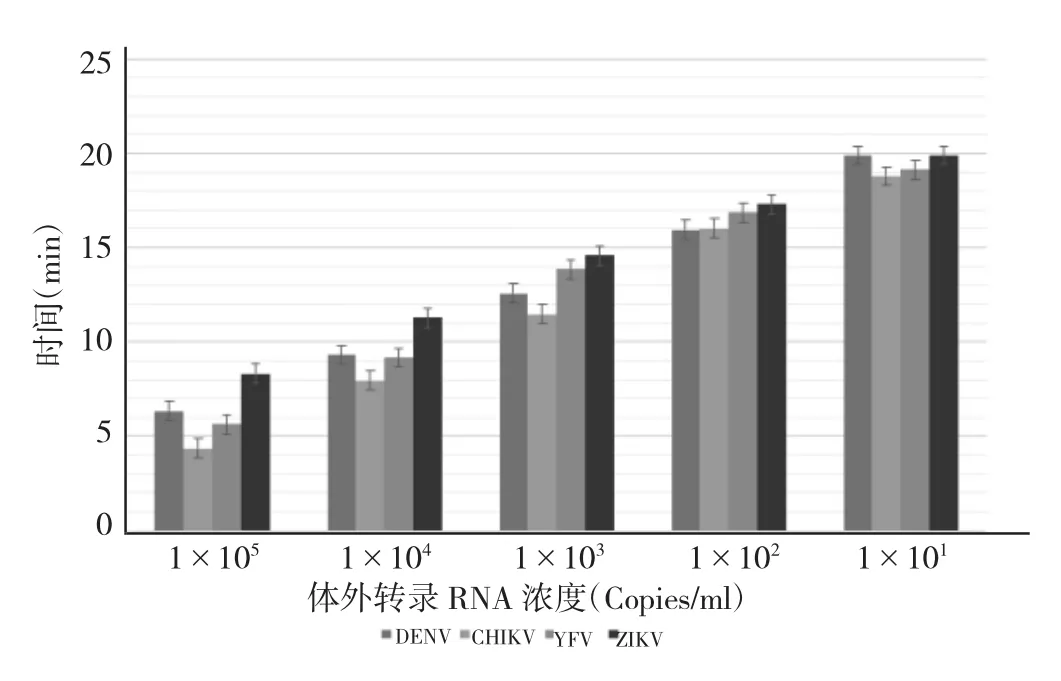
图4 单重RT-RPA检测体外转录RNA灵敏度试验

图5 四重RT-RPA检测质粒标准品灵敏度试验

图6 四重RT-RPA检测体外转录RNA灵敏度试验
2.5 四重RT-RPA的重复性验证结果 RT-RPA法TT值的CV为1.76%~5.96%,见表2。

表2 四重RT-RPA的重复性验证结果
2.6 临床标本验证结果 50份血清样本中,RT-PCR及单重RT-RPA法将20份DENV阳性样本全部检出,阳性标本检出率均为100.00%,四重RT-RPA检测DENV阳性19份,阳性标本检出率为95.00%,经统计学分析,单重RT-RPA、四重RT-RPA、RT-PCR对DENV检出率差异无统计学意义(P>0.05),见表3。
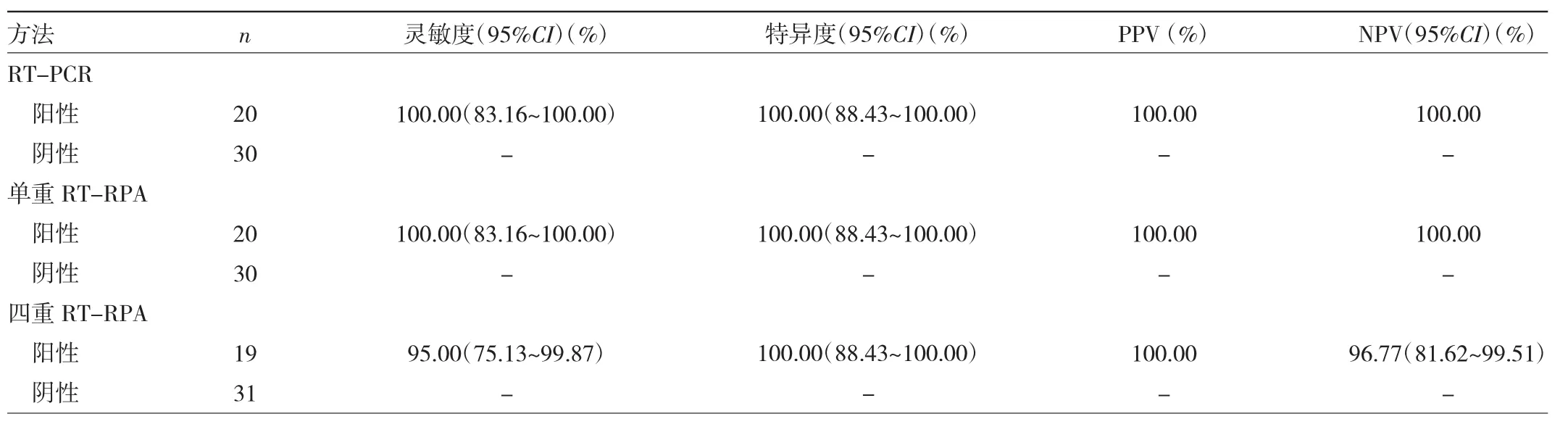
表3 DENV临床标本不同检测方法的灵敏度、特异度、PPV和NPV比较
3 讨论
本研究开发了一种四重RT-RPA方法,该方法在单个反应中包含4对引物和相应的探针,用于单独或同时检测4种蚊媒病毒,通过对DENV、YFV、CHIKV和ZIKV基因的检索及序列比对,选择相对保守的区域进行了引物和探针的设计,为了获得最佳的扩增效果,本研究中使用的引物长度均为32~34 bp,并通过对不同引物组合方式的筛选实验为每种病毒选择了最佳的引物组合。
本研究采用正交设计对反应体系(包括反应温度、Mg2+浓度和50×Exo加入量等)进行了优化。合适的反应温度是实验成功的关键因素之一,RPA技术的推荐反应温度为37~42℃,以往的研究表明,RPA可以在15~50℃进行[20]。较高的反应温度可以避免非特异性扩增的产生,因此对于四重RT-RPA,较高的反应温度更适合,于是本研究在38、40、42℃进行了四重RT-RPA,并最终确定四重RT-RPA的最佳反应温度为42℃。Mg2+可以与dNTPs和核酸骨架相互作用,影响聚合酶分子生物学检测技术的活性,因此Mg2+的浓度对扩增效率有很大影响,Mg2+浓度过高会降低扩增的特异度,Mg2+浓度过低会影响扩增的产物获得率。同样,单重及四重RT-RPA反应中也需要加入Mg2+,且Mg2+加入后RT-RPA反应立即开始,经过上述的正交实验,单重RT-RPA中加入MgOAc 14 mmol/L或四重RT-RPA中加入16.8 mmol/L时,反应结果最佳。在单重及四重RT-RPA反应体系中,逆转录酶对扩增效率较为关键,因此,本研究根据文献报道[21-22],选择逆转录效果较好的WarmStart RTx作为逆转录酶,研究结果表明,该酶逆转录效果好,在实际说明书推荐的用量(1 μl)情况下即能满足实验要求,故未对该酶用量进行优化实验。
本研究团队开发的单重RT-RPA方法和四重RT-RPA方法具有较高的灵敏度、特异度和重复性。实验表明,该单重及四重RT-RPA法不与其他常见病毒发生交叉反应,且可以在背景核酸存在的情况下扩增靶核酸,但背景核酸的存在对扩增的灵敏度有一定的影响,背景核酸浓度越高,检测的灵敏度越低。研究表明,RPA反应体系中所用引物、探针和靶序列的选择会影响其自身对背景核酸的耐受性[23]。在该四重RTRPA体系中,共有4对引物和4个探针,引物之间可以形成二聚体,但由于本研究中使用了探针法,二聚体的形成对扩增信号没有显著影响,但引物和探针数量的增加可能导致交叉反应或竞争性扩增,影响部分引物的扩增效率,本研究结果也表明引物探针用量对四重RT-RPA影响不明显,但在四重RT-RPA中,背景核酸的存在对扩增的灵敏度产生了一定影响,从而导致四重RT-RPA的灵敏度略低于单重RT-RPA。
本研究建立的针对DENV、YFV、CHIKV和ZIKV的单重RT-RPA和四重RT-RPA检测方法虽然具有良好的特异度、灵敏度和重复性。但也存在一定的不足,目前的工作仍然需要昂贵的实时荧光PCR仪器,因此本研究建立的检测方法目前尚不适合资源贫乏的地区,笔者团队正在尝试开发一种更便携的小型检测系统来满足这些要求。此外,由于引物之间的相互干扰以及背景核酸的存在,四重RT-RPA的检测灵敏度尚不理想。同时,由于目前传染病防控良好,临床标本不足,本研究仅验证了登革热临床血清标本,尚缺乏YFV、CHIKV和ZIKV的临床标本,只能以体外合成的RNA样本作为替代物来检验已建立的单重及四重RT-RPA的临床应用价值。虽然本研究存在以上的不足,但四重反应体系的应用前景是不可否认的,本研究可为其他新发再发传染病快速诊断及鉴别诊断方法的建立提供一定的方向。
——一道江苏高考题的奥秘解读和拓展

