实验探究铁和铝在浓硫酸中钝化行为
何翼 黎泓波 姜建文



摘要:对教材中所描述的铁和铝在浓硫酸中钝化后产生致密的氧化膜进行实证研究,发现铁和铝室温下在浓硫酸中钝化的产物分别为Al2O3、S、(少量H2)和FeSO4、S、(少量H2),并通过设计实验探究温度对铁和铝分别在浓硫酸中钝化的影响,探寻钝化的最佳温度。
关键词:铁;铝;浓硫酸;钝化;温度
文章编号:1008-0546(2022)06-0089-05
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2022.06.020
一、问题的提出
鲁科版高中化学必修一“硫”一章节中指出:“在常温下,浓硫酸与铁、铝接触时,会使表面生成一层致密的氧化膜而钝化,阻止了内部的金属继续与硫酸发生反应,因此,冷的浓硫酸可以用铁质或铝制的容器储存”[1]。通常,我们把由某些钝化剂(化学药品)所引起的的金属钝化现象就称为化学钝化。金属钝化后,电极电势向正极移动,使其失去了原有的特性,如钝化了的铁在铜盐中不能将铜单质置换出来[2]。近年来,陆陆续续有研究者对铝或铁的钝化进行研究,如:李俊生[3]对铝箔在浓硝酸或浓硫酸中的钝化机理以及钝化膜性质进行了深入的研究,并设计不同钝化时间下,以钝化后的铝片在硫酸铜溶液中置换出铜表面积作为指标,探寻铝在浓硫酸和浓硝酸中钝化最佳时间范围,但文中仅通过肉眼观察析出固体铜的表面积而得出钝化效果结论,存在不可控误差;王继璋、李高辉[4]通过用Fe、Al做原电池的电极材料,考察其在浓硫酸、浓硝酸中的钝化快慢。除此之外,诸佳丹、丁伟等人[5]以浓硝酸为电解质溶液,以铜、铝为电极,通过导线连接灵敏电流计构成原电池,通过观察灵敏电流计指针偏转方向的变化即电流反转现象,来表征铝的钝化行为,并通过控制浓硝酸浓度探寻铝在浓硝酸中钝化的临界浓度为7.5-8 mol/L;田博文、朱华英等人[6]通过对教学实验中异常现象揭示了铁钝化后并非形成氧化膜而是生成一层不溶于浓硫酸的FeS04,致使内层金属不能与酸持续反应,从而使反应停滞。
以上研究表明,金属铝和铁与浓硫酸以及浓硝酸钝化过程有所不同,且并非如教材中所描述仅仅形成氧化膜,那么金属铁和铝在浓硫酸中钝化的过程以及产物究竟是什么呢?它们的钝化过程是否相同?又是否会受到温度的影响呢?
基于上述研究,本文除了对铁的钝化膜进行实证之外,也对Fe和Al的具体钝化过程和产物进行探究。并在此基础上,探寻温度对其钝化的影响,以期能为广大教师在教学中更好地帮助学生理解钝化的本质提供帮助。
二、实验研究
1.金属Fe和Al在浓硫酸钝化产物的实证研究
(1)实验仪器及药品
实验仪器:J0409灵敏电流计(300 μA)、导线(鳄鱼夹-U型叉型)、具支U形管
实验药品:打磨后相同大小的铝片、铁片、铜片,浓硫酸(质量分数98%)、KSCN溶液、100-/0 H202溶液、蒸馏水、肥皂水、0.1 mol/L CuSO4溶液、去离子水
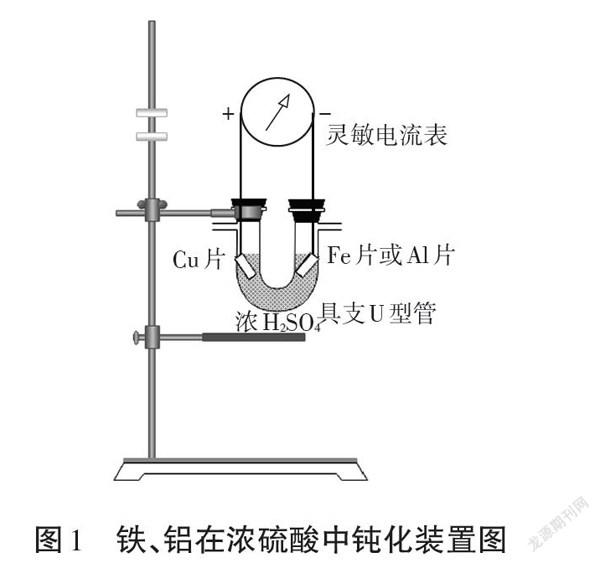
(2)装置设计
为了使实验过程中,是否完全钝化能够得到可视化表征,本实验通过搭建原电池装置,以金属铁片和铜片、金属铝片和铜片分别连接灵敏电流表构成原电池,由于室温下(4-11℃)铜与浓硫酸不发生反应,因此可通过判断电流表指针是否归零作为钝化终止判定依据。待钝化完全后,对钝化产物进行检测。
(3)实验过程
根据图1装置,进行实验,具体实验现象见表1。
(4)实验现象分析
见表2。
2.温度对金屬Fe和Al在浓硫酸钝化影响的研究
王继璋、李高辉[4]等人通过设计Fe-Al原电池,记录不同温度下通过记录检流计指针偏转方向及两极处的现象作为研究依据,主要从定性的角度判断不同温度下Fe和Al的反应活性。本文认为,探究温度对钝化效果的影响,可将完全钝化所需时间作为定量研究证据,并由此探寻Fe和Al在浓硫酸钝化的最佳温度。
(1)实验设计
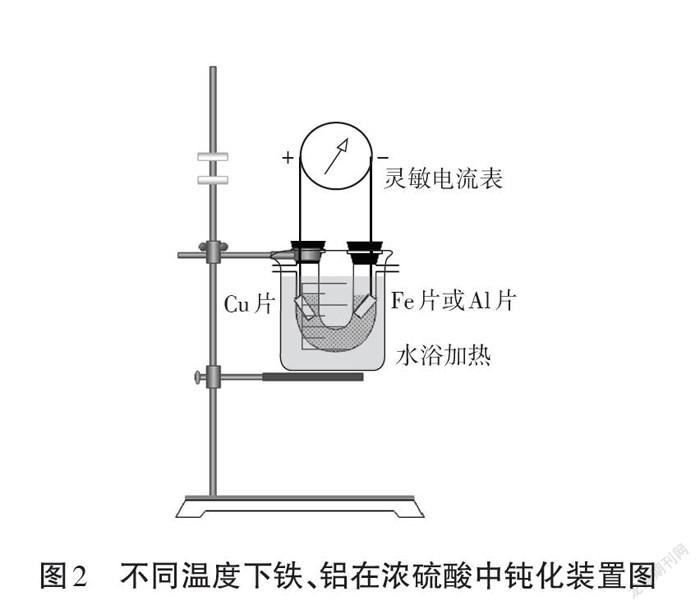
在图1装置中U型管下端添加250 mL烧杯提供水浴加热(或冰浴),如图2。由于水浴控温具有一定的滞后性,本文分别将温度控制在0-5、10-15、20-25、30-35、40-45、50-55、60-65℃之间,通过记录电流表指针从开始钝化至钝化结束偏回零点所需时间,来比较不同温度下铁和铝钝化的最佳条件。
(2)实验过程
(3)实验现象分析
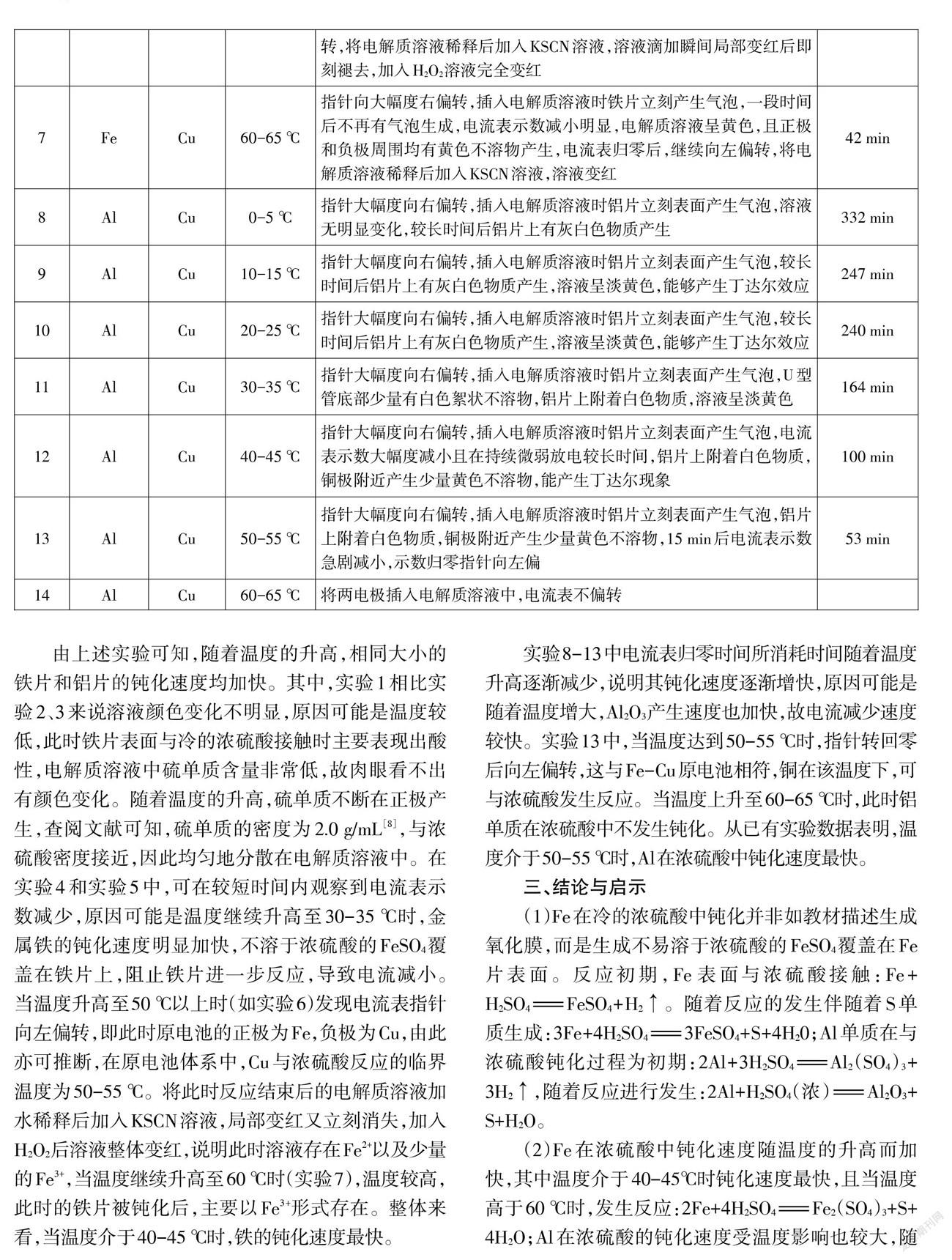
由上述实验可知,随着温度的升高,相同大小的铁片和铝片的钝化速度均加快。其中,实验1相比实验2、3来说溶液颜色变化不明显,原因可能是温度较低,此时铁片表面与冷的浓硫酸接触时主要表现出酸性,电解质溶液中硫单质含量非常低,故肉眼看不出有颜色变化。随着温度的升高,硫单质不断在正极产生,查阅文献可知,硫单质的密度为2.0 g/mL[8],与浓硫酸密度接近,因此均匀地分散在电解质溶液中。在实验4和实验5中,可在较短时间内观察到电流表示数减少,原因可能是温度继续升高至30-35℃时,金属铁的钝化速度明显加快,不溶于浓硫酸的FeS04覆盖在铁片上,阻止铁片进一步反应,导致电流减小。当温度升高至50℃以上时(如实验6)发现电流表指针向左偏转,即此时原电池的正极为Fe,负极为Cu,由此亦可推断,在原电池体系中,Cu与浓硫酸反应的临界温度为50-55℃。将此时反应结束后的电解质溶液加水稀释后加入KSCN溶液,局部变红又立刻消失,加入H2O2后溶液整体变红,说明此时溶液存在Fe2+以及少量的Fe3+,当温度继续升高至60℃时(实验7),温度较高,此时的铁片被钝化后,主要以Fe3+形式存在。整体来看,当温度介于40-45℃时,铁的钝化速度最快。
实验8-13中电流表归零时间所消耗时间随着温度升高逐渐减少,说明其钝化速度逐渐增快,原因可能是随着温度增大,Al2O3产生速度也加快,故电流减少速度较快。实验13中,当温度达到50-55℃时,指针转回零后向左偏转,这与Fe-Cu原电池相符,铜在该温度下,可与浓硫酸发生反应。当温度上升至60-65℃时,此时铝单质在浓硫酸中不发生钝化。从已有实验数据表明,温度介于50-55℃时,Al在浓硫酸中钝化速度最快。
三、结论与启示
(l)Fe在冷的浓硫酸中钝化并非如教材描述生成氧化膜,而是生成不易溶于浓硫酸的FeS04覆盖在Fe片表面。反应初期,Fe表面与浓硫酸接触:Fe+H2SO4==FeSO4+H2↑。随着反应的发生伴随着S单质生成:3Fe+4H2SO4=3FeSO4+S+4H2O;Al单质在与浓硫酸钝化过程为初期:2Al+3H2S04=Al2(S04)3+3H2↑,随着反应进行发生:2Al+H2SO4(浓)==Al2O3+S+H2O。
(2)Fe在浓硫酸中钝化速度随温度的升高而加快,其中温度介于40-45℃时钝化速度最快,且当温度高于60℃时,发生反应:2Fe+4H2SO4=Fe2(SO4)3+S+4H2O;Al在浓硫酸的钝化速度受温度影响也较大,随着温度升高钝化速度加快。
(3)实验证明被钝化的铁片仍然能够将CuS04中的Cu单质置换出來,主要原因是铁片钝化后表面覆盖的FeSO4能够溶于水中,导致铁片表面与溶液接触发生置换反应;而对于铝单质来说,铝表面的钝化膜在0.1 mol/L的CuS04能被破坏,一旦置换出铜单质能够迅速与铜单质形成Al-Cu原电池,加快Cu生成,是一个相对复杂的体系,因此,李俊生等人[3]在对Al的钝化效果进行研究时,单纯地通过铝片表面析出铜的量作为判断依据是不够严谨的。
参考文献
[1] 王磊,陈光巨.普通高中教科书化学必修第一册[M].济南:山东科学技术出版社,2019.
[2]林小驹,王桂杰.浅谈金属钝化的机理[J].化学教学,1993(2):34-35.
[3]李俊生.铝箔钝化机理以及钝化膜性质的研究[J].化学教育,2010,31(4):81-86.
[4]王继璋,李高辉,霍玉坚.探究铁和铝在浓硫酸和浓硝酸中的电化学行为[J].化学教育,2011,32(7):52-53.
[5]诸佳丹,丁伟.原电池法探究金属铝在浓硝酸中的钝化行为[J].化学教学,2017(9):59-62.
[6] 田博文,朱华英,刘怀乐,刘晓渝.实验探究铁被浓硫酸“钝化”的认识误区[J].化学教育(中文),2020,41(15):92-93.
[7]郭红霞.铝及铝合金化学氧化工艺[J].电镀与涂饰,2003(4):17-18.
[8] 范巧玲,姜雪峰.硫的发展与应用[J].化学教育(中英文),2019,40(1):2-6.

