开菲尔粒中微生物对苯并(α)芘的非靶向代谢组学 分析
古丽加马力·艾萨 邢军 李安 张瑞
(1. 新疆特殊环境物种保护与调控生物学实验室 新疆师范大学生命科学学院,乌鲁木齐 830054;2. 新疆大学生命科学与技术学院, 乌鲁木齐 830000)
开菲尔粒(Kerfir grains)是传统发酵乳制品——开菲尔(kefir)的发酵剂,其主要成分除黏性多糖(由半乳糖和葡萄糖构成)外,还有大量的水和少量蛋白、脂质等成分[1-2]。本研究团队前期研究表明新疆传统发酵剂开菲尔粒在属水平上的发酵优势细菌主要有乳酸杆菌属(Lactobacillus)、链球菌属(Streptococcus)、芽胞杆菌属(Bacillus)、乳球菌属(Lactococcus)、葡萄球菌属(Staphylococcus)和奈瑟氏菌属(Neisseria)等[3],微生物的相互适应和协同作用聚集成了复杂的菌相,使开菲尔粒形成了整体“战斗力”,能够抑制杂菌和致病菌的溢生,特有的黏多糖能够保护开菲尔粒不受外界微生物侵染[4-5],使其具有很强的环境适应能力和抗污染能力,因此开菲尔粒可以作为一个相对较为稳定的生物反应器[6-7]。开菲尔发酵乳制品具有较高的营养价值,含有消化性很高的乳蛋白质和乳脂肪。蛋白质中水溶性氮和氨基酸含量高,发酵过程中基本无损失;脂肪球能够充分乳化,更易消化吸收,游离脂肪酸和挥发性脂肪酸含量高,风味良好。另外开菲尔由于多种有益微生物菌相作用使产品的营养比原乳有了很大提高,且易于消化,成为具有丰富营养的保健食品[8-11]。
苯并(a)芘分子量较大,由5个苯环组成,结构稳定,难溶于水。环境和食品中的苯并(a)芘,虽然可以通过一些物理、化学方法降解和清除,但易带来二次污染,且成本较高,而生物降解是非常重要和有效的措施,具有经济、安全、方便的特点,其中最为关注的是微生物降解研究,并已取得了一定成绩[12-16]。有研究表明,能够降解苯并(a)芘的微生物,主要归属于分枝杆菌属(Mycobacterium)和假单胞菌属(Pseudomonas),它们大多来自被污染的水体、土壤、海洋及其沉积物[17-19]。Zhao等[20]研究了乳酸菌菌株对苯并(α)芘的结合能力发现, L. plantarum CICC 22135和 L. pentosus CICC 23163菌株的结合率分别为66.76%和64.31%。Zhang[21]等人发现了乳酸菌具有去除在淀粉基食品中苯并(α)芘的潜在能力。
新疆地区少数民族自古以来就有制作和食用发酵乳制品的习惯,经过几千年的驯化,这些传统发酵乳制品中保留了许多具有传代性好,抗逆性强,风味浓郁独特对人体健康有益的乳酸菌及其它微生物菌群[22-24]。本文针对传统发酵剂开菲尔粒中微生物对多环芳烃类化合物苯并(α)芘的作用机制这一问题,研究在苯并(α)芘胁迫作用下,开菲尔粒微生物在发酵乳中代谢产物发生的特征性变化,采用非靶向代谢组学技术[25-26],结合主成分分析和偏小二乘判别分析方法,寻找特征代谢产物,在KEGG数据库中注释特征代谢物参与可能的代谢途径,进而推导出开菲尔粒中微生物对苯并(α)芘降解的可行代谢物通路。研究可以为微生物对苯并(α)芘的作用机制提供一定的理论基础,为降低苯丙(a)芘对人体的危害提出可能的生物防治策略,进而为开菲尔发酵乳制品在食品工业中的合理开发应用提供研究依据。
1 材料与方法
1.1 材料
1.1.1 样品采集 采集新疆阿勒泰地区牧民家庭手工制作的开菲尔发酵乳制品,采集后装入灭菌自封袋中冷冻保藏运送至实验室。
1.1.2 主要试剂 苯并(α)芘(分析纯,>96%)购自上海麦克林生化科技有限公司,甲醇、乙腈(均为色谱纯,≥99.9%)购自美国Thermo Fisher Scientific公司,甲基叔丁醚(分析纯,≥99.9%):购自北京沃凯生物科技有限公司,甲酸铵(分析纯,≥99.9%)购自自美国 Sigma-Aldrich 公司,甲酸、丙酮、ddH2O等试剂均购自北京鼎国昌盛生物技术有限责任公司。
1.2 方法
1.2.1 开菲尔粒的活化与开菲尔乳的制备 取适量开菲尔发酵乳制品加入无菌水轻轻摇晃,清洗,过滤后留下伞状开菲尔粒备用。将清洗后的开菲尔粒按1∶5的质量比加入到灭菌牛乳中,在(37±1)℃培养24 h,重复上述活化步骤活化1-2次,备用。
苯并(α)芘溶液的配置:将苯并(α)芘固体溶于丙酮中配制为1 mg/mL的苯并(α)芘贮备液,然后用水稀释为苯并(α)芘浓度为100 μg/mL的工作液。
1.2.2 样品制备及处理 样品制备:将牛奶在80-82℃下加热20 min后冷却至40℃,然后以2%的接种量添加已活化的开菲尔粒,取刚接种开菲尔粒的牛乳为发酵0 h的样品作为对照样;在发酵乳中添加苯并(α)芘储备液,使其浓度为50 μg/mL,样品在37℃的恒温培养箱中发酵,从发酵8 h起每隔8 h取5个平行样,直到发酵32 h共25份样本,分别 编 号 为KBD001、KBD002…KBD005,KBD081、KBD082…KBD085,KBD161、KBD162…KBD165,依此类推,-80℃保藏备用。
发酵样品的前处理:将所有样本在4℃下融化(样品量不足按照等比例缩减);从每个样本中取150 μL 于1.5 mL 离心管中;每个离心管加入200 μL 甲醇和200 μL 甲基叔丁基醚(MTBE),振荡60 s,充分混匀;在12 000 r/min 4℃ 离心10 min,上清液使用0.22 μm 膜过滤,得到待测样本;自每个待测样本各取20 μL 混合成QC样本(QC:quality control,用来校正混合样品分析结果的偏差以及由于分析仪器自身原因所造成的失误)。
1.2.3 LC-MS分析 色谱条件:仪器采用Thermo Ultimate 3000,使用ACQUITY UPLC® HSST3 1.8 μm(2.1 mm×150 mm)色谱柱,自动进样器温度设为8℃,以0.25 mL/min 的流速,40℃的柱温,进样2 μL 进行梯度洗脱,流动相为正离子0.1%甲酸水(C)- 0.1%甲酸乙腈(D);负离子5 mmol/L 甲酸铵水(A)-乙腈(B)。梯度洗脱程序为0-1 min,2% B/D;1-9 min,2%-50% B/D;9-12 min,50%-98% B/D;12-13.5 min,98% B/D;13.5-14 min,98%-2% B/D;14-20 min,2% D -正模式(14-17 min,2% B -负 模式)。
质谱条件:仪器使用Thermo Q Exactive Focus,电喷雾离子源(ESI),正负离子电离模式,正离子喷雾电压为3.50 kV,负离子喷雾电压为2.50 kV,鞘气30 arb,辅助气 10 arb。毛细管温度325℃,以分辨率70 000 进行全扫描,扫描范围81-1 000,并采用HCD 进行二级裂解,碰撞电压为30 eV,同时采用动态排除去除无必要的MS/MS信息。
1.2.4 数据分析 所有的LC-MS图谱使用R(v3.1.3)的XCMS程序包进行峰识别、峰过滤、峰对齐得到包括质核比(mass to charge ratio,m/z)和保留时间及峰面积等信息的数据矩阵,进而得到正负离子模式下的前体分子,导出数据至R语言statTarget包的QC-RFSC算法对各个样本的特征(每个代谢物)信号峰进行校正,使用R2和Q2进行主成分分析(principal components analysis,PCA)和最小二乘法判别分析PLS-DA(Partial Least Squares Discriminant Analysis),根据t检验的P <0.05,同时 PLS-DA 模型主成分的VIP 值>1,进行差异性代谢物的筛选。对筛选出的差异代谢物,通过KEGG Pathway 数据库通路分析代谢物参与代谢途径,推导出苯并(α)芘降解的代谢物通路。
2 结果
2.1 苯并(α)芘胁迫下不同发酵阶段的开菲尔代谢物主成分分析(PCA)
采用PCA分析对苯并(α)芘胁迫下的5个不同的发酵时间段的开菲尔样品进行PCA分析,结果见图1。5个分组的点云(point cloud)明显分布在不同区域,从总体上反映了各组样品之间的总体差异和组内样品之间的变异度大小,5组不同发酵时间段的样品组的平行样品聚在一起,表明所有检测具有良好的分析稳定性和实验重现性;同时,第一主成分(PC1)和第二主成分(PC2)解释率分别为39%和14%,两者累计贡献率达到53%,可见苯并(α)芘胁迫条件下不同发酵时间内开菲尔样品之间分离趋势较明显,从整体上反映出这些样品之间的代谢物差异。A组未添加苯并(α)芘的对照样品与其他样品代谢物之间存在明显分离,可能是在苯并(α)芘胁迫下开菲尔粒中微生物产生的谢物物所导致的。
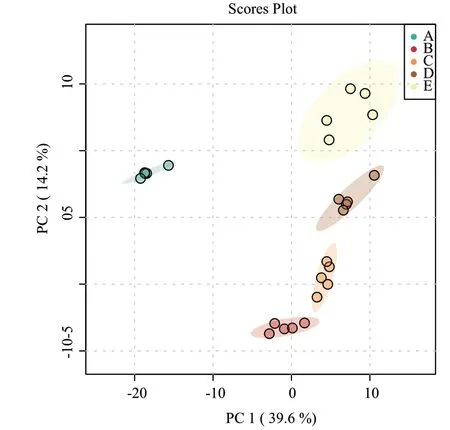
图1 苯并(α)芘胁迫下不同发酵阶段样品主成分分析Fig. 1 Principal component analysis of the samples at different fermentation stages under benzo(α)pyrene stress
2.2 苯并(α)芘胁迫下不同发酵阶段的开菲尔代谢物PLS-DA分析
偏最小二乘判别分析是有监督的,即分析时需要提供分组信息,能够寻找最大程度区分样品分组的因子(因子可以理解为所有代谢物的加权和)。如图2,不同分组的样本的点云分布在不同区域,说明PLS-DA模型的判别效果较好,分组间应该存在有显著差异的代谢物,其结果与PCA相似,正离子模式下所构建模型对开菲尔代谢物的累积判别解释能力R2Y=0.997,对模型预测能力Q2=0.971,这两个指标越接近于1时表示模型越稳定可靠,模型的拟合度较好。在OPLS-DA的置换检验中,我们用Q2作为检验统计量,用置换的方法求得Q2的随机分布。如图3,如果箭头所指的实际观测Q2在随机分布右侧(观测值明显大于随机值),说明Q2是显著的,模型的预测能力显著。

图2 苯并(α)芘胁迫下不同发酵阶段段样品PLS-DA得分图Fig. 2 PLS-DA score map of samples at different fermentation stages under benzo(α)pyrene stress

图3 OPLS-DA置换检验的检验统计量(Q2)分布以及 P值Fig. 3 Distribution of the test statistic(Q2)of the OPLSDA substitution test and the P value
2.3 苯并(α)芘胁迫下不同发酵阶段的开菲尔代谢物
计算每个样本内各个代谢物的百分比含量,然后用堆积柱形图可视化,能直观的比较分组之间的代谢物组成结构差异。图4展示了含量排在前20的代谢物,横坐标是样品名,根据分组顺序排序,同时用不同颜色标注了不同的分组样本。纵坐标表示各个代谢物的百分比含量,从上而下对应代谢物的柱的顺序与图例一致,其余的代谢物被包括进Others中。从图中可以看出,有机酸类物质占主导地位,柠檬酸类物质在发酵初期积累最多,随着发酵时间的延长逐渐减少。发酵0 h的样品中代谢物丰度与其他组分之间有较大差异,可能原因是发酵时间的不同与苯并(α)芘的胁迫所导致的。开菲尔粒中微生物在8 h时磷酸胆碱类物质减少,甘油磷酰胆碱类物质增加,苯乙胺物质在开菲尔发酵8 h与24 h的含量较高。
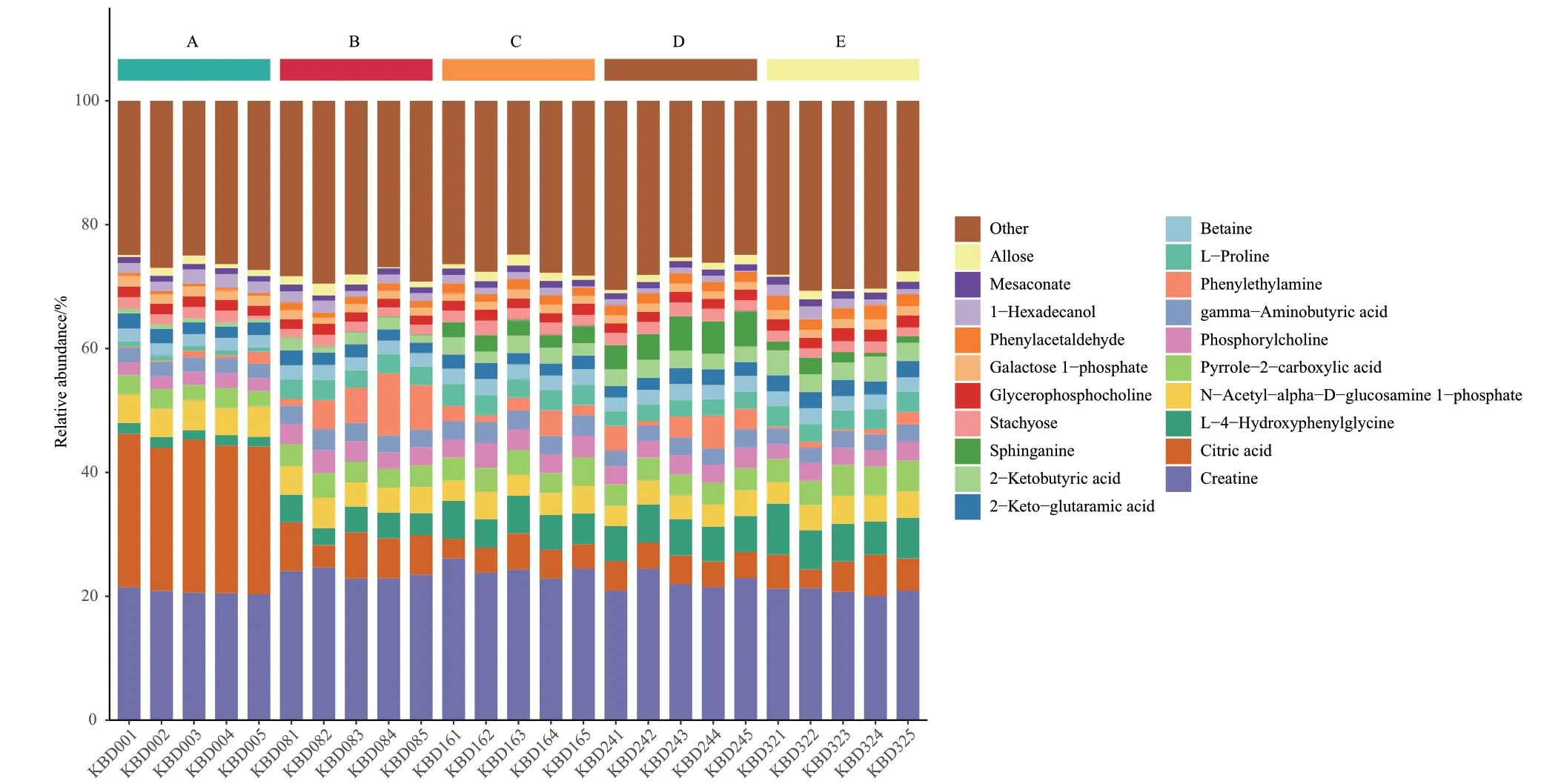
图4 苯并(α)芘胁迫下不同发酵阶段样品中代谢物百分比堆积柱形图Fig. 4 Stacked histogram of the percentages of metabolites in the samples at different fermentation stages under benzo(α)pyrene stress
在所有代谢物中,有的代谢物是在生物体内扮演着特定角色的,比如激素、维生素等。我们将所有代谢物用KEGG数据库br08001进行注释,得到代谢物所扮演的生物学角色,然后统计每个生物学角色的百分比含量,绘制百分比含量堆积柱形图,如图5所示。开菲尔粒中微生物在经过一系列代谢反应过程之后,中间代谢产物逐渐转变为类固醇类物质,激素和递质,维生素,脂类物质,核酸类物质,碳水化合物以及有机酸类物质。在发酵16 h时激素和递质类物质也较之前有明显递增。
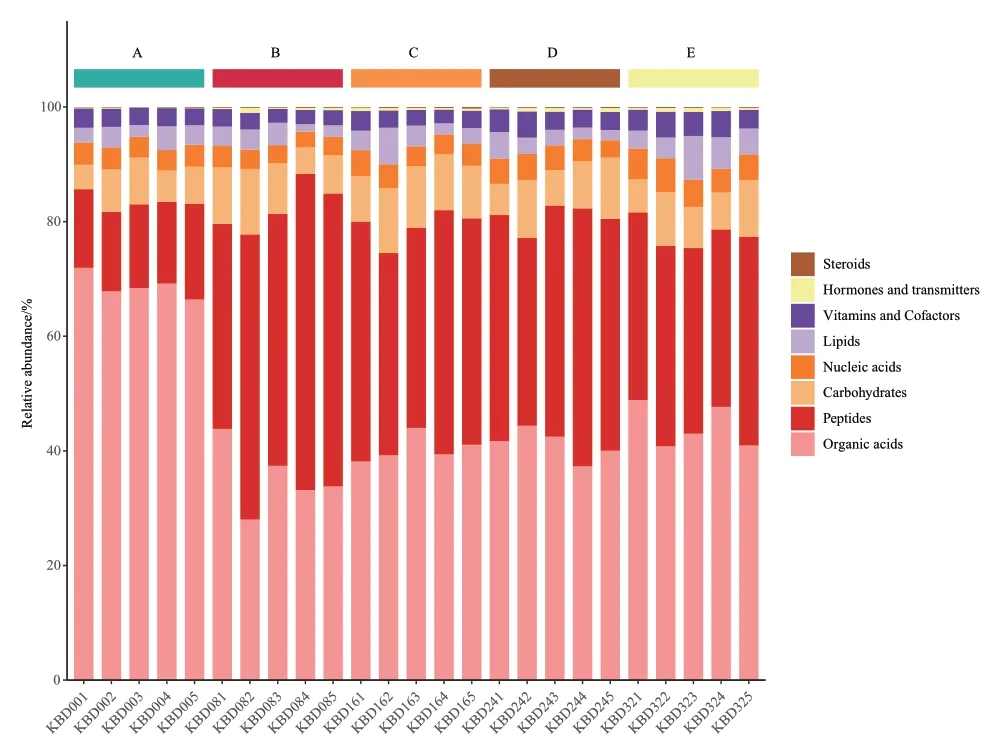
图5 苯并(α)芘胁迫下不同发酵阶样品扮演生物学角色的代谢物百分比Fig. 5 Percentage of metabolites playing a biological role in the samples of different fermentation stages under benzo(α)pyrene stress
2.4 特征代谢物(biomarker)的筛选
通过KEGG代谢物数据库对差异代谢物进行映射,为了更直接地了解关键代谢物,使用箱图比较来自5个不同发酵时间段的开菲尔粒中微生物代谢产物的含量丰度差异,结果见图6,显示具有极显著差异排名前25的物质。结果表明,胞核嘧啶、谷胱甘肽、4-胍基丁酸、胍丁胺、2-苯基乙醇、L-色氨酸、丙二酸、鞘氨醇、N-乙酰基D-半乳糖胺、腺苷、X1-羧基乙烯基膦酸酯、N-乙酰胆碱、腺嘌吟、N6-乙酰L-赖氨酸、苯丙氨酸、脯氨酸、色氨酸、肌氨酸、甲基丙二酸等代谢产物在对照组与苯并(α)芘胁迫组之间存在明显差异。

图6 苯并(α)芘胁迫下不同发酵阶段样品代谢物差异箱式图Fig.6 Box plot of the differences in metabolites of the samples at different fermentation stages under benzo(α)pyrene stress
同时为能够寻找在判别分析过程中作用(value importance in projection,VIP,重要性)最大的代谢物,将这些代谢物作为区分不同分组的biomaker。一般来说,VIP大于1的代谢物对判别分析的贡献是较大的,这些代谢物在分组间有较大差异。如图7黄色区域中,邻苯二甲酸(C8H6O4)、原儿茶酸 ((HO)2C6H3COOH)与苯乙酸(C8H8O)是校正后P<0.05,VIP大于1的代谢物,这些代谢物在分组间有显著差异,在PLS-DA中起到重要作用。
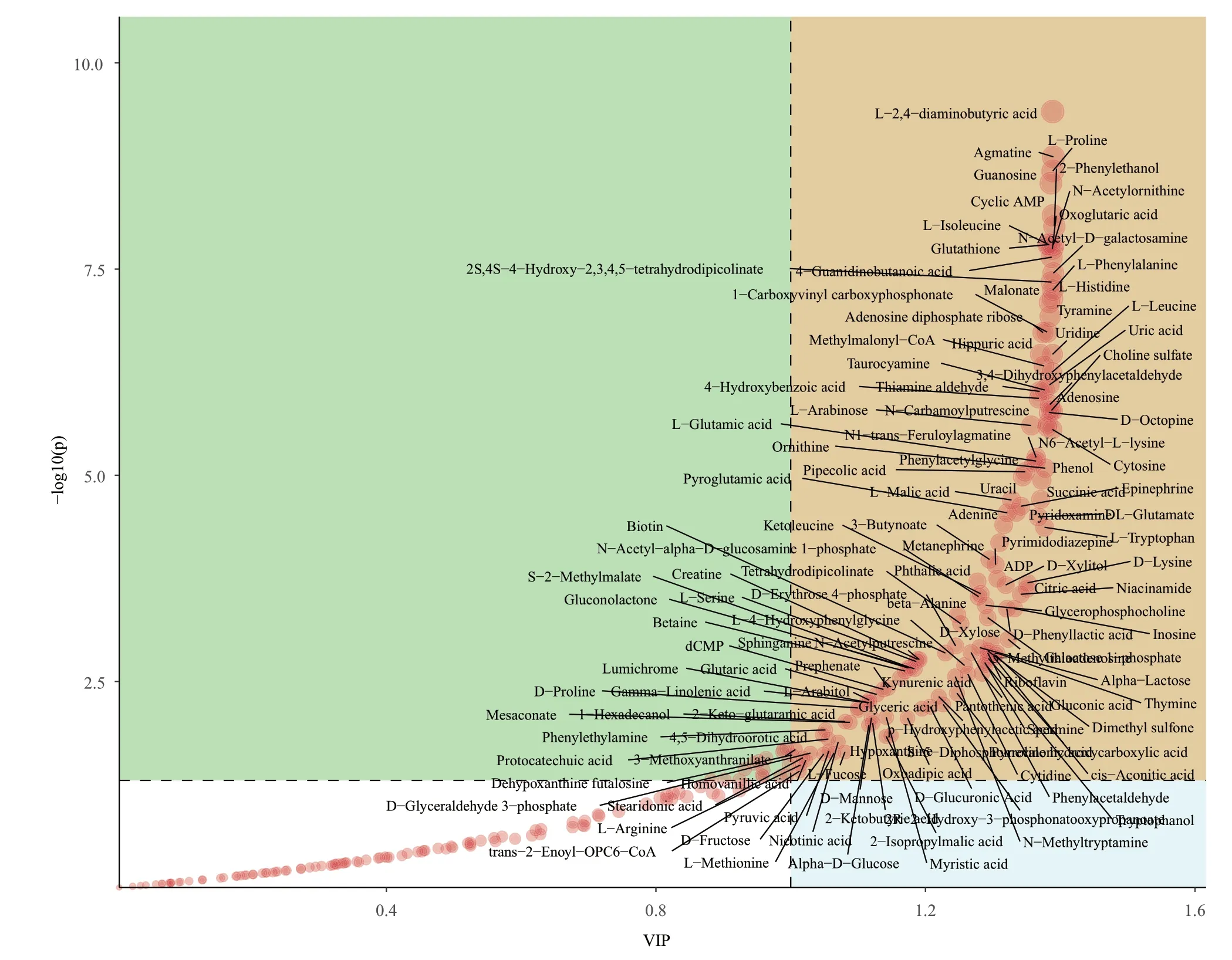
图7 苯并(α)芘胁迫下不同发酵阶段样品PLS-DA代谢物重要性图Fig.7 Importance map of PLS-DA metabolites in the samples at different fermentation stages under benzo(α)pyrene stress
如图6、7所示,对开菲尔粒中微生物在代谢过程中产生的重要代谢物进行分析,结果显示出原儿茶酸和邻苯二甲酸虽然在含量图中并未显示,但在代谢物重要性中可以看出原儿茶酸与邻苯二甲酸虽然含量不高,但在代谢过程中对代谢通路的判断有着重要的方向引导。
结合图1、2中PCA以及PLS-DA分析得出,在B组间明显有差异代谢物的产生,实验通过LC-MS分析,深入研究了开菲尔粒中微生物在对苯并(α)芘降解过程中产生的中间代谢产物,其中通过图3、4可明显看出在开菲尔粒中微生物在降解苯并(α)芘第8小时产生了苯乙酸等物质。
2.5 降解菌代谢苯并(α)芘的途径推测
富集分析是寻找在某个生物学过程中起关键作用的生物通路,从而揭示和理解生物学过程的基本分子机制。通过与KEGG数据库比对,可以获得代谢物参与的代谢通路信息,不同发酵阶段的开菲尔乳中间代谢产物共注释到56条代谢通路。对于代谢组数据,在富集分析之前,需要寻找特征代谢物,通常是那些在分组间有显著差异(t检验,P<0.05)的代谢物。
为了了解苯并(α)芘胁迫下开菲尔不同发酵阶段关键的代谢途径,通过计算这些代谢通路的过表达分析(over-representation analysis,ORA)P值,从而判断显著差异的代谢物是否在这些代谢通路中显著富集。图8中显示了差异代谢物显著富集的代谢通路。这些途径包括:精氨酸和脯氨酸代谢、苯丙氨酸代谢、三羧酸循环、甘氨酸、丝氨酸和苏氨酸代谢、嘧啶代谢、酪氨酸代谢、缬氨酸、亮氨酸和异亮氨酸生物合成等。颜色越深的通路表示这些代谢通路在重要代谢物邻苯二甲酸、原儿茶酸以及苯乙酸在代谢过程中富集程度越大。

图8 苯并(α)芘胁迫下不同发酵阶段样品差异代谢物显著富集的代谢通路(ORA富集分析)Fig.8 Metabolic pathways with significant enrichment of differential metabolites in the samples at different fermentation stages under benzo(α)pyrene stress(ORA enrichment analysis)
即便关注的代谢物在某个通路中显著富集,目前仍然不知道这些代谢物在这个代谢通路中是否起到关键作用,代谢物对代谢通路究竟有多大影响。拓扑分析能够计算显著差异的代谢物在代谢通路中的作用大小(用Impact衡量)。图9中虚线右侧区域的代谢通路是ORA富集分析中显著的代谢通路,纵坐标展示了这些代谢通路在拓扑分析中的作用大小,其结果与ORA富集分析结果一致。由拓扑分析图显示,原儿茶酸不仅在代谢过程中有着重要作用,同时原儿茶酸所在的这些代谢通路在苯并(α)芘降解的过程中也起到了关键性作用。

图9 苯并(α)芘胁迫下不同发酵阶段样品差异代谢物显著富集的代谢通路拓扑分析Fig.9 Topological analysis of metabolic pathways with significant enrichment of different metabolites in the samples at different fermentation stages under benzo(α)pyrene stress
代谢通路图能够比较直观的反映代谢物的上下游关系,作用模式,以及代谢通路的拓扑结构,同时能找到与代谢物关联的基因,是同时包含代谢物和基因的代谢通路(KEGG完整的代谢通路),有颜色的代谢物是在分组间有显著差异的代谢物,颜色对应分组,表示在对应分组中代谢物含量较高(相对其它分组)。
经过图8、9的代谢通路显著性分析,结合在PCA以及PLS-DA中分析得到的差异代谢物邻苯二甲酸、原儿茶酸、苯乙酸、邻苯二甲酸二异丙酯和苯酚等,可推断开菲尔粒中微生物在代谢苯并(α)芘时经过的代谢通路,如图10、11所示,苯乙酸在开菲尔粒中微生物降解苯并(α)芘时所经过的一条途径为苯丙氨酸途径,邻苯二甲酸由邻苯二甲酸二异丙酯通过邻苯二甲酸途径代谢产生。
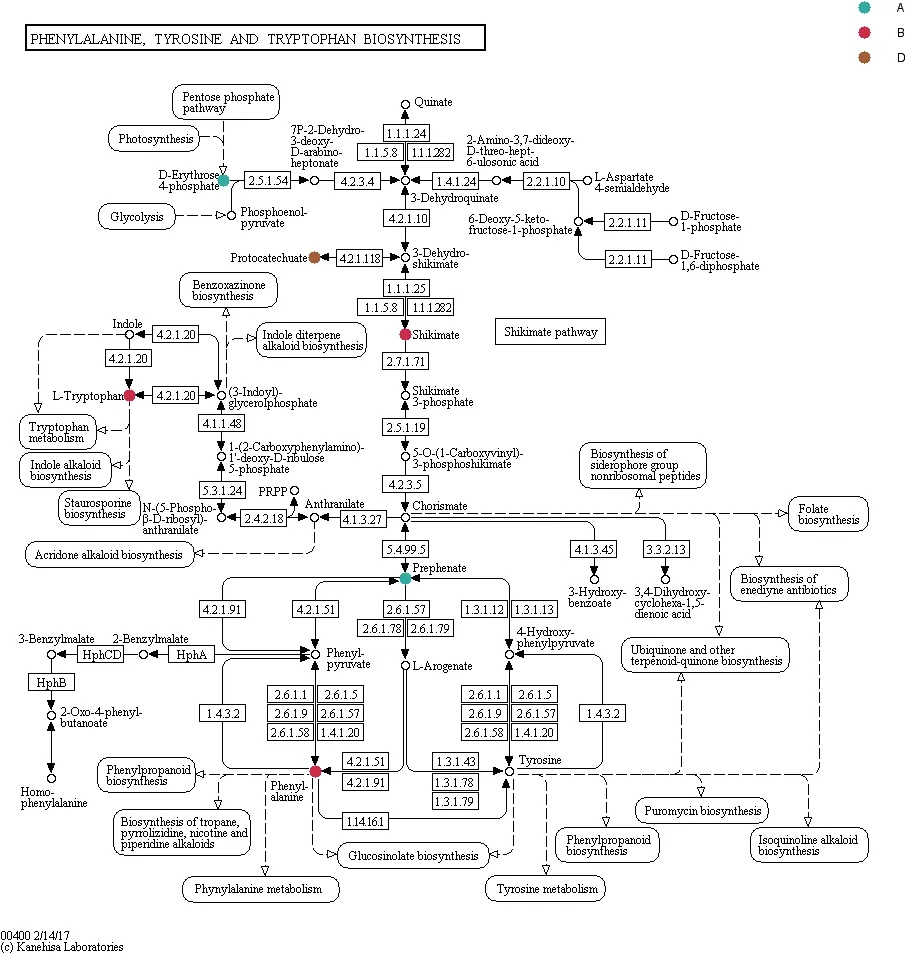
图10 苯丙氨酸途径Fig. 10 Phenylalanine pathway
与空白对照样比较,开菲尔粒中微生物的代谢体系中发现5种物质。分别为保留时间635.17、444.83、65.98、692.45和463.93 min的邻苯二甲酸、原儿茶酸、苯乙酸、邻苯二甲酸二异丙酯和苯酚。其中苯乙酸和苯酚推测为氢化肉桂酸进一步氧化代谢所产生,而在有氧的情况下,邻苯二甲酸首先被转化为原儿茶酸,接着原儿茶酸在双加氧酶的作用下被开环,从而进一步被利用[18];而邻苯二甲酸推测由邻苯二甲酸二异丙酯代谢产生。而邻苯二甲酸二异丙酯的存在推测是由1-羟基-2-萘甲酸在脱氢酶、双加氧酶、脱氢异构酶等一系列酶的作用下苯环裂解产生的[27]。
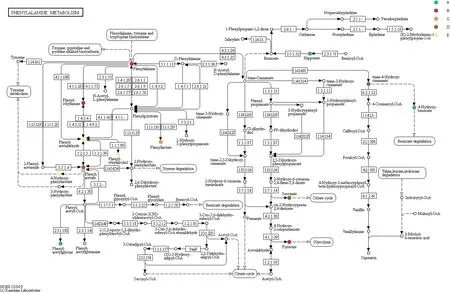
图11 邻苯二甲酸途径Fig. 11 Phthalic acid pathway
3 讨论
由于苯并(α)芘具有较强的致癌性、致突变性和致畸性,所以在研究高分子量多环芳烃的生物转化中,主要集中在苯并(α)芘的降解领域中,马静等[28]研究得出假单胞菌属(Pseudomonas)细菌是将多环芳烃化合物降解成为水杨酸和邻苯二酚等代谢产物最终进入三羧酸循环;分枝杆菌属(Mycobacterium)、气单胞菌属(Aeromonas)、粪产碱杆菌属(Alcaligenes)、微球菌属(Microcoecus)、芽孢杆菌属(Bacillus)[29],是将多环芳烃化合物代谢成为邻苯二甲酸和原儿茶酸再进入三羧酸循环[30]。还有一些菌株同时拥有两条甚至两条以上的苯并(α)芘代谢路径,如杨璐溪等[31]的研究表明新鞘氨醇杆菌US6-1以邻苯二酚代谢路径和原儿茶酸代谢路径。
细菌降解苯并(α)芘的过程中,中间代谢产物变化快且累积少,代谢产物的分离难度也大,因此有些学者研究发现降解苯并(α)芘时出现的中间代谢产物,未能进一步研究降解途径,只有少数研究表明,分离到苯并(α)芘代谢的中间产物并对其降解途径进行了分析。Kamlesh等[32]在枯草芽孢杆菌(Bacillus subtilis BMT4i’deki MTCC 9447)对苯并(α)芘的降解产物中检测到了苯并(a)芘-11、12-环氧化物,苯并(a)芘顺式7、8-二氢二醇等7种代谢产物,并由此推断表明枯草芽孢杆菌中苯并(α)芘降解有多种途径。苯并(α)芘在最初阶段由氧化还原反应活化,通过氢原子的还原和饱和碳原子中的碳-碳键被氧化而形成1-羟基-2-萘甲酸。而1-羟基-2-萘甲酸被认为是多环芳烃生物降解的关键中间产物[27]。虽然在本研究中并未测得1-羟基-2-萘甲酸,但在许多推定芳烃双加氧酶基因的研究可以支持这一推论[33-35]。而1-羟基-2-萘甲酸通常可以通过“邻苯二甲酸途径”或“萘途径”的两种不同途径进行降解[34]。通过已经测得的邻苯二甲酸经由“邻苯二甲酸途径”进一步转化为原儿茶酸[36],推测开菲尔粒中微生物对苯并(α)芘的降解是经过“邻苯二甲酸途径”代谢途径。虽然1-羟基-2-萘甲酸通过“萘途径”的代谢途径可能产生的氢化肉桂酸并未检出,但苯乙酸和苯酚的存在可以推断出氢化肉桂酸为1-羟基-2-萘甲酸通过“萘途径”代谢的降解产物。苯酚可以通过羟化酶基因的作用转化成为儿茶酚进入三羧酸(TCA)循环后被降解,羟化酶基因通过编码苯酚降解途径的第一个酶,负责将苯酚转化为儿茶酚;将儿茶酚开环裂解为TCA产物,是由邻位和间位酶负责的;儿茶酚的进一步降解具有不同的途径和酶系统:邻苯二酚2,3-双加氧酶(间位裂解)或邻苯二酚1,2-双加氧酶(邻位裂解)[37]。苯酚也可通过羟基被氧化为羧基形成糖醛酸。通过以上分析,推测开菲尔粒中微生物在降解苯并(α)芘时具有“萘途径”“邻苯二甲酸途径”“苯丙氨酸途径”3条代谢途径,最后进入TCA循环。研究结果表明开菲尔粒中微生物在降解苯并(α)芘方面具有较大潜力,可以为微生物对苯并(α)芘的作用机制提供一定的理论基础,可以为降低苯丙(a)芘对人体的危害提出可能的生物防治策略,为开菲尔发酵乳制品在食品工业中的合理开发应用提供研究依据。
4 结论
本研究基于LC-MS 的非靶向代谢组学技术,对添加苯并(α)芘发酵0 h、8 h、16 h、24 h和32 h 的5个发酵时间段样品的差异代谢产物进行分析。通过对差异代谢物和通路进行相关性分析,获得了邻苯二甲酸、原儿茶酸、苯乙酸、邻苯二甲酸二异丙酯和苯酚等特征代谢物。从以上5种物质推测出开菲尔粒中微生物在降解苯并(α)芘时可能经过“萘途径”“邻苯二甲酸途径”“苯丙氨酸途径”3条代谢途径,最后进入TCA循环。

