三亚蜈支洲岛海洋牧场近岛区底表大型底栖动物群落结构及评价
马文刚, 夏景全, 魏一凡, 尹洪洋, 覃乐政, 刘相波, 胡雪晴, 许强, 李秀保,王爱民
海南大学海洋学院, 南海海洋资源利用国家重点实验室, 海南 海口 570228
现代化海洋牧场建设已成为国家促进渔业产业转型升级、缓解近海渔业资源衰退的重要举措。南海热带海域幅员辽阔, 生物资源种类丰富, 休闲旅游产业发达, 发展热带岛礁型海洋牧场潜力巨大,以增殖放流、发展休闲旅游业及修复珊瑚礁生境为主要目标, 可实现资源可持续利用与生态环境优良协同发展(许强 等, 2018; 黄晖 等, 2020)。三亚蜈支洲岛海洋牧场是我国第一个热带休闲旅游型海洋牧场国家级示范区, 近岛珊瑚礁区域为休闲渔业开发的核心区, 通过开展珊瑚修复和渔业资源养护, 显著促进了珊瑚礁生态系统的恢复, 也为各类礁栖生物提供了丰富的饵料和栖息场所(Soares et al,2021)。
大型底栖动物群落多样性是珊瑚礁生态系统健康的重要指标之一(吴莹莹 等, 2021), 开展大型底栖动物群落结构监测与评价对于评估海洋牧场的生态修复作用至关重要(杨东 等, 2017)。珊瑚礁区的大型底栖动物 (macrozoobentho) 多为无脊椎动物,主要包括节肢动物甲壳类、软体动物、腔肠动物、环节动物多毛类和棘皮动物5 个类群(田胜艳 等,2009), 在其摄食和筑巢等活动时, 造成的生物扰动会促进有机质的代谢循环产生能流和物流的传递,对生物地球化学循环造成重大影响, 促使水层-底栖耦合机制的建立(张志南, 2000)。近年来, 全球范围内珊瑚礁生态系统均呈退化趋势, 严重扰乱了礁区内大型底栖动物与底栖生境的平衡(李元超 等,2015; 吴钟解 等, 2015)。有研究发现, 某些底栖动物种类是海洋污染的敏感指示生物, 因此许多研究人员将监测大型底栖动物群落组成的改变, 作为监控海洋生态系统变化及生态状况评估的主要手段(Von Der Ohe et al, 2013; Azovsky et al, 2019)。
大型底栖动物是海洋食物网中的重要成员(罗章凤 等, 2017), 是多种肉食性动物的天然食物来源,生物资源量的分布及变动还将直接影响渔业资源的变化(刘帅磊 等, 2018), 因此大型底栖动物是海洋牧场建设中备受关注的生物类群。目前, 国内已有对海洋牧场底栖生物群落的研究, 发现海洋牧场建成后, 底栖动物资源增加, 有效证明了海洋牧场建设工程对生境的改善, 并且利于底栖动物群落结构的稳定性, 有助于海洋牧场生物资源的可持续利用(陈晨 等, 2016; 王言丰 等, 2019)。热带休闲旅游型海洋牧场受旅游等人为因素干扰较大, 底表大型底栖动物群落很可能会受其影响, 因此亟须加强持续的监测评估, 分析其变动趋势及人为影响程度。但目前相关研究仅有黄端杰 等(2020)对棘皮动物的研究报道。
与此同时, 三亚蜈支洲岛海洋牧场靠近琼东沿岸上升流核心区, 其近岸珊瑚礁位于我国珊瑚礁过渡区, 上升流可以减弱区域内海温上升对珊瑚胁迫的影响, 使得岛周珊瑚礁保存了较高的生物多样性(Huang et al, 2020)。蜈支洲岛海洋牧场近岛区底表大型底栖动物群落的研究对于海南近岛珊瑚礁系统健康的评价与保护也具有借鉴意义。
本文研究了蜈支洲岛海洋牧场底表大型底栖动物群落组成和结构及其时空变动, 以期探究环境因子变化对群落分布的影响, 初步评估水环境状况和生物群落稳定状况, 为蜈支洲岛海洋牧场生态系统健康评价提供数据支持。
1 材料与方法
1.1 调查站位
蜈支洲岛海洋牧场分为近岛区及远岛毗邻区两部分。毗邻区投放有多处人工鱼礁区, 而近岛区主要为拥有高生物多样性的自然珊瑚礁生态系统,为整体海洋牧场提供了观光旅游和资源养护等重要功能, 所以本文着重研究近岛区。为充分调查蜈支洲岛近岛区底表大型底栖动物群落状况, 以前期珊瑚礁生物群落普查结果为基础(李秀保 等,2019), 在近岛区北部和南部近岸区域设置四个站位, 调查站位分布见图1。蜈支洲岛珊瑚礁分布在水深3~12m, 因此礁栖大型底栖动物采样选择水深6~8m 区域进行。
1.2 调查时间
蜈支洲岛属热带海区, 7—10 月台风伴随暴雨灾害频发, 2018—2020 年每月平均降雨量如图2 所示(数据来源于海南省气象局, 网址: http://hi.cma.gov.cn/)。台风期间潜水员不宜作业, 故本研究根据实际情况分别在夏季(2020 年6 月)、秋季(2020 年11 月)、冬季(2021 年1 月)和春季(2021 年4 月)进行4 个季度的底表大型底栖动物调查及环境因子采样。
1.3 调查方法
依据已有珊瑚礁底栖动物调查方法及本文研究目的, 本研究中底表大型底栖动物(以下简称“大型底栖动物”)特指生活在珊瑚礁区底质表面上肉眼可见的大型底栖动物(Hutchings, 1990; 孙有方 等,2018)。调查采用国际上通用的珊瑚礁区调查方法(黄丁勇 等, 2021), 将潜水视频记录及样带采样法相结合, 在各站位根据水深(约8m)及海底地形设置采样断面, 布设3 条平行于海岛岸线的20m 长样带作为采样平行。调查人员手持水下高清摄像机(GoPro 5)沿样带拍摄两侧各1m 范围内的底栖生境录像, 构成三段20m×2m 的基准调查范围, 同步采集该区域内的大型底栖动物。采样后2h 内将样品送至岛上实验室进行生物鉴定、计数和称量工作, 并结合样带视频和现场记录资料汇总统计分析, 将大型底栖动物数量换算为单位面积的丰度(ind.·m-2),湿重换算为单位面积的生物量(g·m-2)。
用有机玻璃采水器于各站位1m 深处采集表层水1L, 避光冷藏保存至实验室抽滤测定营养盐; 采集表层沉积物, 上岸后用铝箔纸包好沉积物样品送检测定沉积物粒度和有机质含量; 各站位表层(海面以下 1~2m)水体温度(T)、盐度(Sal)和溶解氧(dissolved oxygen, DO)等环境参数采用 YSI 6600 型多参数水质监测仪现场测定。
1.4 数据处理与分析
大型底栖动物群落的生物多样性指数: 丰富度指 数 (Margalef index,d) 、 多 样 性 指 数(Shannon-Weaveer index,H′)、均匀度指数(Pielou index,J)以及优势度(Y)计算分别采用如下公式(董栋等, 2015):
式中,S表示样品中的种类总数,N表示样品中的生物总个体数,Pi为第i种的个体数与总个体数N的比值,ni为群落中第i个种在空间中的个体数量,fi为第i个种在各样方中出现频率; 当优势度Y≥0.02 时,该种为优势种(徐兆礼 等, 1989)。
本文采用生物多样性指数(H′)和多变量海洋生物指数(Multivariate-AZTI′s marine biotic index,M-AMBI)对环境质量状况进行初步评价(林和山等, 2015), 利用丰度与生物量比较曲线(ABC 曲线)法对底栖动物群落结构稳定性进行评判(田胜艳等, 2006)。群落结构的时空差异采用聚类分析(cluster)与多维排序尺度分析(multidimensional scaling, MDS)进行, 以四季中相对丰度超过3%的物种(减少机会种干扰)绘制图表划分聚类组; 环境因子与底栖动物群落结构指标相关性分析采用Spearman 相关性分析法进行, 分析前对大型底栖动物丰度、生物量与环境因子数据利用平方根转化进行均一化预处理。
大型底栖动物的优势度采用微软Excel 统计计算; 站位图及丰度、生物量分布图采用Surfer 12 软件绘制; 生物多样性指数、聚类分析和生物量比较曲线(abundance-biomass curves, ABC 曲线)分析采用PRIMER 6 软件分析绘制; M-AMBI 指数采用AMBI V5.0 软件分析计算; 大型底栖动物丰度与生物量季节性及区域性差异, 环境因子和生物群落多样性指数的季节性差异采用单因素方差分析(one-way ANOVA)进行, 使用SPSS 23 软件。
2 结果与分析
2.1 近岛区环境特征
近岛区四个季度的环境因子统计结果如表1 所示,不同季节近岛区北部和南部的环境因子变动如图3 所示。蜈支洲近岛区水体温度(T)季节性变化特征为冬季最低, 受琼东上升流影响夏季水体温度并没有出现显著升温, 与春季和秋季差异不显著; 溶解氧(DO)在冬季最高, 秋季受台风和降雨的影响显著低于其他季节。各环境因子的空间分布也有所不同, 近岛区北部的磷酸盐(P)和硅酸盐(Si)含量在春、秋和冬季高于南部(图3c、d); 北部的沉积物有机质含量(Org)分布表现为在不同季节均高于南部(图3f)。相关性分析的结果显示大型底栖动物的丰度与溶解氧(DO)呈显著正相关(P<0.05), 生物量同其他环境因子均未呈现出相关性(P>0.05)。温度和其他多个环境因子具有相关性, 如温度与溶解无机氮(dissolved inorganic nitrogen, DIN)呈极显著负相关(P<0.01), 也与磷酸盐中磷元素呈极显著负相关(P<0.05)。
进一步对底栖生境调查发现, 蜈支洲岛近岛区北部与南部生境斑块类型差异较大。北部区域造礁石珊瑚和软珊瑚覆盖度为 14.52%左右, 还包含80.02%的砂砾及粉砂—黏土底质类型; 而岛南区域两种底质类型分别占到41.85%和52.84%(李秀保等, 2019; Huang et al, 2020)。
2.2 种类组成和优势种
蜈支洲岛海洋牧场近岛区4 个季节共采集到大型底栖动物90 种, 隶属于棘皮动物、软体动物、节肢动物3 个门类。其中软体动物种类数最高, 达62种, 占总种类数的68.89%; 其次是棘皮动物(22 种)和节肢动物(6 种)。大型底栖动物群落种类组成存在季节性变化, 秋季种类数最为丰富, 有55 种, 占全年大型底栖动物总种类数的61.11%, 冬季(51 种)大型底栖动物种类数略低于秋季, 夏季发现的种类数最少, 共鉴定出大型底栖动物2 个门类共16 种, 仅占全年大型底栖动物种类数的 17.78%。近岛区南、北区域的群落种类组成也存在变化, 四个季节在北部区域采集到的种类数均高于南部(图4)。
海洋牧场近岛区优势种共16 种(表2), 棘皮动物在四个季节均占据优势。冬季优势种最多共14 种,角小核果螺(Drupella cornus)优势度最高(Y=0.107);其次为春季共10 种, 优势种以红腹海参(Holothuriaeduils) (Y=0.225)和黑海参(Holothuria atra)(Y=0.121)为主; 秋季有8 种, 主要优势种同春季一致; 夏季优势种最少有7 种, 以黑海参(Y=0.305)和角小核果螺(Y=0.146)为主。蓝指海星(Linckia laevigata)、吕宋棘海星(Echinaster luzonicus)、红腹海参、黑海参和金口蝾螺(Turbo argyrostomus)是全年优势种。
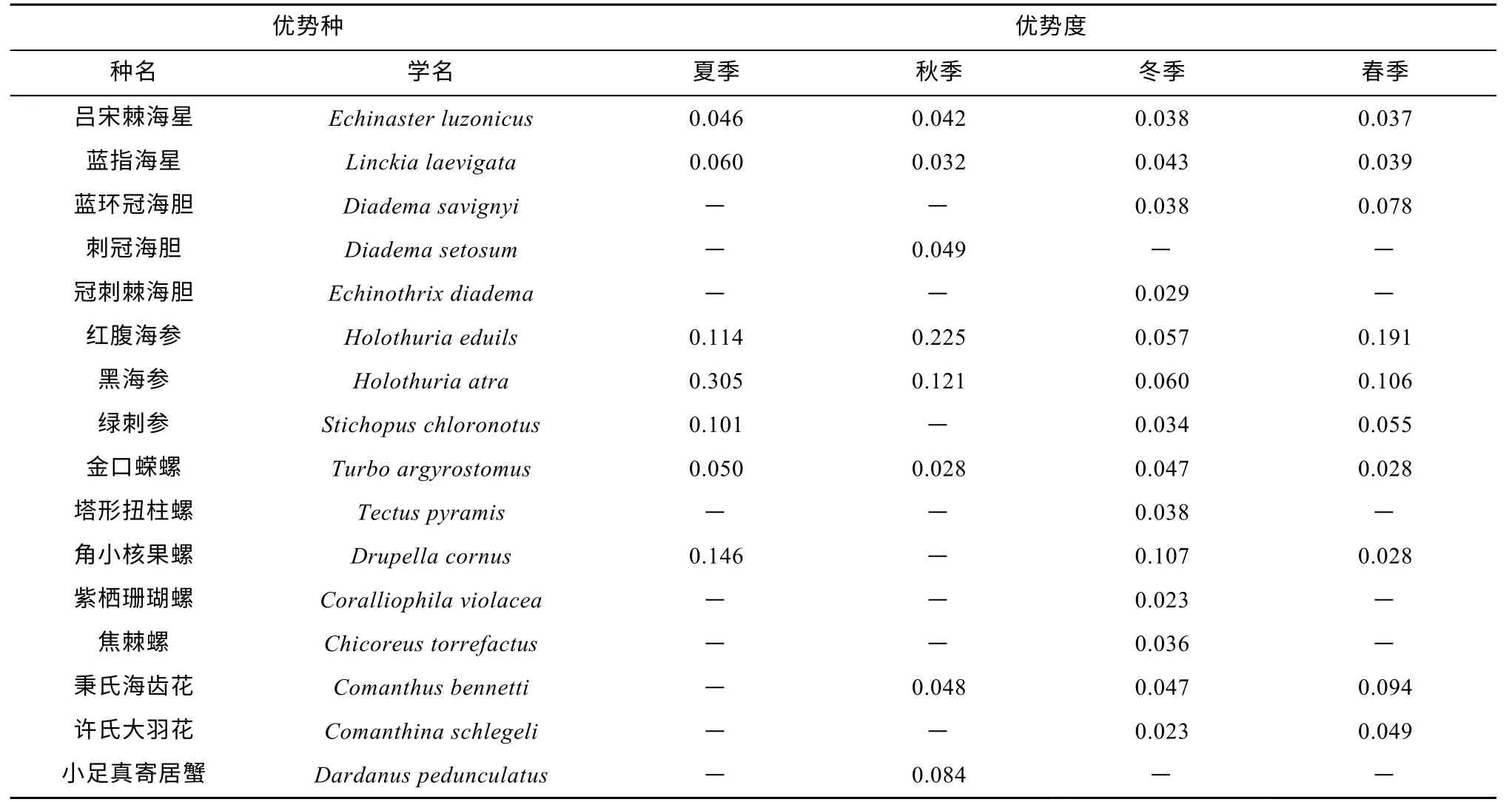
表2 各季节优势种Tab. 2 Dominant species in each season
2.3 丰度和生物量分布
图5 及图6 分别为四季各站位的大型底栖动物丰度和生物量分布。大型底栖动物的年平均丰度为0.87±0.26ind.·m-2, 夏季大型底栖动物丰度最低(图5a), 仅有0.59ind.·m-2, 春季丰度(1.18ind.·m-2)为四季中最高(图5d), 季节间丰度变化的差异不显著(P>0.05), 近岛北部区域(d1、d2)的丰度要显著高于南部区域(d3、d4)(P>0.05)。棘皮动物是海洋牧场近岛区大型底栖动物群落的优势类群, 只有冬季丰度(51.49%)占比略低, 其他季节其占比都达70%及以上, 尤其以春季丰度最高, 同全年大型底栖动物丰度在近岛区域的分布一致, 棘皮动物的丰度在北部的两站位要高于南部。
近岛区大型底栖动物年平均生物量为76.99 ±34.32g·m-2, 生物量的季节性变化同丰度的类似。春季(126.28g·m-2)最高(图6d), 秋季(53.09g·m-2)与夏季(54.03g·m-2)的生物量相近(图6a、b), 处于较低水平, 生物量季节差异不显著(P>0.05), 北部区域(d1、d2)的生物量要显著高于南部区域(d3、d4)(P>0.05)。棘皮动物的生物量优势依旧明显, 除冬季(76.72%)外, 其他三个季节的占比都达到90%及以上。因棘皮动物生物量及丰度均占比较高, 所以大型底栖动物的总体丰度及生物量变化趋势同棘皮动物一致。
2.4 群落结构空间差异分析
本文采用聚类分析(cluster)与多维排序尺度分析(MDS), 分别以四个季节的不同站位底栖动物群落结构相似性进行分组(图7)。依据50%的相似性水平, 四个季节的近岛区底栖动物群落分别可划分为2 个聚类组, 聚类组间存在较为明显的区域性差异。大致可划分为近岛区北部两站位(d1、d2)的大型底栖动物群落为一群组, 南部d3 和d4 两个站位的大型底栖动物群落为一群组。
北部聚类组的生境状况表现为水体中部分营养盐(P、Si)含量和沉积物有机质含量较高, 底质类型多为砂地, 沉积物粒径偏细, 大型底栖动物的种类数、丰度和生物量也较丰富, 同时人类活动较为密集; 南部聚类组环境中的营养物质较北部低, 珊瑚覆盖度高, 沉积物粒径较大, 生物的各项指数也低于北部区域, 且人为干扰较少。
2.5 生物多样性指数及M-AMBI 指数
海洋牧场近岛区四季的生物多样性指数如表3所示。d的最大值在冬季, 为3.40±0.26, 显著高于夏季(P<0.05), 秋季的d值在站位间变化最大;J和H′的最大值均出现在冬季, 分别为 0.81±0.09 和3.71±0.52。四个季节的J值无显著差异(P>0.05),H′值为春、秋和冬季显著高于夏季(P<0.05)。

表3 各季节生物多样性指数及M-AMBI 指数值Tab. 3 Biodiversity index and M-AMBI in four seasons
根据蔡立哲 等(2002)采用的多样性指数(H’)与水质污染程度的分级标准, 即H′值于2~3 之间时,研究区域属轻度污染;H′值>3, 该区域为无污染; 以及当M-AMBI 指数介于0.77~1 时, 生态环境质量为高等, 介于0.53~0.77 时为优良 (林和山 等, 2015)。初步判断蜈支洲岛海洋牧场近岛区的大型底栖动物在春季、秋季和冬季的生物多样性较高, 水体无污染, 而夏季的生物多样性较低, 且水体受到轻度污染影响。
2.6 群落结构稳定性评价
海洋牧场近岛区四个季节的大型底栖动物ABC 曲线(图8)显示冬季的生物量曲线一直在丰度曲线之上, 没有出现交叉现象, 仅在两曲线终点处非常接近(图8c), 说明冬季大型底栖动物群落的稳定性最好。而春季、夏季和秋季的两条曲线相距较近, 生物量曲线部分位于丰度曲线下方, 两条曲线出现交叉和重叠现象(图8a、b、d), 说明大型底栖动物群落受到扰动, 群落稳定性有所下降; 夏季的W值(0.023)在四季中最低, 且出现两次交叉现象,群落受到的扰动最为严重。
3 讨论
本研究调查站位间距较大, 覆盖的范围广, 因此近岛区物种数量调查的结果相较于已有研究文献更为丰富(李秀保 等, 2019; 黄端杰 等, 2020)。与三亚珊瑚礁保护区内的其他海域相比, 蜈支洲岛海洋牧场近岛区的大型底栖动物丰度要低于东岛、鹿回头和大东海珊瑚礁保护区的平均丰度(1.36ind.·m-2)(孙有方 等, 2018), 也明显低于西岛、亚龙湾和鹿回头(566.29ind.·m-2)(董栋 等, 2015), 但大型底栖动物的生物量与该三处相邻海域的调查结果平均值相近(82.15g·m-2)且物种具有较高的相似性(董栋 等,2015; 黄丁勇 等, 2021)。
3.1 大型底栖动物群落结构季节变动
本研究发现夏季海洋牧场近岛区的大型底栖动物丰度(0.59ind.·m-2)、生物量(54.03g·m-2)及群落多样性(1.26 ± 0.53)较低, 这可能和夏季岛周出现的季节性冷水上升流造成的底层温度持续偏低有关(Li et al, 2015)。蜈支洲岛位于琼东沿岸上升流区, 在夏季高温时, 上升流能部分缓解水体温度升高, 珊瑚礁区的底层温度能维持在礁栖性生物相对适宜范围内(Li et al, 2012; Huang et al, 2020)。但随着上升流加强, 底层水体温度出现较明显下降(表1), 并将持续1~2 周, 琼东上升流期间文昌海域测得底层上升流水体(8m)与表层水体(0m)温差达5℃以上(Li et al,2015)。底层持续的低温会导致与温度相关的一系列环境因子的变化, 从而干扰到大型底栖动物的生存状态, 进而产生群落分布格局的变化。
本研究同时发现因受2020 年秋季持续台风带来的强降雨造成的水体低氧影响, 秋季大型底栖动物的丰度(0.74ind.·m-2)与生物量(53.09g·m-2)也都维持在较低的水平。Rajan 等(2021)研究发现, 地表径流加强伴随的水体低氧会影响底栖生物的生理和繁殖等生命活动, 大型动物如甲壳动物和棘皮动物对DO 降低相对更敏感。对比发现, 2020 年夏、秋季节蜈支洲岛经历的台风和暴风雨较往年偏多(图2), 频繁而强烈的风暴潮造成的恶劣海况和上游泄洪使水体浊度较高, DO 含量处于较低值(表1), 大型底栖动物向离岛深水区等相对稳定的生境迁移(Lunt et al,2014), 导致近岛礁区的大型底栖动物的生物量出现全年最低值。
3.2 大型底栖动物群落结构空间差异
聚类(cluster)与MDS 分析结果间的差异性表明,蜈支洲岛海洋牧场近岛区可划分为北部和南部2 个聚类组。相较季节间差异, 群落结构的区域性差异更为明显, 北部区域大型底栖动物的丰度及生物量明显偏高, 能够在不同季节形成较大规模的聚类组,而南部受到部分环境因素限制, 形成另一个聚类组。这可能与近岛南北两侧的沉积物性质以及人类活动的频繁程度差异相关。南部区域为发育良好的珊瑚礁生境, 生物群落稳定性高整体变动较小, 北部区域尚处于恢复阶段, 稳定性略差, 易受环境等因素变化影响。
底栖动物的群落组成与海底沉积物粒径(袁涛萍 等, 2017; Kolyuchkina et al, 2020; Gerasimova et al, 2021)及沉积物的有机质含量(Rajan et al, 2021;Boutoumit et al, 2021)有重要的关系。经鉴定, 海洋牧场近岛区北部区域底质粒径偏细, d1 站位底质多为粉砂, 而其他站位多为粒径大于63μm 的粉砂质砂, 棘皮动物与软体动物多分布于沉积物为粉砂—黏土等粒径较细的区域(黄端杰 等, 2020; 全秋梅等, 2020); 北部区域靠近蜈支洲岛码头和主要娱乐设施, 人类活动较为密集, 各类船艇及休闲潜水活动对水体造成较强的扰动会造成底质营养盐的再悬浮, 同时潜水游客对观赏鱼类的投饵也会带来一定的外源营养(Huang et al, 2020; 许惠丽 等, 2020),因此水体中营养盐含量及表层沉积物有机质含量在全年大部分时间均高于南部区域(图3), 为底栖藻类的生长提供了充足营养物质(徐帅帅 等, 2017;Rojas-Montiel et al, 2020)。文献数据表明, 岛北藻皮与钙化藻的覆盖度介于 19.44%~35.83%(夏景全,2021), 海藻来源有机质构成了底栖动物的潜在食物来源, 使得该区域底栖动物丰度及生物量均较南部区域高。相较而言, 近岛区南部海域水质良好, 透明度高, 珊瑚覆盖度要远高于岛北部, 沙质底生境斑块较少。由于海参等棘皮动物对沙质底生境有较强的依赖性, 同时岛南侧近岛区浪大流急, 因此海参等棘皮动物分布较少, 这也与国外学者研究结论一致(Rodríguez-Troncoso et al, 2019)。因此, 岛南部两站位的丰度与生物量相差不大且低于北部区域。
3.3 群落结构稳定性评价
本研究基于Shannon-Wiener 多样性指数(H′)以及M-AMBI 指数评价环境受污染程度标准(蔡立哲等, 2002; 林和山 等, 2015), 初步判断蜈支洲岛海洋牧场近岛区春、秋和冬季水质状况良好, 仅在夏季海区出现轻度污染现象, 整体生态状况处于良好状态。ABC 曲线法评估结果表明, 夏季大型底栖动物群落受到一定程度干扰, 群落结构出现稳定性较差的情况, 这与生物多样性指数的评估结果一致。究其原因可能与季节性自然环境变动因素有关, 夏季进入雨季导致的降雨量持续增加, 同时上升流介导的底层溶氧水平下降和低温可能也会造成影响。区域性差异方面, 北部区域靠近游客码头及主要娱乐区域(夏景全 等, 2020), 海上船艇活动和潜水活动频繁, d1 站位的水质状况在春季和秋季为各站位最低, 呈现轻度污染, 主要原因可能是营养盐水平偏高; 南部区域的水质状况除夏季出现下降外, 其他季节均为良好, 推测可能因南部水动力引起的潮流复杂, 水体自净能力最强, 大部分时间处于洁净状态。
对比邻近珊瑚礁生态系统的多样性指数, 如东岛(3.07)、鹿回头(2.88)和大东海(1.85)(孙有方 等,2018), 蜈支洲岛近岛区的多样性指数(3.14±0.88)较高。在其他三片海域依然存在人类过度捕捞, 生境被破坏的威胁下, 蜈支洲岛旅游区在多年前就一直对海域开展严格的监管维护, 其自身优良的水环境条件及周边多样化的底栖生境类型, 为近岛区礁栖性生物栖息提供了良好的庇护所及索饵场地, 复杂的底质类型会使底栖动物丰富度更高(Rojas-Montiel et al, 2020)。未来需要长期的监测数据来了解群落结构变化对海洋牧场生态效应的影响。
4 结论
蜈支洲岛海洋牧场近岛区大型底栖动物丰度与生物量的变化总体上以软体动物和棘皮动物的变动为主要特征。夏季上升流造成的底层水体低温环境,以及秋季频繁的热带风暴与强降雨天气造成的水环境剧烈波动, 可能是近岛区大型底栖动物丰度及生物量偏低的原因。蜈支洲岛北侧和南侧的大型底栖动物群落存在明显的差异, 可能与底栖生境类型、水动力条件以及人类活动的频繁程度等因素有关。综合研究结果表明, 蜈支洲岛海洋牧场近岛区大型底栖动物种类与资源量丰富, 生物多为大型化成体,同时底栖群落多样性指数总体维持在正常范围内,但群落稳定性在部分季节偏低。建议夏季近岛区北侧旅游活动应进行调整、优化, 保证海洋牧场近岛区珊瑚礁生态系统的稳定性与健康。

