中沙大环礁四种大型海藻的光生理特征比较及其对升温的响应*
李刚, 万明月, 史晓寒, 秦耿, 麦广铭, 黄良民, 谭烨辉,邹定辉
1. 热带海洋生物资源与生态重点实验室(中国科学院南海海洋研究所), 广东 广州 510301;
2. 南方海洋科学与工程广东省实验室(广州), 广东 广州 511458;
3. 应用海洋学重点实验室(中国科学院南海海洋研究所), 广东 广州 510301;
4. 中国科学院大学, 北京 100049;
5. 华南理工大学环境与能源学院, 广东 广州 510006
大型海藻包括绿藻、红藻和褐藻等, 主要分布于近岸及珊瑚礁海域的潮间带及潮上和潮下带, 是一类最重要的海洋生物和可再生资源(钱树本,2014)。在近岸以及珊瑚礁生态系统中, 大型海藻可以通过光合作用将无机碳转化为有机碳, 为上层食物网提供食物和氧气(钱树本, 2014; 杨宇峰, 2016)。大型海藻在生长过程中对无机碳(CO2、HCO-3)的吸收, 还可以加速大气CO2向海水溶入、缓解CO2升高的生态效应(高坤山, 2014); 其对营养盐(N、P等)的吸收, 也可以缓解水体富营养化(黄道建 等,2005; Yang et al, 2015; Cai et al, 2021)。此外, 大型海藻还可以为人类提供食物、医药、工业原料等(杨宇峰, 2016)。因此, 大型海藻在维持海洋生态系统健康和为人类提供生产生活原料中起着不可替代的作用。
在自然环境中, 影响大型海藻生长、生存和分布的理化因子有很多, 其中温度是最重要的环境因子之一(高坤山, 2014; Li et al, 2020)。温度的改变可以改变海藻胞内各种酶类的活性, 影响生理代谢,最终改变其光合作用及生长。研究发现, 温度升高可以提高红藻门(Rhodophyta)、绿藻门(Chlorophyta)和褐藻门(Phaeophyceae)中12 种大型海藻的光合固碳关键酶—核酮糖1-5 二磷酸羧化加氧酶(RubisCO)的活性, 进而提高其光合作用能力(Iñiguez et al,2019); 也有研究证实, 升温可以缓解其他环境因子如高光、低营养盐等对海藻的胁迫效应(吴超元 等,1996; 程丽巍 等, 2010)。因此, 前期的多数研究结果显示, 适度升温可以促进海藻的生长, 提高初级生产力(Zou et al, 2005, 2014; Koch et al, 2013; Li et al, 2020), 也有关于升温与酸化耦合提高红藻龙须菜(Gracilaria lemaneiformis)对阳光紫外辐射敏感性的报道(杨雨玲 等, 2013)。
近年来, 受人类活动向大气中释放过多温室气体的影响, 全球变暖正进一步加剧。海洋吸收了全球90%以上的过剩热能(von Schuckmann et al, 2020),据估测本世纪末表层海水温度将升高2~4 ℃ (IPCC,2014)。海水升温不可避免地会影响海藻的生理、生长和分布(Koch et al, 2013; 高坤山, 2014; 杨宇峰,2016)。与上述缓慢升温相比较, 极端事件如海洋热浪引起的局部升温更为剧烈、幅度更大, 甚至可以超过6 ℃ (Thomsen et al, 2019), 对海藻等生物的影响也更明显(Smale et al, 2019)。如2017—2018 年间,受夏季热浪侵袭引起温度骤升的影响, 新西兰南岛利特尔顿港的大型海藻巨藻(Durvillaea poha)几乎全部死亡, 致使该海域海藻的多样性急剧下降(Thomsen et al, 2019)。同样地, 2011 年夏季期间, 海洋热浪事件使澳大利亚西部海域岩藻(Scytothalia dorycarpa)和昆布(Ecklonia radiata)的生长范围向南部海域大幅缩减(Wernberg et al, 2016); 而类似的生长范围缩减现象也发生于西班牙海域的墨角藻(Fucus serratus)和海条藻(Himanthalia elongata)(Duarte et al, 2013), 这一生态现象背后的直接生理机制值得深入研究。
我国南海珊瑚礁海域的大型海藻资源丰富, 拥有隶属于红藻、绿藻、褐藻等门类的300 余种海藻(Titlyanov et al, 2017)。这些大型海藻在与珊瑚一起为礁栖鱼类、虾蟹类等生物提供丰富食物和良好栖息环境的同时, 也与珊瑚竞争包括光照、营养盐等生长所必需的环境资源(Vergés et al, 2012; 高坤山,2014)。在全球变暖的背景下, 珊瑚白化和死亡事件发生的频率和程度日益增加, 珊瑚礁“藻席化”也愈发严重(Wernberg et al, 2016)。前期已有大量关于升温与南海珊瑚生理生态变化关系的研究(Hughes et al, 2013; Tong et al, 2017; Jiang et al, 2018; Yuan et al,2019; 龙超 等2021), 但有关南海珊瑚礁区海藻的生理生态学的研究相对较少(Lei et al, 2018; Wei et al, 2020), 特别是有关升温对中沙大环礁海藻生理生态学影响的研究还未见报道, 尚不能全面认识升温对该区域珊瑚礁生态系统的影响。中沙大环礁位于我国西沙群岛东南侧, 距离永兴岛约200km, 地理位置极为重要。中沙大环礁长140km, 宽60km,礁坪水深 10~60m, 是中沙群岛的主体, 也是南海诸岛中最大的环礁(沈乃澂, 2013)。本文在比较中沙大环礁区4 种优势海藻生理生态学特征的基础上,研究了升温对其光合生理的影响, 结果有助于认识该珊瑚礁海藻的生理生态现状, 同时也加深升温对该区域海藻生理生态及珊瑚礁生态系统健康影响的认识。
1 材料与方法
1.1 实验区域与样品采集
于2021 年6 月4 日至10 日期间, 搭载“粤霞渔指20027”科学调查船, 在中沙大环礁区(16°02′ N,114° 55′ E)开展实验。本研究的对象是共同生长于中沙大环礁珊瑚礁区的4 种大型海藻, 包括红藻门的厚膜藻(Grateloupia ellipitica)和粉枝藻(Liagora samaensis), 以及绿藻门的钙扇藻(Udotea flabellum)和仙掌藻(Halimeda discoidea)。这4 种海藻均与珊瑚共同生长, 也是我国热带珊瑚礁区的优势种类(Titlyanov et al, 2017)。实验期间, 在现场测定水体温度、盐度等环境因子的同时, 潜水采集共同生长于水深约20m 的4 种海藻, 其中6 月4 日采集了厚膜藻和钙扇藻, 6 月8 日采集了粉枝藻, 6 月10 日采集了仙掌藻。将现场采集的海藻置于黑色塑封袋中(避光), 迅速转移至船舱实验室内取样、处理, 采用下述方法测定藻体色素、蛋白含量和光响应(P-E)曲线。
1.2 环境参数测定
采样区域的海水温度和盐度用多参数水质分析仪(YSI 6600, Yellow Springs Instruments, 美国)测定,光照用光合有效辐射仪(US-SQS/L, ULM-500, Walz,Germany)测定; 同时, 采集不同水深的水样、冷冻保存于-20oC 冰箱, 直至实验室内用营养盐自动分析仪(AA3, Seal Instruments, Germany)测定氮(NO-3+NO-2)、活性磷(PO3-4)以及硅(SiO2-3)的浓度(Song et al,2019)。此外,采样区域空气中的光合有效辐射(photosynthetically active radiation, PAR)用光合有效辐射仪(US-SQS/L, ULM-500, Walz, 德国)测定, 根据PAR 在该水域消光系数 (李刚, 2009)估测海藻在原位接受的光照强度。
1.3 色素和蛋白测定
准确称量0.10g 新鲜藻体, 转移至盛有10mL 甲醇的离心管中并加入少许石英砂研磨至匀浆, 随后转移至于4℃黑暗条件下过夜提取。提取结束后将匀浆取出, 离心10min (5000r·min-1, 4 ℃)后取上清液用紫外可见分光光度计(UV-1800, Shimadzu,Japan)扫描280~750nm 间的吸收光谱。最后, 根据Wellburn (1994)的公式计算叶绿素(Chla) 和类胡萝卜素(Car)含量。
为了测定红藻厚膜藻和粉枝藻的藻红蛋白(PE)和藻蓝蛋白(PC)含量, 准确称取0.20g 新鲜藻体, 转移至10mL 0.10mol·L-1磷酸缓冲液(pH 6.8)中研磨提取。随后, 将提取液在4℃条件下离心10min, 取上清液用分光光度计扫描吸收光谱, 根据 Beer 等(1985)计算藻体的PE 和PC 含量。
为了测定藻体可溶性蛋白含量, 准确称取0.10g 新鲜藻体, 转移至2mL 0.10mol·L-1磷酸缓冲液(pH 6.8)中研磨提取。随后, 将提取液在4℃条件下离心 10min, 取上清液用蛋白分析试剂盒(A045-2-1, 南京建成生物工程有限公司)并根据其使用说明测定蛋白含量。
1.4 光响应(P-E)曲线测定
将原位采集的藻体迅速转移至实验室后, 利用灭菌的医用刀片将藻体切割成2~3cm 藻体段(粉枝藻、钙扇藻和仙掌藻)或藻片(厚膜藻), 并将这些藻体段或藻片置于原位温度、弱光(~10μmol·photons·m-2·s-1)下修复培养30min, 以减轻机械损伤对其生理的影响(Li et al,2021)。随后, 将0.10~0.20g 藻体段或藻片转入体积15mL、温度恒定(环境温度29.5℃和升高温度33.5 ℃)的反应槽中适应20min 后, 分别在8 个光强梯度(0、50 、 100 、 200 、 400 、 800 、 1200 、 1800 和2400μmol·photons·m-2·s-1)下测定反应槽内溶解氧浓度变化, 研究即时升温(4 ℃)对海藻光合放氧速率的影响。反应槽内溶解氧浓度变化用藻类光合仪(YZQ-201A, 翼鬃麒科技有限公司, 北京)测定, 该仪器测定溶解氧浓度的精度为±0.01mg·L-1。同时,该仪器的反应槽底部装有4 个光强可调的LED 灯,可提供强度为0~2500μmol·photons·m-2·s-1的光照;该仪器还装有冷却装置, 可以精确控制反应槽内温度(精度±0.1 ℃)。测定过程中, 为消除溶解氧浓度过高对藻体光合放氧的影响, 调节加入反应槽内海藻的生物量以调节反应槽内溶解氧的初始浓度为~6.5mg·L-1。用光照和黑暗条件下反应槽中溶解氧浓度随时间的变化率(单位: μmol O2·mL-1·h-1)除以加入藻体的鲜重(单位: g FW·mL-1), 计算获得光合放氧速率(Pn,单位: μmol O2·g-1FW·h-1)和呼吸速率(Rd, 单位:μmol O2·g-1FW·h-1)。
1.5 数据分析
根据测得的光响应(P-E)曲线, 用以下公式拟合获得光合参数, 包括光能利用率α[单位: μmol O2g-1FW h-1·(μmol·photons·m-2·s-1)-1]、饱和光强EK(单位:μmol·photons·m-2·s-1)和最大光合放氧速率Pmax(单位: μmol O2·g-1FW·h-1) (Henley, 1993):
其中,E为藻体获得的光照强度。
为了模拟海水升温对海藻日生产力的影响, 利用转化因子(PQ=1.5)将光合放氧转化为净光合固碳(Williams et al, 1979); 然后, 利用以下公式对海藻一天内即日出(sun rise)至日落(sun set)期间光合固碳量随其在原位环境下接受光照E(单位:μmol·photons·m-2·s-1)变化进行积分, 获得单位鲜重海藻的日净光合固碳量PP(单位: mg C·g-1FW·d-1):
用以下公式估测升温对海藻生理参数I(%)的影响:
其中,AT和AT0分别指代升温和环境温度下测得的生理参数。
利用Prism 5 软件(Graphpad Software)作图; 同时, 利用单因素重复测量方差分析(one-way repeated measures ANOVA)对不同光强下的放氧速率进行比较; 利用单因素方差分析(one-way ANOVA)和双因素方差分析(two-way ANOVA)对不同物种和/或不同温度处理的生理参数进行比较, 并进行置后检验(Tukey′s multiple comparison test), 显著水平设为0.05。
2 结果
2.1 理化环境
采样期间, 海水的平均温度为30.02±0.50℃ , 变化范围为29.62~31.03 ;℃ 平均盐度为34.10‰±0.12‰, 变化范围为33.95‰~34.42‰; 温度、盐度随水深的变化不明显。同时, 海水营养盐氮、磷和硅的平均浓度(变化范围)分别为 0.26±0.03μmol·L-1(0.20~0.33μmol·L-1)、0.36±0.03μmol·L-1(0.21~0.39μmol·L-1) 和5.00±0.08μmol·L-1(4.23~5.16μmol·L-1), 营养盐随水深的变化也不明显。海藻在原位珊瑚礁区生长时所接受的光照强度最高(正午时分)可达600μmol·photons·m-2·s-1(图1)。
2.2 生化组分
不同种类的海藻, 其光合色素和可溶性蛋白含量的差异较大(表1)。绿藻钙扇藻和仙掌藻的叶绿素a(Chla)含量分别为0.36±0.068 和0.16±0.034mg·g-1FW, 显著高于红藻厚膜藻和粉枝藻(P<0.01); 同时,绿藻的类胡萝卜素含量也显著高于红藻(P<0.01)。在两种红藻中, 厚膜藻的藻红蛋白含量(0.65±0.021mg·g-1FW)显著高于粉枝藻(P<0.01), 而藻蓝蛋白含量(0.004±0.003mg·g-1FW)则显著低于粉枝藻(P<0.05)。就蛋白含量而言, 钙扇藻的最高, 为5.17±0.53mg·g-1FW; 厚膜藻、粉枝藻和仙掌藻蛋白含量的种间差异不明显, 为 1.22±0.085mg·g-1FW。
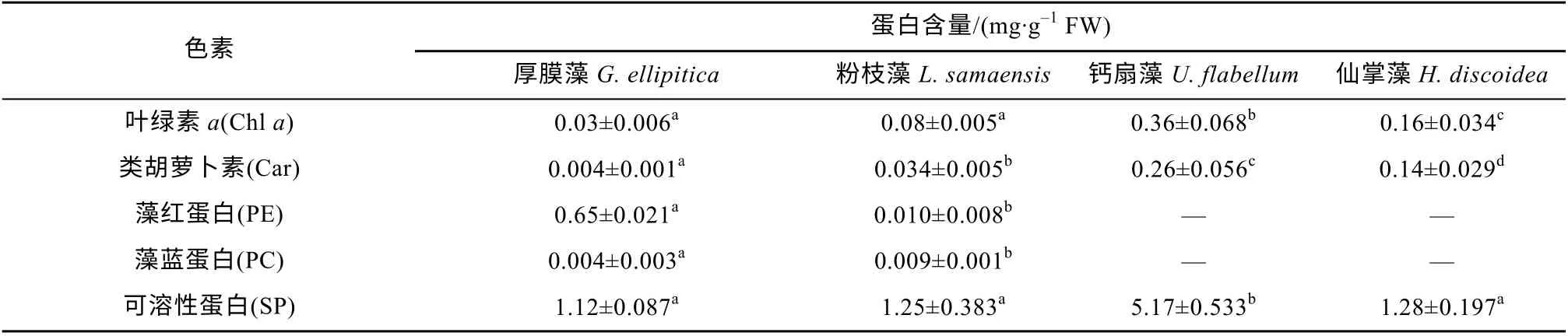
表1 4 种大型海藻藻体色素与蛋白含量Tab. 1 Pigments of chlorophyll a (Chl a), carotenoids (Car), phycoerythrin (PE), phycocyanin (PC), and soluble proteins (SP) contents (mg·g-1 FW) in G. ellipitica, L. samaensis, U. flabellum, and H. discoidea. Shown are the mean and standard deviation of three or four independent measurements (n=3 or 4)
2.3 生理特征及升温效应
不同海藻的光合放氧速率随光照强度的变化也不同(图2)。总体上, 粉枝藻的光合放氧速率最高( 图 2b), 仙掌藻的最低( 图 2d); 在光强<2000μmol·photons·m-2·s-1时, 4 种海藻的光合速率均未呈现出明显的光抑制。海水升温, 在光强较低时(<1000μmol·photons·m-2·s-1)显著提高两种红藻的光合放氧速率(P<0.05), 在光强较高时(>1000μmol·photons·m-2·s-1)则显著降低其光合放氧速率(P<0.05)(图2a、b); 对两种绿藻而言, 温度升高显著提高它们的光合放氧速率(P<0.05), 光强变化对该效应的影响不显著(图2c、d)。
在原位温度下, 4 种海藻的光能利用效率(α)的种间差异不明显, 平均为0.14±0.02μmol O2g-1FW h-1·(μmol·photons·m-2·s-1)-1(图3); 温度升高分别使厚膜藻、粉枝藻、钙扇藻和仙掌藻的α提高了226%、111%、34%和58%。然而, 在原位温度下, 4 种海藻饱和光强(EK)的种间差异显著(F(3,8)=142,P<0.001),其中粉枝藻的EK最高(529±41μmol·photons·m-2·s-1),仙掌藻的最低(119±13μmol·photons·m-2·s-1); 升温分别使红藻粉枝藻和厚膜藻的EK降低57%和65%, 但对绿藻钙扇藻和仙掌藻的影响不显著(图3)。同样地,4 种海藻的最大光合放氧速率(Pmax)也存在极为显著的种间差异(F(3,8)=550,P<0.001), 粉枝藻的Pmax最高(80±3.2μmol O2·g-1FW·h-1)、仙掌藻的最低(12±0.8μmol O2·g-1FW·h-1); 升温对粉枝藻和厚膜藻的Pmax影响不显著, 但分别使钙扇藻和仙掌藻的Pmax提高了25%和41%。
与EK和Pmax类似, 4 种海藻的补偿光强EC的种间差异也极为显著(F(3,8)=132,P<0.001), 其中厚膜藻的EC最低(4.0±0.60μmol·photons·m-2·s-1)、仙掌藻的最高(65±7.1μmol·photons·m-2·s-1); 温度升高分别使厚膜藻和粉枝藻的EC提高了143%和185%, 但对钙扇藻和仙掌藻的影响不显著(图4)。
原位温度下, 4 种海藻的呼吸速率(Rd)也存在显著种间差异(F(3,8)=11.3,P<0.005), 其中厚膜藻的Rd最低(0.56±1.91μmol O2·g-1FW·h-1)、仙掌藻的最高(7.89±0.76μmol O2·g-1FW·h-1); 升温分别使厚膜藻、粉枝藻、钙扇藻和仙掌藻的Rd提高720%、487%、34%和58% (图5)。
在原位温度下, 4 种海藻每天的净光合固碳量PP 也存在显著的种间差异(F(3,8)=33.2,P<0.005), 其中粉枝藻的PP 最高(6.44±0.50mg C·g-1FW·d-1), 仙掌藻的最低(3.31±0.37mg C·g-1FW·d-1); 升温分别使厚膜藻、粉枝藻、钙扇藻和仙掌藻的PP 提高59%、58%、34%和41% (图6)。
3 讨论
3.1 四种海藻的生化组分比较
不同门类的大型海藻, 即使是生活在同一生境中其生化组分的差异也较大, 如绿藻(钙扇藻和仙掌藻)的Chla含量是红藻(厚膜藻和粉枝藻)的2~12 倍,类胡萝卜素含量是红藻的4~60 倍; 同属于绿藻门的钙扇藻和仙掌藻之间, 它们的色素及蛋白含量也存在较大差异(表1), 这种生化组分的差异通常被认为与不同海藻对光照、温度和营养盐等环境因子变化的适应性不同有关(周百成 等, 1974; 黄道建 等,2005; 丁兰平 等, 2011)。与高等植物一样, 位于海藻叶绿体类囊体膜上的光合色素(如Chla)的主要功能是捕获光能, 并将光能传递给光反应中心, 以驱动ATP 和NADPH 等的合成和CO2的固定(高坤山,2014); 而类胡萝卜素除了具有捕获和传递光能的功能之外, 还具有清除累积于海藻胞内活性氧自由基(如1O2、O-2和H2O2)、保护细胞器免受氧化损伤的功能(高坤山, 2014)。因此, 类胡萝卜素含量较高的红藻, 如长珊瑚藻(Corallina elongata)对环境胁迫的耐受性通常会更强(Esteban et al, 2009)。此外, 红藻藻体不仅含有叶绿素和类胡萝卜素, 还含有藻胆素(表1) (周百成 等, 1974)。藻胆素包括藻红蛋白和藻蓝蛋白, 是红藻光系统捕光色素复合体的重要组成部分之一, 可以辅助光系统捕获、传递光能, 驱动光合过程(高坤山, 2014); 因此, 与绿藻相比, 尽管红藻的叶绿素和类胡萝卜素含量均较低, 但其光合能力却接近甚至高于绿藻(图2)。除了色素含量的差异以外, 不同种类海藻的蛋白含量也存在较大差异,如钙扇藻的可溶性蛋白含量是其余3 种藻的4~5 倍(图2)。蛋白是藻体内酶类的主要组成部分, 在参与胞内各种生理代谢及抵抗环境胁迫中起着重要作用(高坤山, 2014; Cai et al, 2021); 同时, 一些蛋白还可以作为储存于藻体的氮源, 在氮匮乏时以补充藻体对氮源需求, 维持其正常的生命活动(McGlathery et al, 1996)。因此, 与另外3 种海藻相比, 蛋白含量较高的钙扇藻更适应在营养盐(包括氮)浓度较低的中沙大环礁珊瑚礁区生存和生长。
3.2 4 种海藻生理特征比较及升温效应
不同海藻的生化组分不同, 其生理特征也存在较大差异, 如红藻的补偿光强显著低于绿藻(图4),这可能与其同时含有叶绿素、类胡萝卜素等光合色素及藻胆素等特征色素有关(周百成 等, 1974; 高坤山, 2014)。藻胆素是红藻的特有色素, 可以辅助光系统更有效地捕获光能, 使红藻的光补偿点更低,适于低光环境中生存、生长(Lei et al, 2018), 这与自然环境中红藻多分布于水深更深的潮下带相一致(丁兰平 等, 2011)。前期, 章守宇 等(2018)在比较我国浙江枸杞岛海域6 种大型海藻的光合特性时发现, 绿藻的光合能力显著高于红藻, 但该结论是基于海藻活体叶绿素荧光, 与本研究结果中红藻光合放氧速率接近甚至高于绿藻相悖(图2)。在环境胁迫如高光、营养盐缺乏、失水等条件下, 基于叶绿素荧光得出的结论往往不能真实反映藻类的光合能力(Hughes et al, 2018; 蔡逸洵 等, 2021), 这可能是造成这种结论差异的原因之一。另外, 红藻的呼吸速率仅为绿藻的7%~30% (图4), 可能与红藻固碳关键酶RubisCO 对CO2的选择性远高于对O2的选择性有关(Badger et al, 1998), 高CO2选择性维持了高CO2保留率和低呼吸率。因此, 尽管多数红藻不像绿藻那样拥有 CO2浓缩机制(CO2-concentrating mechanism, CCM) (Koch et al, 2013; 高坤山, 2014),但RubisCO 对CO2的高亲和性反过来也会降低其对光合产物的呼吸消耗, 从而维持更高的净光合能力。
温度升高可以通过改变胞内酶活性来影响生理代谢, 最终改变海藻的光合能力、生长及分布(高坤山, 2014)。同时, 不同种类的海藻因胞内生化组分和含量等不同而对升温的生理响应存在较大差异(周百成 等, 1974; 杨雨玲 等, 2013), 如升温会降低绿藻的饱和光强, 却提高了红藻的最大光合放氧速率,同时升温对前者的最大光合放氧速率和后者的饱和光强的影响均不显著; 尽管升温对红藻和绿藻的光能利用率均有促进效应, 但对前者的影响更大(图4)。升温对光合作用的促进效应也在多种大型海藻中得以证实, 包括绿藻砺菜(Ulva conglobata) (Li et al, 2020)、蕨藻(Caulerpa lentillifera) (Cai et al, 2021),红藻龙须菜(Gracilariopsis lemaneiformis) (Zou et al,2014)和褐藻羊栖菜(Hizikia fusiforme) (Zou et al,2005)等。
前期研究显示, 一定范围的海水升温(4~10 ℃)会提高海藻的呼吸速率(Koch et al, 2013), 同时也提高光合作用相关酶类如RubisCO 的活性(Iñiguez et al, 2019), 进而提高藻体内光合作用产物的积累(图6)。当升温对光合固碳的促进效应超过其对呼吸消耗的促进效应时, 会加速藻体内碳的净累积,促进海藻生长(Zou et al, 2005, 2014)。通常, 维持热带海域的大型海藻光合作用的最适温度范围为27~33 ℃, 接近其生长所需的最适温度(Koch et al,2013)。尽管本研究所设置的升温幅度为 4 ℃(29.5→33.5 ℃), 但升温后的温度仍在维持海藻光合作用与生长的最适温度范围之内(Koch et al,2013), 因此这一升温幅度仍有利于海藻在原位环境中光合产物的净累积(图6)。另外, 考虑原位升温实验的可操作性以及室内长期培养实验对原位环境的改变, 即时升温效应研究(Li et al, 2020), 包括本研究所探讨的升温效应在某种程度上可以反映藻类在原位环境中对升温的生理响应与适应。鉴于不同海藻对升温的生理响应与适应性不同, 极端环境事件如海洋热浪引起的短期海水升温可能会改变大型海藻的种群结构, 影响其生物地理分布格局(Wernberg et al, 2016)。
4 结论
本研究发现, 中沙大环礁的4 种大型海藻的色素及蛋白含量差异较大, 绿藻钙扇藻和仙掌藻的叶绿素和类胡萝卜素含量高于红藻厚膜藻和粉枝藻;钙扇藻的蛋白含量最高, 其余3 种藻的蛋白含量差异不显著。粉枝藻的光合放氧速率最高, 仙掌藻的最低, 但二者呼吸速率的差异不显著。温度升高会抑制或促进红藻的光合放氧, 该抑制或促进效应取决于光强的高低; 升温促进绿藻的光合放氧, 该效应与光强变化无关。我们还发现, 升温提高4 种海藻的光能利用率、呼吸速率和光补偿点, 以及其在原位环境中的日净光合固碳量; 升温降低红藻的饱和光强, 提高绿藻的光合放氧速率。综上所述, 即时升温(~4 ℃)有利于中沙大环礁海藻的光合作用, 与绿藻相比更有利于红藻。

