p38/JNK MAPK信号通路对MEHP致小鼠睾丸间质细胞凋亡的影响
黄金瑞,李 玲,德小明,李丽萍,宋贝贝,郭晓英,马慧颖
(1.宁夏医科大学公共卫生与管理学院职业卫生与环境卫生学系,宁夏环境因素与慢性病控制重点实验室,生育力保持教育部重点实验室,银川 750004;2.陕西省富平县疾病预防控制中心,富平 711700)
邻苯二甲酸酯(phthalates,PAEs)是一类环境内分泌干扰物,常作为增塑剂被广泛用于食品包装、玩具、化妆品、医疗器械、装修材料等。邻苯二甲酸二(2-乙基)己酯[(Di(2-ethyl)hexyl phthalate,DEHP]是应用最为广泛的增塑剂之一,占国产PAEs的80%[1]。调查发现,DEHP是宁夏地区环境中主要的PAEs[2]。DEHP主要经呼吸道、消化道和皮肤接触途径进入机体,在体内进一步转化为邻苯二甲酸单(2-乙基己基)酯(mono-(2-ethylhexyl)phthalate,MEHP)对机体产生各种毒性作用[3],其对生殖能力的毒性引起了人们广泛关注[4]。已有实验证实[5],活性氧(ROS)水平升高可以上调p-p38 MAPK、p-JNK及Caspase-3等凋亡相关蛋白的表达,诱导细胞凋亡。本实验通过观察p38 MAPK抑制剂SB203580和JNK抑制剂SP600125对MEHP染毒致小鼠睾丸间质(TM-3)细胞凋亡情况,探讨p38/JNK MAPK信号通路对MEHP致TM-3细胞凋亡的影响及其作用机制,为研究MEHP产生雄性生殖毒性机制提供理论基础。
1 材料与方法
1.1 主要仪器与试剂
主要仪器:HF90 CO2培养箱(上海力申科学仪器有限公司,中国),高压蒸汽灭菌器(TOMY公司,日本),SW-CJ-1CU超净工作台(苏州安泰空气技术有限公司,中国),正倒置一体显微镜(ECHO公司,美国),Neofuge15R高速冷冻离心机(上海力申科学仪器有限公司,中国),全波长酶标仪(PerkinElmer公司,美国),流式细胞仪(BD公司,美国),凝胶成像仪(Thermo Fisher Scientific公司,新加坡)。
主要试剂:TM-3细胞株(ATCC细胞研究中心,美国),MEHP标准品(纯度为97%,Sigma公司,美国),SP600125、SB203580(Med Chem Express公司,美国),DMEM培养基、胰酶、青链霉素混合液、胎牛血清(Gibco公司,美国),CCK-8法细胞增殖检测试剂盒、Annexin V-FITC/PI凋亡试剂盒(上海贝博生物科技有限公司,中国),ROS检测试剂盒、全蛋白提取试剂盒、BCA蛋白检测试剂盒及凝胶配制试剂盒(南京凯基生物技术股份有限公司,中国),Caspase-9、Caspase-3、p38、JNK、p-p38、及p-JNK抗体(Cell Signaling Technology公司,美国)。
1.2 TM-3细胞培养和实验分组
用含10%胎牛血清和100 IU·L-1青链霉素的DMEM培养液在5%CO2、37℃的培养箱中培养TM-3细胞,选择对数生长期细胞进行实验。课题组前期已经通过CCK-8法实验确定MEHP低、中、高剂量[3]。实验分为对照组和MEHP低、中、高剂量组分别给予终浓度为0、200、400,800μmol·L-1的MEHP,SB203580干预组给予终浓 度 为10μmol·L-1SB203580+400μmol·L-1MEHP,SP600125干预组给予终浓度为10μmol·L-1SP600125+400μmol·L-1MEHP,继续培养24 h后进行相关检测。
1.3 CCK-8法检测TM-3细胞活性
将处于对数生长期的TM-3悬液在细胞计数器上计数,配制成1×105/mL的细胞悬液,接种于96孔板。96孔板设置空白组、对照组和实验组,空白组加入100μL/孔的培养液,对照组和实验组中每孔加入细胞悬液100μL,培养24 h后实验组分别加入浓度为0、5、10、20、40μmol·L-1的SB203580,0、2.5、5、10、20μmol·L-1的SP600125及0、400μmol·L-1的MEHP、SB203580(10μmol·L-1)+MEHP(400μmol·L-1)、SP600125(10μmol·L-1)+MEHP(400μmol·L-1)培养24 h,后每孔加入10μL CCK-8试剂,37℃培养箱培养1 h左右,用酶标仪450 nm波长处测吸光度(A)值,当对照组A接近1时,用其值计算细胞增殖率,细胞增殖率(%)=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
1.4 光学显微镜观察TM-3细胞形态学
将对数生长期的TM-3细胞以1×105/mL接种至6孔培养板,置于培养箱中培养至细胞贴壁70%左右,倒掉培养基,每孔各加入完全培养基(对照)、200、400、800μmol·L-1的MEHP溶液2 mL,10μmol·L-1SB203580+400μmol·L-1MEHP及10μmol·L-1SP600125+400μmol·L-1MEHP溶液放入培养箱培养24 h后,光学显微镜下观察TM-3细胞形态并拍照。
1.5 Annexin V-FITC/PI法检测及荧光探针DCFH-DA法分别检测TM-3细胞凋亡率及ROS水平
将对数生长期的TM-3细胞以1×105/mL接种于60 mm培养皿,贴壁后倒掉原液,对应培养皿加入0、200、400、800μmol·L-1MEHP、10μmol·L-1SB203580+400μmol·L-1MEHP及10μmol·L-1SP600125+400μmol·L-1MEHP 3 mL放入培养箱培养24 h后,用不含EDTA胰酶消化并收集细胞,分别依照Annexin V-FITC/PI试剂盒说明书和ROS检测试剂盒说明书检测TM-3细胞的凋亡率及细胞内ROS水平。
1.6 免疫印迹法检测TM-3细胞相关蛋白表达
将对数生长期的TM-3细胞以1×105/mL接种于100 mm培养皿,分别给予完全培养基(对照)及200、400、800μmol·L-1MEHP、10μmol·L-1SB203580+400μmol·L-1MEHP及10μmol·L-1SP600125+400μmol·L-1MEHP溶液后放入培养箱培养24 h,用刮刀在培养皿底刮下细胞,离心。根据全蛋白提取盒说明书破碎细胞,离心收集上清,检测蛋白浓度,加入1/5体积的5×Buffer及Lysis Buffer,配平蛋白质量,100℃板上进行蛋白变性,按照凝胶配制试剂盒说明书配制凝胶,电泳、切胶、转膜、漂洗、封膜、孵育一抗、孵育相应的二抗;采集图像并用Image J软件进行灰度分析。
1.7 统计学方法
数据采用SPSS 25.0统计学软件进行分析,每个实验至少重复3次,计量资料以均数±标准差(±s)表示,行单因素方差分析,进一步两两比较用LSD-t法。P≤0.05为差异有统计学意义。
2 结果
2.1 抑制p38/JNK MAPK信号通路对TM-3细胞增殖的影响
CCK-8法分别检测不同浓度(0、5、10、20、40μmol·L-1)SB203580及不同浓度(0、2.5、5、10、20μmol·L-1)SP600125对TM-3细胞增殖的影响。随着SB203580和SP600125浓度的增加,TM-3细胞的增殖呈先增后减趋势,与对照组相比差异均无统计学意义(P均>0.05),确定抑制剂组干预剂量分别为10μmol·L-1SB203580和10μmol·L-1SP600125。与中剂量组比较,SB203580干预组及SP600125干预组细胞增殖率均增加(P均<0.05),见表1和表2。
表1 不同浓度SB203580及SP600125对TM-3细胞增殖的影响(n=3,±s)
SB203580浓度/(μmol·L-1) SP600125浓度/(μmol·L-1) 细胞增殖率/%0 0 100.00±0.00 2.5 82.84±16.07 10 5 84.77±6.88 20 10 92.17±9.86 40 20 83.06±9.41 P值 P值 >0.05 5细胞增殖率/%100.00±0.00 88.23±3.94 96.93±12.80 92.06±10.7 85.60±5.18>0.05
表2 不同组TM-3细胞增殖率变化(n=3,±s)
与对照组比较*P<0.05;与中剂量组相比#P<0.05。
分组 分组 细胞增殖率/%对照组 对照组 100.00±0.00 SB203580干预组 SP600125干预组 70.16±2.22*#中剂量组 中剂量组 65.00±2.00*P值 P值 <0.05细胞增殖率/%100.00±0.00 80.57±8.00*#67.96±7.84*<0.05
2.2 抑制p38/JNK MAPK信号通路对TM-3细胞形态的影响
对照组TM-3细胞大多为梭形或多边形贴壁生长,低剂量组细胞间隔增大,少量细胞变圆;中剂量组细胞间缝隙进一步增大,大量细胞水肿变圆呈露水状;高剂量组细胞大多数为圆形,贴壁细胞数量明显减少。
与中剂量组相比,SB203580干预组少量细胞变圆,细胞间隔减小,皱缩和圆形坏死细胞明显减小;SP600125干预组圆形细胞较少,细胞间隔稍有减小,见图1。
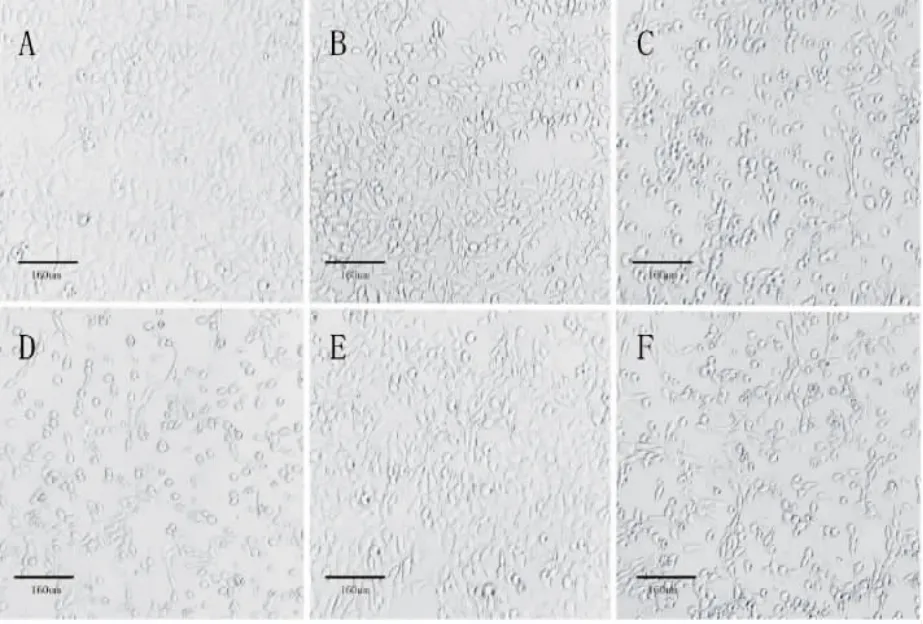
图1 各组TM-3细胞形态学变化的光镜图(×100)
2.3 抑制p38/JNK MAPK信号通路对TM-3细胞凋亡和ROS水平的影响
与对照组相比,MEHP各染毒组TM-3细胞的凋亡率和ROS水平均升高(P均<0.05),且随着MEHP染毒剂量的升高,TM-3细胞的凋亡率和ROS变化越显著(P<0.05)。
与中剂量组相比,SB203580干预组和SP600125干预组TM-3细胞凋亡率和ROS水平均降低(P<0.05),见表3和图2、图3。

图2 各组TM-3细胞凋亡的检测流式图
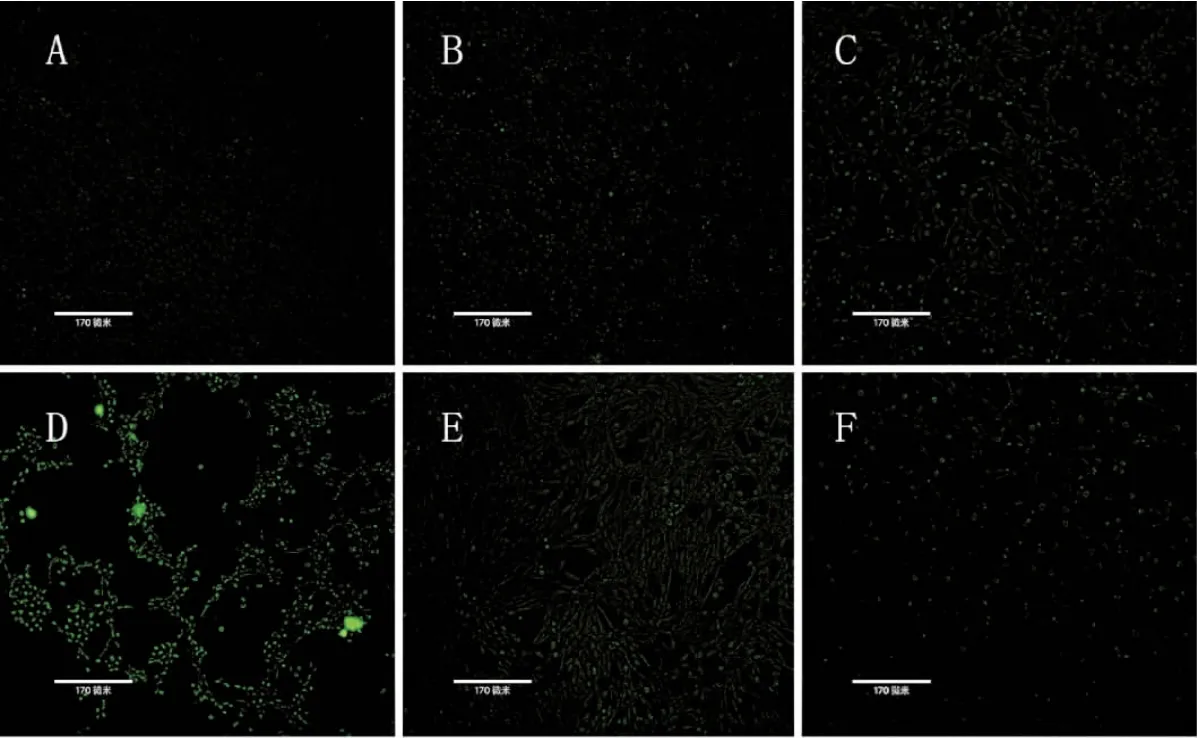
图3 各组TM-3细胞ROS表达的荧光检测图(×100)
表3 各组TM-3细胞凋亡率和ROS水平变化(n=3,±s)
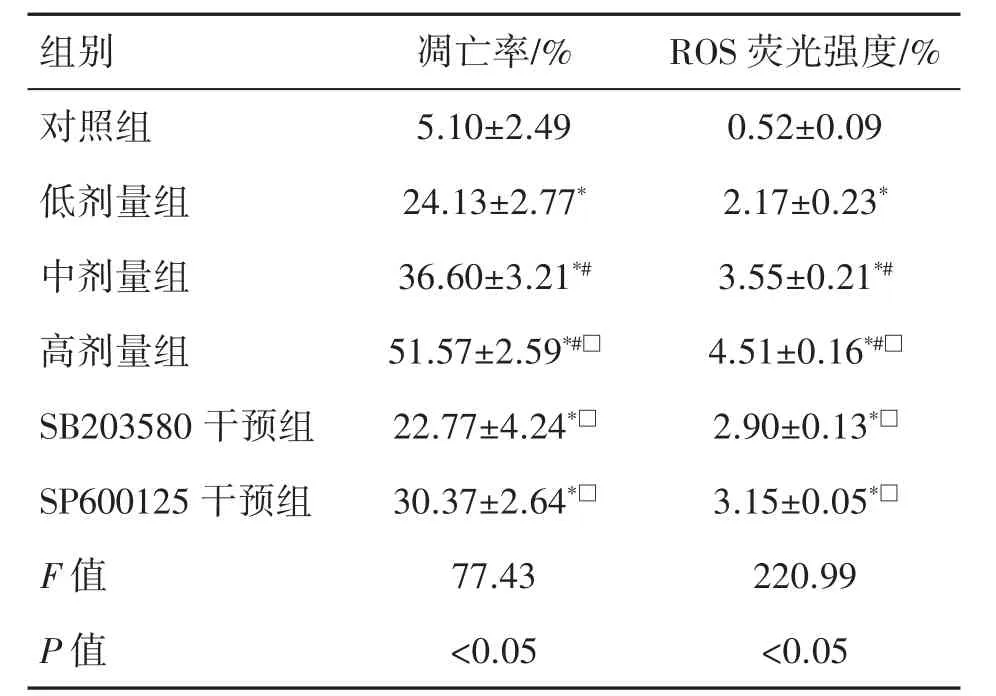
表3 各组TM-3细胞凋亡率和ROS水平变化(n=3,±s)
与对照组比较*P<0.05;与低剂量组相比#P<0.05;与中剂量组相比□P<0.05。
组别 凋亡率/% ROS荧光强度/%对照组 5.10±2.49 0.52±0.09低剂量组 24.13±2.77* 2.17±0.23*中剂量组 36.60±3.21*# 3.55±0.21*#高剂量组 51.57±2.59*#□ 4.51±0.16*#□SB203580干预组 22.77±4.24*□ 2.90±0.13*□SP600125干预组 30.37±2.64*□ 3.15±0.05*□F值 77.43 220.99 P值 <0.05 <0.05
2.4 抑制p38/JNK MAPK信号通路对TM-3细胞p38、p-p38、JNK、p-JNK、Caspase-9及Caspase-3蛋白表达的影响
与对照组相比,MEHP各染毒组TM-3细胞内p38和JNK蛋白的表达水平差异均无统计学意义(P均>0.05);p-p38、p-JNK、Caspase-9和Caspase-3蛋白的表达水平均升高(P均<0.05),且随着MEHP染毒剂量的升高,细胞内p-p38、p-JNK、Caspase-9和Caspase-3蛋白的表达水平均呈逐渐上升的趋势,见图4。

图4 MEHP作用TM-3细胞后相关蛋白表达水平图
与中剂量组相比,SB203580干预组细胞内p38蛋白的表达水平差异无统计学意义(P>0.05),p-p38蛋白表达水平下降(P<0.05);SP600125干预组细胞内JNK蛋白的表达水平差异无统计学意义(P>0.05),p-JNK蛋白表达水平下降(P<0.05);SB203580干预组及SP600125干预细胞凋亡蛋白Caspase-3和Caspase-9表达水平均下降(P均<0.05),见图5和图6。
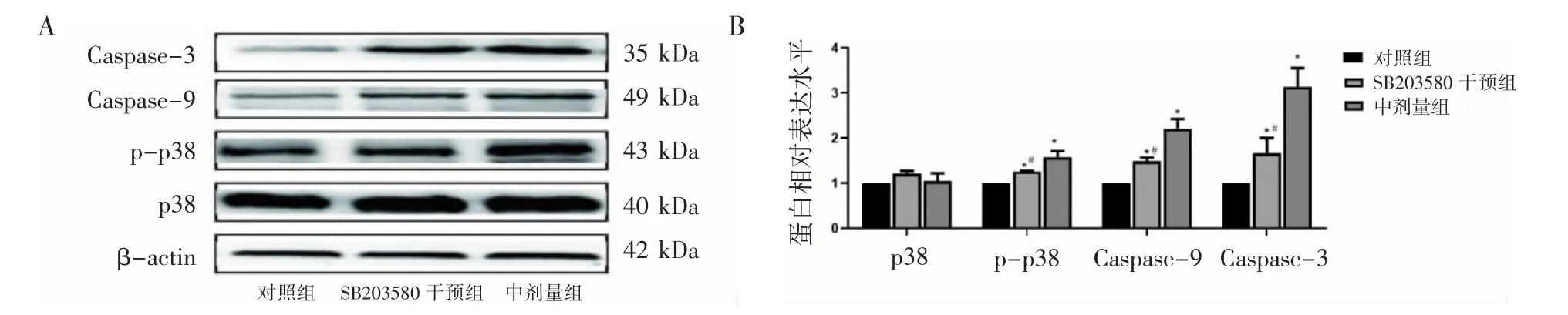
图5 抑制p38 MAPK信号通路TM-3相关蛋白表达水平比较
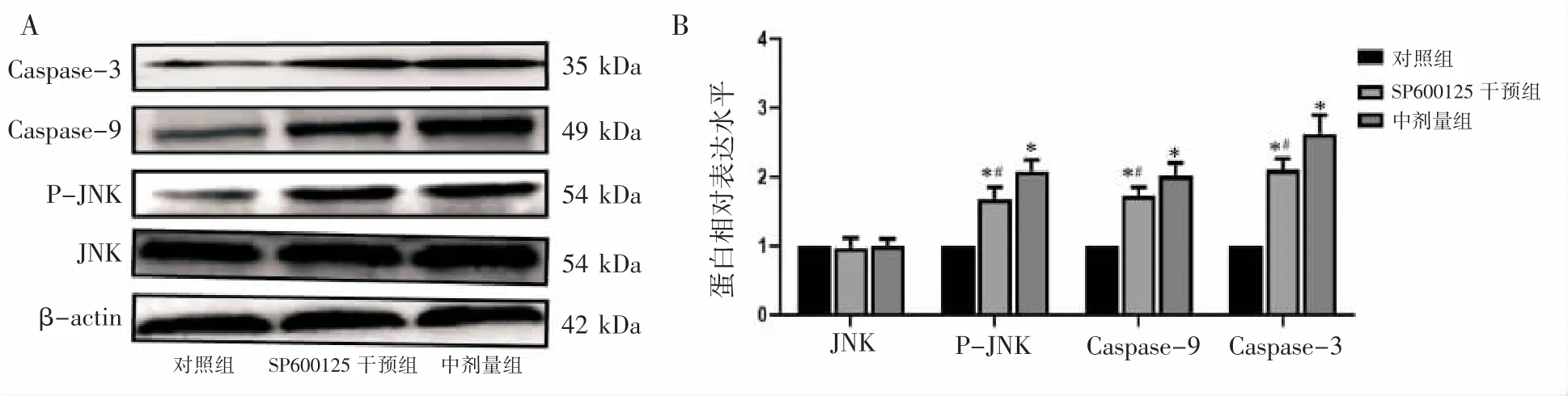
图6 抑制JNK MAPK信号通路TM-3相关蛋白表达水平比较
3 讨论
TM-3细胞的主要作用是合成和分泌雄激素。雄激素的主要功能是调节精子生成及生殖行为。研究TM-3细胞增殖和凋亡分子机制对于理解精子的生成及雄性不育等意义重大[6]。PAEs产生生殖毒性作用主要机制之一是氧化应激[7]。
细胞中ROS来源有内源性和外源性两种,其中化学毒物、炎性细胞因子及紫外线电离等形成外源性ROS。低水平ROS主要作用是调节细胞存活信号,过量ROS会诱导氧化应激,致使氧化损伤,如组织损伤及蛋白质变性等[8]。多种疾病的发生发展和细胞凋亡与氧化应激有关[9]。已有研究发现过量ROS诱导细胞凋亡及MAPK活化[10]。过量ROS可启动p38和JNK通路,继而致使细胞中其他促凋亡蛋白表达水平增高[11-12]。本实验结果表示,MEHP染毒可使TM-3细胞凋亡率升高,且凋亡率随MEHP染毒剂量的升高而升高;TM-3细胞ROS水平随MEHP染毒剂量的升高呈剂量依赖式升高,提示MEHP染毒可引起TM-3细胞氧化应激,诱导细胞凋亡。
p38及JNK是丝裂原活化蛋白激酶MAPK的主要家族成员,在哺乳类动物细胞内表达广泛,可被不同的细胞外刺激启动[13],后将细胞质的信号传达至细胞核使细胞核发生变化。p38 MAPK及JNK信号通路在细胞凋亡过程中发挥着重要作用,p38及JNK的表达改变,可以有效调控主要的信号通路,控制细胞凋亡[14]。
目前,p38及JNK促细胞凋亡的分子机制还未完全阐明,p38主要通过激活下游的Caspase来促使细胞凋亡[15]。JNK通过磷酸化Bcl-2及Bcl-xl,使线粒体释放细胞色素C至胞浆,与Caspase-9结合,启动Caspase级联反应,最终作用于Caspase-3,激活的Caspase-3与凋亡底物结合导致细胞凋亡[16]。
Eun等[17]研究发现辣木果实可使黑色素瘤A2058细胞ROS水平显著升高,引起氧化应激,诱导MAPK级联被依次激活,主要包括生长因子调控的细胞外信号调节激酶(extracellular-sig-nalregulated kinase1/2,ERK1/2)、JNK、p38,最终诱导心肌细胞凋亡。徐怡等[18]研究发现胡桃醌能引起口腔鳞癌Tac8113细胞凋亡率和ROS明显增加,p38和JNK蛋白表达变化不明显,p-p38、p-JNK和Caspase-3蛋白表达显著增加。Lu等[19]发现姜黄素类似物GO-Y078通过激活JNK和p38信号通路诱导人骨肉瘤细胞凋亡,Caspase-3、Caspase-8、Caspase-9、p-p38和p-JNK等凋亡蛋白水平升高。有研究[20]表明,二氧化钛纳米颗粒能上调小鼠睾丸支持细胞(TM-4)ROS水平,启动p38 MAPK信号通路,致使TM-4凋亡率、p-p38等相关蛋白表达的升高,加入p38 MAPK的抑制剂SB203580,TM-4细胞损伤情况均被逆转。本研究结果显示,MEHP染毒后,与对照组相比,TM-3细胞内p38和JNK蛋白的表达水平差异无统计学意义;Caspase-3、Caspase-9、p-p38及p-JNK蛋白浓度均增加,随着MEHP染毒浓度的增加,细胞内p-p38、p-JNK、Caspase-9和Caspase-3蛋白的表达水平均逐渐上升。用抑制剂SB203580进行干预p38 MAPK信号通路后,TM-3细胞ROS水平及凋亡率均降低,提示MEHP可通过p38 MAPK信号通路诱导TM-3细胞发生氧化应激和凋亡。SB203580抑制p38 MAPK活性,阻止下游靶点磷酸化,但不能改变p38 MAPK的表达水平[21]。本研究结果也发现SB203580使TM-3细胞的p-p38蛋白表达降低,但p38蛋白表达水平变化不明显,验证了p38 MAPK抑制剂SB203580对p-p38具有抑制功效。凌春美[22]研究发现纳米二氧化钛可使细胞中p-JNK、Caspase-9和Caspase-3蛋白表达水平升高,诱导TM-4凋亡。当JNK的抑制剂SP600125和纳米二氧化钛共同作用于细胞时,与纳米二氧化钛组相比,SP600125干预后的细胞凋亡率下降,p-JNK、Caspase-9和Caspase-3蛋白表达明显下降。JNK特异性抑制剂SP600125可显著降低JNK活化的c-Jun氨基末端激酶磷酸化,阻止JNK介入的氧化应激、细胞凋亡。本研究结果发现MEHP染毒致TM-3的凋亡率高于对照组,p-JNK、Caspase-9和Caspase-3的蛋白表达水平高于对照组,给予SP600125和MEHP共同作用于TM-3细胞时,细胞凋亡率及p-JNK、Caspase-9、Caspase-3的表达水低于MEHP染毒组,提示MEHP可通过JNK MAPK信号通路诱导TM-3细胞凋亡。
综上,MEHP可能通过上调TM-3细胞ROS水平,磷酸化激活p38 MAPK和JNK,激活的p38 MAPK和JNK进一步激活下游的Caspase-9和Caspase-3诱导TM-3细胞凋亡。通过抑制p38/JNK MAPK信号通路能抑制MEHP染毒所致的TM-3细胞凋亡,缓解MEHP染毒所致的TM-3细胞损伤,为进一步阐明PAEs雄性生殖毒性机制提供了实验依据。

