乳腺钙化在乳腺钼靶诊断中的应用准确性探讨
陈国梁
(日照市中医医院放射科 山东 日照 276800)
乳腺癌是一种于乳腺或导管上皮发病的恶性肿瘤之一,临床对其病因研究尚未取得统一定论,但有关研究指出[1],不良的生活方式、习惯以及精神刺激、创伤等均为诱发乳腺癌的危险因素。该病早期无显著临床症状,以乳房肿块、皮肤异常等症状较为常见,待疾病发展至中、晚期可见癌细胞扩散、转移并引发多器官病变,危及患者生命安全[2]。因此,临床对于乳腺癌患者应秉持早发现、早诊断、早治疗的原则,以改善患者预后发展。乳腺钼靶在临床诊断乳腺癌中取得了较为广泛的应用,其可清晰观测到早期乳腺癌患者的细小钙化灶,具有较高诊断准确性[3]。基于此,本文选取2017年7月—2020年7月日照市中医医院确诊的50例乳腺病变患者,就乳腺钼靶在乳腺钙化诊断中的临床准确性展开探讨,报道如下。
1 资料与方法
1.1 一般资料
选取日照市中医医院2017年7月—2020年7月收治的乳腺钙化患者50例,患者均经临床病理检查确诊为乳腺钙化病变,根据病变情况分为良性钙化组(n=8,乳腺良性钙化病变)和恶性钙化组(n=42,乳腺恶性钙化病变)。两组患者均为女性,良性钙化组患者年龄38~80岁,平均年龄(54.00±11.66)岁,经病理检查显示3例为纤维腺瘤、1例乳腺纤维囊肿、2例小叶增生、1例叶状肿瘤、1例为炎性病变;恶性钙化组患者年龄38~80岁,平均年龄(52.34±4.88)岁,经病理检查显示1例为导管癌、1例导管原位癌、1例髓样癌、39例为浸润性癌。两组患者基本资料比较无显著差异(P>0.05),具可比性。患者及家属均知情本试验并签署知情同意书。纳入标准:①患者均经病理组织检查确诊为乳腺钙化;②患者均无交流沟通障碍;③依从性良好,配合此次研究者。排除标准:①合并脏器类疾病程度严重者;②合并精神系统严重障碍者;③合并认知、意识功能障碍者。
1.2 方法
给予所有患者乳腺钼靶检查,检查设备为数字乳腺钼靶机(HOLOGIC,型号:SDM170100101 SDM-00001-2),乳腺扫描位置依据病变部位开展,嘱患者取坐位或立位,对患者双乳轴位及内外斜位进行扫描,必要时可加拍患者双乳切线位,并对局部施压后进行放大摄影。检查所获得图像均由经验丰富的影像人员进行阅片,观察并记录钙化病灶的化学性质及物理特征,对两组患者的观察结果进行分析比较,同时,以腺体组织为标准,将检查结果分为高、等密度两种,若患者钙化密度较乳腺组织的密度呈较高显示,则记为高密度;若患者钙化钼靶片中隐约可见钙化征象,则记为等密度。
1.3 观察指标
观察乳腺钼靶的诊断效能、两种病变的病灶特征及钙化情况。
1.4 统计学方法
采用SPSS 22.0统计软件进行数据处理。计数资料以频数(n)、百分比(%)表示,采用χ2检验;同时采用一致性检验验证检测结果,当Kappa值>0.75时表示检测结果的一致性良好;当Kappa值在0.4~<0.75时表示检测结果的一致性一般;当Kappa值<0.4时则表示检测结果的一致性较差。P<0.05为差异有统计学意义。
2 结果
2.1 乳腺钼靶检查结果与病理结果对比
50例乳腺钙化病变患者行乳腺钼靶检查显示恶性病变为41例,良性病变为9例,见表1。

表1 乳腺钼靶检查结果与病理结果对比 单位:例
2.2 乳腺钼靶的诊断效能分析
乳腺钼靶诊断的准确性为94.00%,特异度为87.50%,灵敏度为95.24%,与病理诊断结果比较无显著差异(P>0.05)。乳腺钼靶的诊断结果与病理结果的一致性较好(Kappa=0.788>0.75)。见表2。
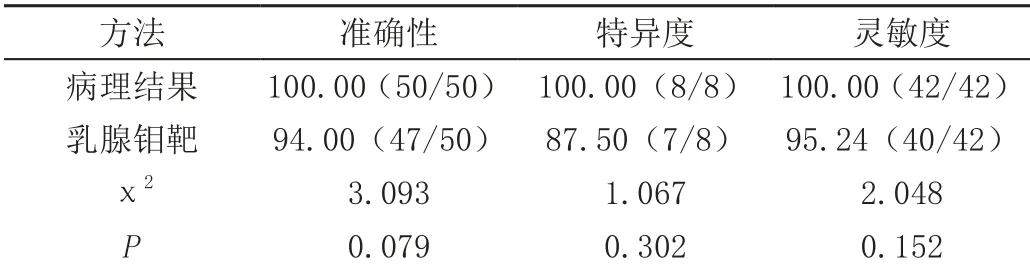
表2 乳腺钼靶诊断效能分析[%(n/m)]
2.3 乳腺钼靶诊断组间病灶特征对比
乳腺钼靶诊断显示,恶性钙化组患者病灶≥1 cm、形态不规则、边缘模糊的检出率均显著高于良性钙化组患者(P<0.05),见表3。
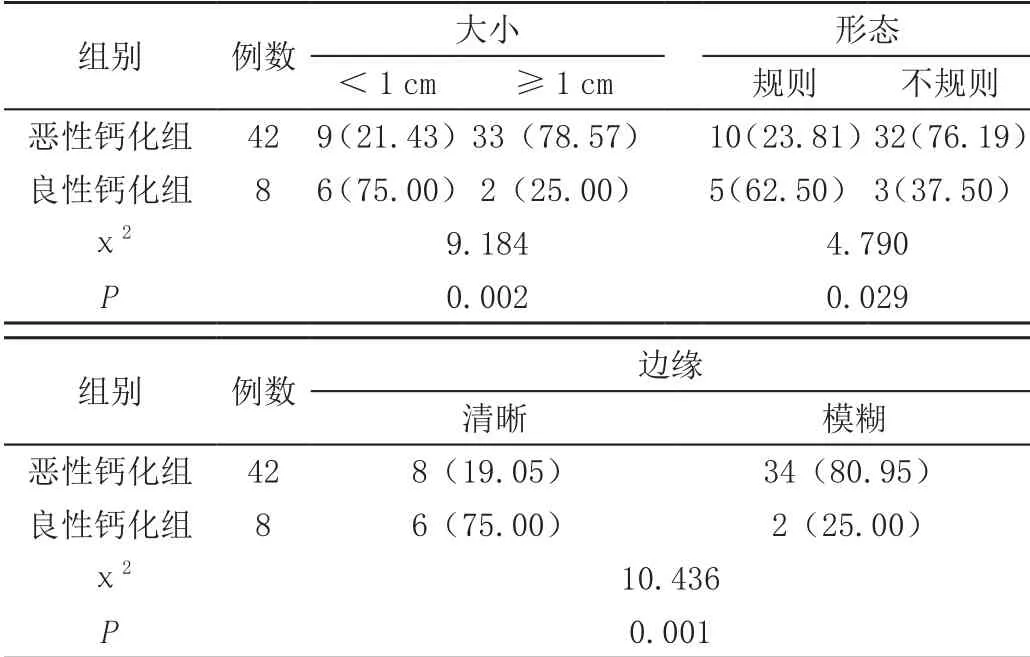
表3 乳腺钼靶诊断组间病灶特征对比[n(%)]
2.4 乳腺钼靶诊断组间钙化情况对比
乳腺钼靶诊断结果显示,恶性钙化组患者钙化数量≥10个/cm²、等密度钙化、节段/线性分布的检出率均显著高于良性钙化组患者(P<0.05),见表4。
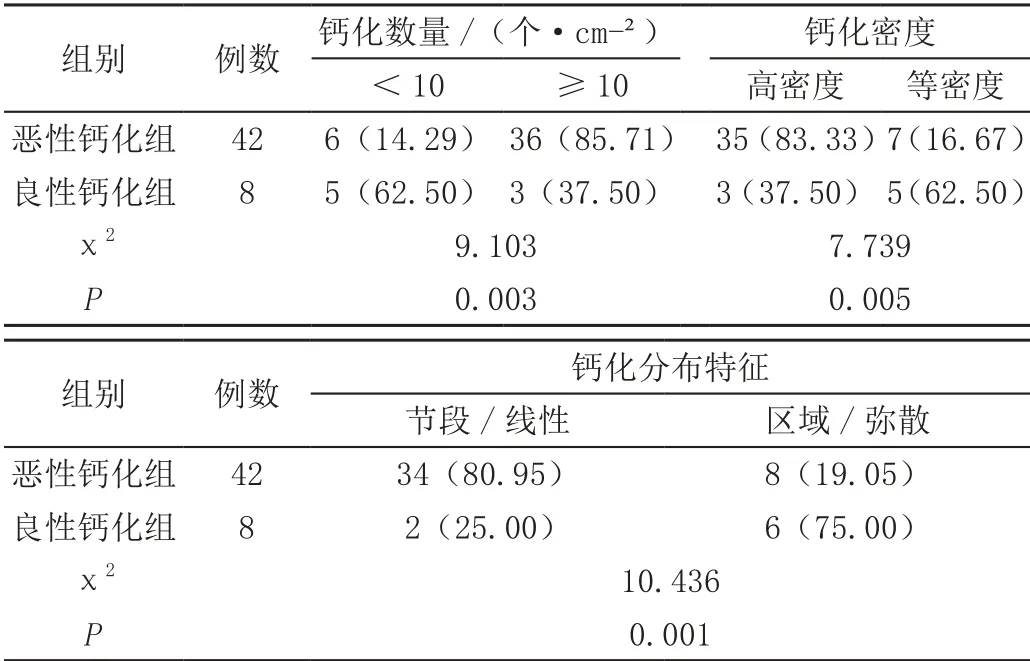
表4 乳腺钼靶诊断组间钙化情况对比[n(%)]
3 讨论
乳腺钼靶成像为临床乳腺疾病诊断的新兴技术之一,其相较于传统乳腺X线摄影而言,对于乳腺疾病的各种组织类型具有较为精准的检出率,可显著提高年轻女性乳腺癌的检出率以及准确性,阳性预测值较高[4]。此外,乳腺钼靶成像技术可对乳腺癌筛查过程中的异常情况进行检测与评估,并利用相关处理软件对显像进行处理以将图像采集时间缩短[5]。本文结果显示,50例乳腺钙化病变患者行乳腺钼靶检查显示阳性为41例,阴性为9例,漏诊2例,误诊1例,诊断的准确性为94.00%,特异度为87.50%,灵敏度为95.24%,与病理诊断结果比较无显著差异(P>0.05),诊断一致性较好(Kappa=0.788>0.75)。提示乳腺钼靶诊断应用于乳腺钙化病变患者中具有较好的诊断效果,可较为精准对乳腺钙化良、恶性病变进行鉴别区分,诊断准确性较高。
乳腺钙化形态对于乳腺良、恶性病变区分具有十分重要的意义,良性病变钙化形态多表现为皮肤、血管钙化;纤维腺瘤钙化多表现为爆米花状不规则钙化;导管扩张等分泌性病变多表现为连续粗棒状钙化,直径多>1 mm;囊肿则呈蛋壳状环形钙化,脂肪坏死呈圆或卵圆形中空钙化,中央呈低密度表现[6]。此外还可见缝线、营养不良性及点状钙化等钙化形态,均于良性病变中较为常见。乳腺恶性病变钙化形态则多呈现直径<0.5 mm、形态大小存在差异性的颗粒点状钙化,或针尖状钙化,或直径<0.5 mm、形态细长、不连续、不规则的线样钙化,提示导管腔已受到乳腺癌侵犯[7]。乳腺钙化分布则多表现为线状、段样、区域状、弥漫状或簇状,段样提示病变由同一导管或分支而来,或是由同一叶或段叶产生的多灶癌,恶性钙化形态且不伴肿块表现时,可初步判断为导管原位癌。区域状、弥漫状则多表现为在整个乳腺较大范围内随意分布,簇状分布在良、恶性病变中均可见[8]。乳腺良性病变钙化数目一般情况下<5个,数目较少,颗粒较大,恶性病变钙化数目则较多,多表现为泥沙、针尖样钙化形态,呈簇状分布,部分甚至无法进行计数。临床将每平方厘米存在>5个钙化病变称为成簇钙化,表明机体钙化病变类型呈现恶性,且恶性钙化病变的可能性随钙化数量、形态增多、大小、密度程度不一而逐渐增大。应从多方位、多角度对乳腺钙化部位进行观察与了解,乳腺良性钙化病变于纤维组织、皮肤、血管及脂肪等乳腺间质内较为多发,以乳腺实质内较为少见,乳腺恶性钙化病变则于乳腺实质内较为多发,泥沙样、小杆状、小叉状钙化分别于乳腺小叶腺泡内、导管内、末支小导管内较为常见多发。乳腺钙化病变与肿块可并存也可独立,可于肿块病变内发生钙化病变,也可于肿块病变外发生钙化病变。钼靶片中仅见钙化病变而未见肿块影,则良、恶性病变均存在较大可能性。乳腺癌钙化则以瘤体坏死区域内较为常见、多发,部分于其周围组织内可见,或钙化病变为未伴肿块。若肿块内部或周围出现未伴肿块且形态较为单一、微小的钙化病变,则提示恶性病变的概率增大。
钙化密度多表现为不均匀特征,肿物及钙化分布直径多超过3 cm,数量多超过24个,并伴有其他恶性征象,如毛刺、肿块以及结构扭曲等[8]。乳腺恶性钙化病变多发于瘤体坏死区或其邻近组织内。相关研究认为[9-10],若钙化表现为细小多形样,于肿块内、外均可见,且其微小钙化呈大小、密度不等、数量超过5个/cm²时,恶性率将大幅度提高。若乳腺恶性钙化病变以管状为主要表现,呈长柱或分枝状,经临床病理诊断则多为粉刺状癌。若导管内皮细胞发生病变,则整个管腔都会被病灶侵占,引发管腔中央坏死、钙化。若乳腺恶性钙化病变以点状为主要表现,且直径<0.5 mm,形态、大小呈不规则、不等状,经临床病理诊断则多为微小乳头状或筛状导管原位癌。若其囊泡及间隙可见分泌物淤积或于导管内乳头状突起处沉积,则易发生钙化。本次试验采用乳腺钼靶对观察组患者病灶特征及钙化情况进行诊断,结果显示,恶性钙化组患者病灶大小≥1 cm为33例(78.87%),病灶形态呈现不规则状为32例(76.19%),边缘呈现模糊不清的毛刺状或结构纠集为34例,钙化数量≥10个/cm²为36例(85.71%),钙化呈节段/线性分布为34例(80.95%)。
综上所述,乳腺钼靶对于乳腺恶性钙化病变者的病灶大小、形态、边缘及钙化情况可进行较为精准的诊断,可为临床治疗的开展提供可靠的参考依据。

