3种柑桔材料水杨酸处理前后对柑桔溃疡病的抗性分析
戴文珊,廖 颖,韩雨菲,刘润东,刘媛媛,王 敏
(赣南师范大学脐橙学院/国家脐橙工程技术研究中心,江西赣州,341000)
柑桔是世界第一大果树,其面积和产量均居第一,目前在146个国家和地区有栽植,产地主要集中在中国、美国、巴西及地中海沿岸国家[1]。根据FAO的统计数据分析,2017年世界柑桔种植面积达927万hm2,产量达1.58亿t,是仅次于小麦、玉米的第三大国际贸易农产品[2]。柑桔也是我国南方地区最重要的果树,据统计,2019年我国柑桔面积和产量分别为261.70万hm2和4 584.54万t[3],柑桔产业在扩大柑桔主产区城乡居民就业、促进农业经济增收等方面作出了巨大贡献[4]。
柑桔溃疡病(citrus bacterial canker disease,CBCD)是由柑桔黄单胞杆菌柑桔亚种Xanthomonascitrisubsp.citri(Xcc)引起的病害,对柑桔产业威胁极大[5]。作为一种细菌性病害,其致病菌主要通过柑桔伤口或者气孔、皮孔等孔道进入植物体内,仅需约20 min即可完成感染过程,可为害叶片、枝条、果实等器官组织[6-10]。柑桔感染溃疡病后,最初在柑桔叶背出现点状黄色或暗黄色的斑点,病斑逐渐扩大,同时叶片病斑两面均逐渐隆起、表皮开裂、木栓化、周围伴有黄色晕圈,随着感病时间的延长,症状逐渐加重,感病后期病斑中央成火山口状开裂,表现出黄褐色的圆形、木栓化病灶[11-12]。柑桔感染溃疡病后,轻则引起果实外观和品质变差、产量下降等,重则造成柑桔树落叶、落果、枝梢枯死、幼树死亡等严重后果[13-14]。前人研究发现,不同柑桔对柑桔溃疡病的敏感性有很大差异,金柑对溃疡病的抗性最强[15-16],甜橙高感溃疡病[17]。枳作为常见的柑桔砧木,也会受到柑桔溃疡病感染。最新研究表明,嫁接柑桔时以枳为砧木较其他砧木对柑桔溃疡病的敏感度更高[18]。然而,枳、甜橙及金柑对柑桔溃疡病的综合抗性尚不清晰。
植物激素信号分子在面对病原物侵染时,能够形成一个复杂的防御体系,使植物做出最为有效的防御反应[19-23]。水杨酸(salicylic acid,SA)是调节植物抗病信号途径的重要内源信号分子,其通过激活植物体内防御基因的表达,从而使植物表现出对生物胁迫的抗性反应[24-28]。大量研究表明,SA可以诱导植物对病原菌的抗性反应,主要是通过诱导植物细胞膜脂过氧化,产生超敏(hypersensitive response,HR)反应,并诱导植物PR(pathogenesis-related)基因的表达,进一步诱导植物的系统获得性抗性(systemic acquired resistance,SAR)[29-33]。因此,采用SA处理植物并分析处理前后植物的抗病性差异与生理变化,从而解析植物对病菌的抵抗机制,是非常有效的办法。
笔者对柑桔亚科3个属(枳属、柑桔属、金柑属)中各自代表种(枳、甜橙和金弹)进行外源SA处理,观察分析3种材料接种柑桔溃疡病菌后叶片表型变化、发病症状、细菌生长趋势,并测定植株相应生理数据指标,鉴定3种材料在水杨酸处理前后对柑桔溃疡病抗性的差异。同时,分析3种材料经SA处理后抗病相关基因表达的变化,以期初步探索这3种材料对柑桔溃疡病敏感度差异的来源。本试验的研究结果可为柑桔溃疡病抗性育种的亲本选择提供参考。
1 材料与方法
1.1 材料
转化GFP蛋白的柑桔溃疡病菌Xanthomonascitrisubsp.citri(Xcc)由本实验室构建并保存,添加50%甘油冻存于-80 ℃冰箱备用。
NA培养基配方:牛肉膏3 g,氯化钠5 g,蛋白胨10 g,定容至1 L。若配制NA固体培养基则继续加入琼脂粉 20 g后定容至1 L。
3种柑桔材料分别为金弹Fortunellacrassifolia、哈姆林甜橙Citrussinensis‘Hamlin’和枳Poncirustrifoliata,均由赣南师范大学苗圃中心提供。
1.2 方法
1.2.1 柑桔实生苗培养与水杨酸处理 实生苗培养:金弹、甜橙和枳实生苗采用野生型种子,1 mol/L NaOH溶液浸泡15 min去除表面残余果胶,再用2% NaClO溶液灭菌20 min,最后用蒸馏水冲洗3~5遍。在30 ℃培养箱中催芽,保证环境湿润,待发芽后移栽于10 cm× 10 cm培养盆中土培,基质使用品氏营养土(Pindstrup,丹麦),与蛭石按照3∶1比例混合后种植,每盆种植1株植物。25 ℃人工气候培养箱(光照16 h/黑暗8 h)培养10周后用于溃疡病接种试验。
SA处理:采用200 μmol/L SA进行处理,每盆材料用50 mL SA溶液喷洒叶片+50 mL SA溶液浇灌盆土,对照采用等量蒸馏水进行同样处理。分时间点(0 h、1 h、3 h、6 h、12 h、24 h)取样各材料叶片,液氮速冻后保存于-80 ℃冰箱以备RNA提取及定量PCR检测,每组至少取3片叶片。24 h后,分别对SA处理组和对照组进行柑桔溃疡病菌接种。
1.2.2 接种柑桔溃疡病菌 菌株活化:接种前从-80 ℃冰箱中取出保存的Xcc菌株,NA固体培养基划线活化,28 ℃培养箱培养2 d后挑取单克隆菌落,继续在新NA培养基划线扩大培养,2 d后刮取生长的Xcc菌体,无菌水稀释调节,配制为5×107CFU/mL的菌悬液。
接种试验:分别选取金弹、甜橙和枳对照组及SA处理组的盆栽苗各4盆,每盆挑选3片叶,在叶背面采用小号注射器(规格:1 mL)注射Xcc菌悬液,每片叶注射两个接种点,每个接种点接种50 μL。此外,各材料再分别挑选4盆未进行SA处理实生苗,叶片背面注射接种蒸馏水,作为阴性对照。接种完成后将实生苗放回光照培养箱中,28 ℃光照培养,观察材料发病表型并拍照记录。
1.2.3 RNA提取与实时荧光定量PCR分析 对材料方法1.2.1中分时间点取样的各组材料叶片进行RNA提取,植物RNA提取参照RNAiso Plus RNA(TaKaRa,日本)试剂盒的方法进行,cDNA合成利用反转录试剂盒K1622 RevertAid First Strand cDNA Synthesis Kit(Thermo,美国)完成。采用实时荧光定量PCR(Real-time quantitative reverse transcription PCR,简称qPCR)方法分析各柑桔材料抗病相关基因的表达,方法参照QuantiNovaTM SYBR○R Green PCR试剂盒(QIGEN,德国)说明书。qPCR的反应体系(10 μL)包括2 × QuantiNova SYBR Green PCR Mix 5.0 μL,Rox染料 0.3 μL,正向引物(10 μmol/L)0.3 μL,反向引物(10 μmol/L)0.3 μL,cDNA模板1.0 μL和ddH2O 3.1 μL。qPCR反应在Applied Biosystems QuanStudioTM 7 Flex Real-Time PCR系统(ABI,美国)内完成。反应程序为:95 ℃预变性5 min,95 ℃变性10 s,58 ℃退火30 s,72 ℃延伸15 s,45个循环。以柑桔Actin作为内参基因,引物序列为Actin F:CATCCCTCAGCACCTTCC;Actin R:CCAACCTTAGCACTTCTCC。以合成的cDNA为模板,每个样品重复4次。以2-ΔΔCT 法进行定量数据分析。
1.2.4 台盼蓝染色 台盼蓝(Trypan blue)是一种细胞活性染料,可以让死亡细胞染色而变蓝,因此常用来作为鉴定细胞生死状态的指示剂。Trypan Blue母液配方:0.02 g Trypan Blue试剂(Sigma,美国),10 g苯酚,10 mL乳酸,10 mL甘油,10 mL无菌水。Trypan Blue应用液配制方法:按照母液∶96%乙醇=1∶2的体积比例配制应用液。
在注射Xcc菌悬液9 d后分别对金弹、甜橙和枳各组植物材料进行取样,只取注射叶片,每组进行3次生物学重复。将需要进行染色的植物材料放入离心管中,加入Trypan Blue应用液至完全浸泡,沸水煮4 min后,取出自然冷却1 d,再加入脱色液(饱和水合氯醛溶液)进行脱色,中途可更换脱色液,待脱色完全后取出植物材料,平铺于玻璃板上,拍照保存。
1.2.5 相对电导率测定 电导率是衡量细胞膜透性的重要指标,其值越大,说明电解质的渗透量越多,表示细胞膜受损程度越重。在注射Xcc菌悬液9 d后分别对金弹、甜橙和枳各组植物材料进行取样,只取注射叶片鲜样0.1 g,每组进行3次生物学重复。将植物样品用去离子水洗净,放入50 mL离心管中,加入30 mL去离子水,置于旋转摇床上室温下缓慢摇动1~2 h,取出样品,用DSS-307型电导率仪(SPSIC,中国)测量此时电导率C1。之后沸水煮样品10 min,使细胞内离子渗透达到最大,取出样品,室温冷却后测量电导率C2。两次测量均以空白去离子水为对照组,电导率记为C01和C02。相对电导率=[(C1-C01)/(C2-C02)]×100%。
1.2.6 叶绿素含量测定 参照Liu等[34]的方法,略有改动。具体方法如下:在注射Xcc菌悬液9 d后分别对金弹、甜橙和枳各组植物材料进行取样,每组进行3次生物学重复。只取注射叶片叶肉鲜样0.1 g,加入1.9 mL蒸馏水中,冰上研磨成匀浆。取200 μL匀浆液加入4.8 mL 80%丙酮,充分涡旋后,4 000转/min离心5 min,取上清液于分光光度计上测定645 nm处吸光值(记为A645)。总叶绿素含量(Ct,mg/L)计算式如下:Ct=A645×1 000÷34.5。
1.2.7 柑桔溃疡病菌的荧光显微镜观察 试验所用的Xcc经改造后融合有GFP蛋白,在荧光显微镜下可观察到细菌GFP荧光。在注射Xcc菌悬液后1、3、5、7和9 d,分别选取各组注射柑桔叶片,用6 mm孔径打孔器在叶片边缘打孔,每组3个重复,将打孔取下的叶圆片加入2 mL离心管中,放入2颗研磨珠和200 μL无菌水,磨样机磨样后3 000 转/min离心30 s,吸取上清液至新的1.5 mL离心管中,取10 μL滴加到血细胞计数板上,荧光显微镜下进行观察、拍照并计算柑桔溃疡病菌数,每组进行3次生物学重复。
1.3 数据分析
使用SAS 8.1软件对数据进行统计分析,依据邓肯氏新复极差法比较显著性差异。
2 结果与分析
2.1 SA处理对发病症状的影响
试验结果看出,未经过SA处理的甜橙与枳均在接种Xcc后的第3天开始出现发病症状,并随着时间的延长逐渐加重;枳的病症较甜橙更严重,接种第9天枳叶片开始出现显著的水渍化病症。经过SA处理后,甜橙和枳接种Xcc后的发病表型均得到缓解,症状更轻。经过SA处理或未经过SA处理的金弹接种Xcc后均无显著病症出现,但未经过SA处理的叶片接种Xcc后有黄化倾向(见图1)。这表明金弹对柑桔溃疡病具有很高的抗性;SA处理确实可以增强3种柑桔材料对柑桔溃疡病的抗性。

注:Cs:甜橙;Ptr:枳;Fc:金弹;Xcc:接种溃疡病菌(未经水杨酸处理);Xcc+SA:水杨酸处理后接种溃疡病菌。图2和图3同。
2.2 SA处理对感病后病菌增殖的影响
试验结果看出,未经SA处理的甜橙、枳和金弹分别在接种Xcc后第3天、第3天和第5天开始能够观察到细菌GFP荧光,且随着时间的推移,细菌数量逐渐增大,到第9天,甜橙、枳和金弹的Xcc数量分别为3.36×107、4.75×107和1.9×107CFU/mL。经过SA处理的甜橙、枳和金弹均在接种Xcc后第5天开始能够观察到细菌GFP荧光;到第9天,甜橙、枳和金弹的Xcc数量分别为1.39×107、2.05×107和1.18×107CFU/mL,均显著低于对应时间未处理组材料(见图2)。这表明,SA处理能够抑制甜橙、枳和金弹体内Xcc的增殖。
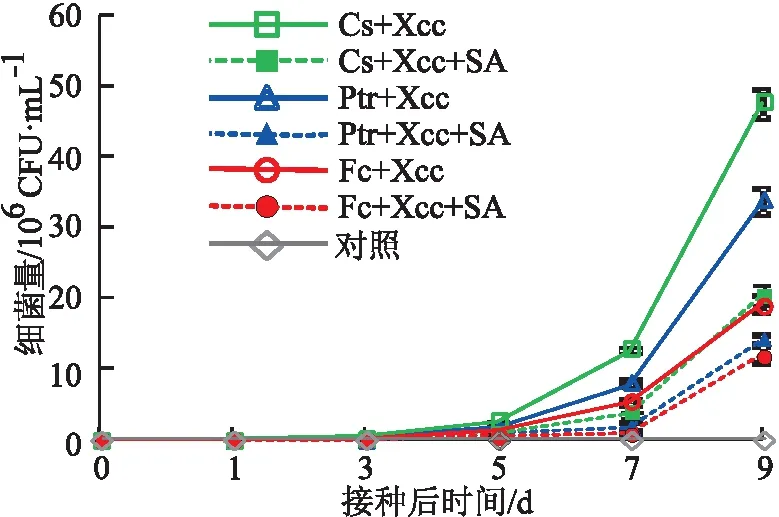
图2 3种柑桔材料经水杨酸处理后接种柑桔溃疡病菌的增殖情况
2.3 SA处理对感病后死亡细胞数量的影响
试验结果看出,甜橙、枳和金弹对照(清水处理并接种清水)叶片均未被染色。未经SA处理的甜橙、枳和金弹,叶片接种Xcc后,接种部位出现不同范围的染色,其中,枳的染色程度最深、范围最广,其次是甜橙,金弹仅在接种临近部位有较浅染色。经过SA处理的甜橙、枳和金弹,叶片接种Xcc后,其染色程度均有明显降低,尤其金弹的叶片几乎无染色症状出现(见图3)。这表明,接种Xcc后,金弹叶片细胞的死亡量较甜橙与枳更少,同时,SA处理可以降低3种柑桔材料细胞的死亡量。

图3 3种柑桔材料经水杨酸处理后接种柑桔溃疡病菌叶片的台盼蓝染色
2.4 SA处理对感病后细胞膜透性和叶绿素含量的影响
试验结果看出,未经SA处理的甜橙、枳和金弹接种Xcc后叶片的相对电导率分别为19.3%、26.6%和13.6%,均显著高于清水处理并接种清水的对照(分别为14.1%、13.7%和11.0%),与经过SA处理3种柑桔材料接种Xcc后叶片相对电导率(分别为17.5%、25.6%和11.7%)差异不显著(见图4)。这表明,接种溃疡病菌后,金弹叶片细胞膜受损程度最轻,而甜橙和枳叶片受损程度较重;经过SA处理后对感染溃疡病菌后的细胞膜受损的改善不明显。
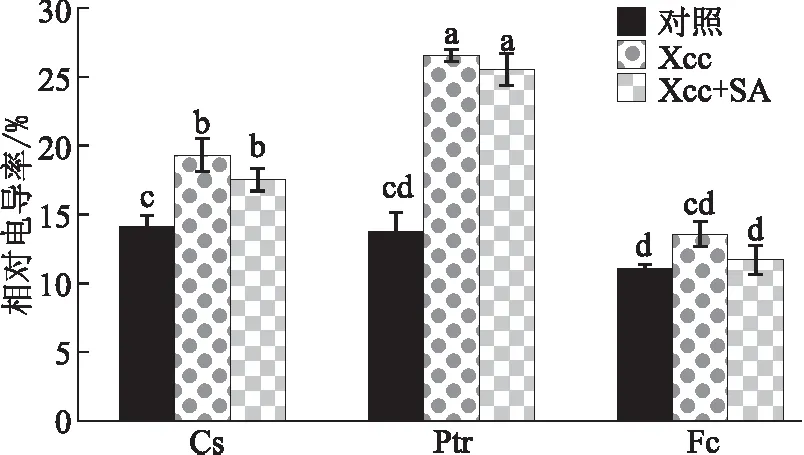
注:数柱上不同小写字母表示差异显著(p<0.05)。表5同。
未经SA处理的甜橙、枳和金弹,接种Xcc后叶片叶绿素含量(分别为1.62、4.46和1.03 mg/g),显著低于清水处理并接种清水的各对照(分别为3.89、5.06和8.00 mg/g)。其中,金弹的降幅最大,这与金弹叶片接种Xcc后出现黄化症状的现象吻合。经过SA处理后的3种材料接种Xcc后叶片中叶绿素含量(分别为2.87、4.84和4.22 mg/g)与经SA未处理相比均有不同程度的升高,光合效率均得到一定程度的改善(见图5)。
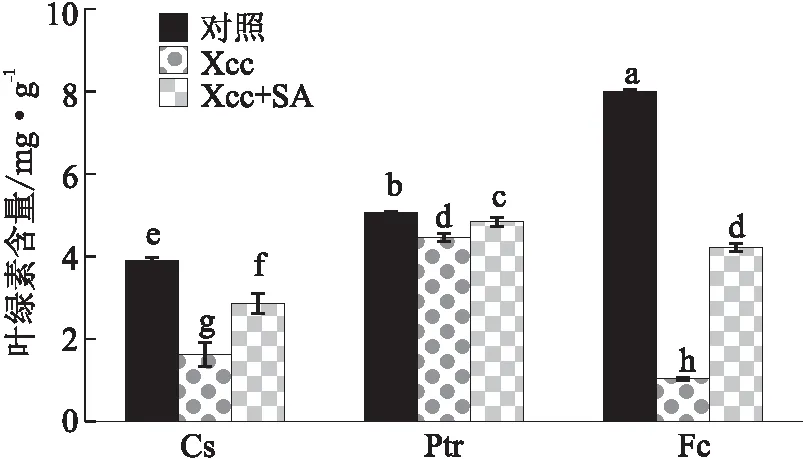
图5 3种柑桔材料经水杨酸处理后接种柑桔溃疡病菌叶片的叶绿素含量
2.5 SA处理对抗性相关基因表达的影响
试验结果看出,经SA处理后,抗病基因NPR1、EDS1、ICS1、PAD4和PR1在3种柑桔材料中均有不同程度的上调表达。其中,NPR1、PR1在金弹中被诱导上调表达最明显,SA处理3 h时的相对表达量(NPR1为4.81,PR1为12.59)显著高于甜橙和枳。经SA处理后,PAL1基因在甜橙中的表达量无显著变化,但在金弹和枳中均上调表达(见图6)。
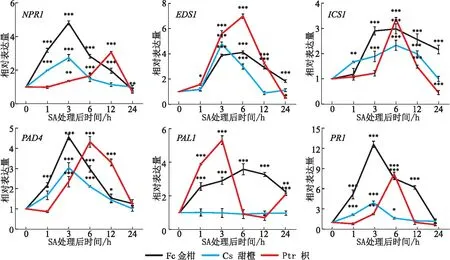
注:星号表示数值与对应0 h的差异显著性,*p< 0.05,** p< 0.01,*** p< 0.001。
3 讨论
SA是植物免疫反应中起重要作用的信号分子,当植物受到活体营养型病原侵染后,体内SA合成急剧增加,进而激活植物对病原产生抗性反应,因此SA是植物体内重要的抗病激素[35]。本研究通过比较柑桔亚科3个属中(金弹属、柑桔属和枳属)代表柑桔种(金弹、甜橙和枳)经过SA处理与否,接种柑桔溃疡病菌后的发病表型与相关生理数据,发现与未经SA处理的柑桔材料相比,经过SA处理的柑桔材料接种柑桔溃疡病菌后,死亡细胞数量减少,相对电导率降低,叶绿素含量提高,柑桔溃疡病菌繁殖量也显著减少。这证明了,SA确实可以诱导金弹、甜橙和枳对柑桔溃疡病菌的抗性。
进一步分析SA处理后3种材料抗病相关基因的表达量,发现NPR1和PR1在金弹中被诱导上调表达且显著高于甜橙和枳。众所周知,SA能诱导包括PR蛋白(pathogenesis-related protein)等多种抗病相关蛋白的产生,从而使植物产生系统获得性抗性。NPR1基因位于SA信号的下游、PR蛋白的上游,是植物SA信号传导过程中的关键调节因子[36]。PAD4(phytoalexin deficient 4)和EDS1(enhanced disease susceptibility 1)形成的复合模型位于SA信号通路的上游,可以促进SA在植物体内的积累,SA积累的反馈回路又可以增强EDS1、PAD4等基因的表达,从而进一步增加植物的抗性功能[37]。PR1是SA诱导激活的PR家族基因中的一员,也是NPR1的下游调控因子,在植物抗病防御过程中扮演了重要的作用[38]。以上3个基因都是参与SA信号通路且在植物抗病响应过程中起正向调节作用的关键基因。经SA处理,NPR1和PR1基因的表达量在金弹叶片中的诱导上调程度显著地高于甜橙与枳,PAD4基因上调表达水平也较高,表明金弹在SA诱导的抗病通路中响应程度较高。进一步推测,金弹对柑桔溃疡病的高抗能力,可能与其受到柑桔溃疡病菌入侵时,体内这3个抗病基因会显著上调相关。

