TRV介导的小报春基因沉默技术体系的建立
付偲僮 司未佳 刘颖 程堂仁 王佳 张启翔 潘会堂
(北京林业大学园林学院 国家花卉工程技术研究中心 花卉种质资源创新与分子育种北京市重点实验室 城乡生态环境北京实验室,北京 100083)
基因功能验证常用的方法有转基因、RNA干扰、基因敲除和酵母杂交等,但大部分基因验证方法都依赖于稳定的遗传转化体系。稳定遗传转化体系的构建步骤繁琐、耗时,且依赖传统遗传转化体系的基因功能验证不适用于无稳定遗传转化体系的物种。因此在无遗传转化体系的物种中,基因沉默(gene silencing)验证则需要另辟蹊径。
基因沉默是真核生物细胞基因表达调控的一种重要手段,是植物自身防御病毒入侵的一种自然机制。病毒诱导的基因沉默(virus-induced gene silencing,VIGS)是利用病毒载体携带植物目的基因片段,通过各种方式侵染植物,重组病毒在植物中复制产生双链RNA(double strand RNA,dsRNA),在植物自身防卫反应转录后基因沉默(post transcriptional gene silencing,PTGS)的机制作用下,dsRNA进一步产生siRNA(small interference RNA,siRNA),该产物能够诱导与其具有同源性的植物内源目的基因mRNA的降解,根据表型变异来进行基因功能分析,实现植物基因功能的快速鉴定[1]。相比于传统的转基因技术,VIGS技术具有沉默效率高、周期短、操作简单、经济实惠等优点,并且不需要事先知道并克隆基因全长,也无需建立遗传转化体系,只需要一段300-500 bp的基因片段就能快速获得表型,进行基因功能的验证[2]。目前,已经成为植物基因功能研究领域最具有吸引力的技术之一。烟草脆裂病毒(tobacco rattle virus,TRV)具有基因组较小,可以侵染植物生长点,不产生典型病毒性状,便于改造等优点,是目前在植物中应用最广泛、效果最好的 VIGS 病毒载体[3],对包括番茄[4]、烟草[5]、辣椒[6]等在内的植物有良好的侵染效果。
花柱异型现象能够促进异花授粉,是植物界经典的适应性范例,是被子植物多样性形成的核心因素之一[7]。小报春作为典型的花柱二型植物,是研究花柱二型形成机制的理想材料。但是报春花属植物的体外再生非常困难,关于报春花属植物的再生体系和遗传转化体系的研究较少。前人以欧报春叶片为外植体得到了愈伤组织[8],Hayta等[9]报道了两种农杆菌介导的欧报春遗传转化系统,一种是农杆菌介导的真空渗透幼苗,能够实现在欧报春中的瞬时转化;一种是根癌农杆菌感染的花梗外植体,平均转化率为4.6%,具有稳定的转基因整合和转化到下一代的能力,但这一方法转化效率低,难以实现大规模的基因功能分析。因此,建立小报春VIGS基因沉默体系成为基因功能验证亟待解决的关键问题。
PDS是类胡萝卜素合成途径中的限制酶,参与植物类胡萝卜素的合成累积。PDS基因沉默会影响植物番茄红色的积累,番茄植株的绿色部分(叶子和绿色果实)因为缺乏该酶而导致叶绿体对光极度敏感,出现典型光漂白表型,因此变成白色[3]。由于植物不同部位均出现容易观察的沉默表型,PDS在VIGS体系建立过程中得到广泛应用。
近年来,VIGS技术已经被广泛应用于番茄[4]、苹果[10]、玉米[11]、棉花[12]、葡萄[13]等作物中,但尚没有在小报春中建立VIGS体系的报道。
本研究以实验室培育的小报春新品种‘红星’为试验材料,利用小报春的PDS(八氢番茄红素脱氢酶)基因作为标记基因,构建TRV2-PfPDS重组载体,以期构建小报春VIGS体系,为小报春的基因功能研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 将小报春种子播种在穴盘中,置于北京林大林业科技有限公司的人工气候室中,培养条件为光照时间16 h,温度22℃,黑暗时间8 h,温度18℃,相对湿度60%。约2个月后将小报春的种苗移植到直径10 cm的花盆里,一周后有新叶长出时用于侵染。另外,在湿润的滤纸上播种小报春种子,分别培养至白色胚轴刚刚伸出和长出子叶2种发育阶段,用于真空侵染。
1.1.2 病毒载体和菌株 TRV病毒载体pTRV1和pTRV2由中国农业大学傅达奇教授惠赠,载体图谱如图1所示,所选用大肠杆菌(Escherichia coli)感受态为DH5α(CD201-02,全式金,北京),农杆菌感受态为GV3101(BC304-01,博迈德,北京)。
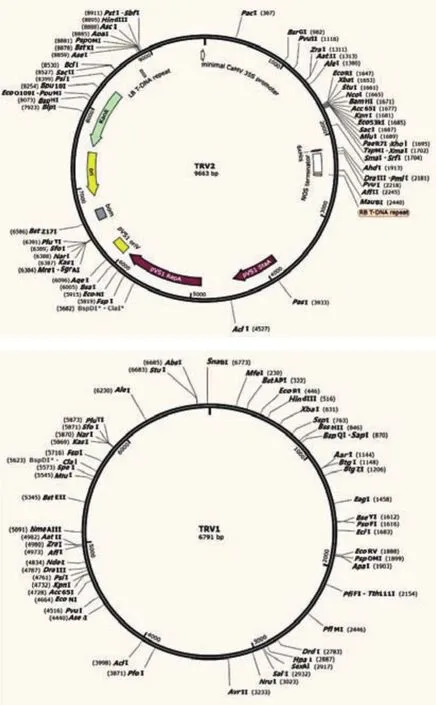
图1 TRV1和TRV2载体图谱Fig.1 Vector map of TRV1 and TRV2
1.2 方法
1.2.1 报告基因扩增 从小报春转录组中筛选出小报春PDS基因(PfPDS)序列,在其ORF框内选取302 bp长度的片段。参考In-fusion引物设计原则设计引物(上游引物为5′-TTAAGGTTACCGAATTCAT ACCGGCTTGTGAC-3′,下游引物为 5′-GCTCGGTACC GGATCCGCAAATCGATGCACT-3′),由上海生工生物有限公司合成。反应体系为cDNA 2 μL(80 ng/μL)、上游引物 2 μL(100 μmol/L)、下游引物 2 μL(100 μmol/L)、2×EasyTaq PCR SuperMix 25 μL 和 ddH2O 19 μL。离心混匀后按以下反应体系进行扩增,反应程序为 94℃ 5 min ;94℃ 30 s,60℃ 30 s,72℃ 1 min,35个循环;72℃ 10 min。经琼脂糖凝胶电泳检测,将正确的条带切下后进行回收。
1.2.2 重组载体构建 用限制性内切酶BamH I和EcoR I对TRV2质粒进行双酶切。反应体系为TRV2 质 粒 1μg、BamH I 0.7 μL(10 U)、EcoR I 0.7 μL(10 U)、10×K Buffer 5 μL,ddH2O 补 至 50 μL。37℃酶切3-4 h后胶回收。将1.2.1得到的基因片段与线性TRV2载体通过In-fusion连接法,50℃15 min,转化大肠杆菌,筛选阳性克隆进行菌液PCR鉴定阳性重组子。经琼脂糖凝胶电泳检测后,将含有目的条带的菌液送北京诺赛基因组研究中心有限公司测序。
1.2.3 菌液制备及侵染 取5 μL测序正确的重组质粒TRV2-PfPDS转化农杆菌感受态GV3101,28℃培养2 d,挑取外形圆润的单个菌斑于1 mL含有50 μg/mL卡那霉素、50 μg/mL庆大霉素、25 μg/mL利福平的液体LB培养基中28℃摇菌(150 r/min)培养。
以菌液∶诱导LB=1∶20的比例,将摇好的菌液转入诱导LB中(其中卡那霉素工作浓度为50 μg/mL,庆大霉素工作浓度为50 μg/mL,利福平工作浓度为25 μg/mL,MES工作浓度为10 mmol/L,AS工作浓度为20 μmol/L),在28℃下震荡培养12-16 h(150 r/min)。
将培养好的诱导LB菌液以5 000 r/min离心5 min后,弃上清,用侵染液重悬菌体。将菌液调至所需浓度(OD600)后室温下静置3-4 h。最后将含有TRV1的菌液与含有TRV2-PfPDS的菌液按体积比1∶1混合,待用。
1.2.4 沉默体系的构建 侵染方式:在同样的OD600和侵染液配方的条件下,研究叶背注射、叶柄注射、真空渗透侵染刚露白种子或长出子叶的种苗4种方式的侵染效率。具体方法如下:将OD600调至1.0,侵染液为无菌水中含有10 mmol/L MES、10 mmol/L MgCl2和 200 μmol/L AS。(1)叶背注射法 :用 5 mL一次性注射器吸取侵染液并拔掉针头,将注射器对准叶片的背面,避开叶脉,用食指隔着叶片抵住注射口,将侵染液注入叶片中,以观察到叶片呈现浸渍状为宜。对每片叶进行注射,确保侵染液进入植株内部。(2)叶柄注射法:用5 mL一次性注射器吸取侵染液后,用针头轻轻划伤叶柄(不能将叶柄折断),在伤口处注射少量侵染液。为保证侵染液进入植株内部,对每个叶柄进行注射。2种侵染方式各处理10株小报春。(3)真空渗透侵染刚露白种子或长出子叶的种苗:将分别培养至种子刚露白和长出子叶的小报春用于真空渗透侵染,设置3种压强(-25、-50和-75 kpa)及3种侵染时间(30 s、2 min和5 min),每组处理20粒种子。叶背注射、叶柄注射、真空渗透4种侵染方式均设置相应的空载组和对照组。所有植株在侵染后遮光处理24 h,之后在人工气候室(光照时间16 h,温度22℃,黑暗时间8 h,温度18℃,湿度60%)中培养。
菌液浓度与侵染液配方:设置4种侵染液配方及菌液OD600(表1),合计16组处理,每组处理设置对应的空载组和对照组,采用叶背注射法侵染5株小报春,所得数据使用SPSS和Excel软件进行分析。

表1 侵染液菌液浓度及配方Table 1 OD600 value and combinations of infiltration liquid
提取出现白化表型植株不同部位的RNA,同时提取空载组和对照组的RNA,分别反转为用于载体检测和表达量检测的2种cDNA,用于载体检测的cDNA使用TIANScript RT Kit(KR104,天根,北京)反转录试剂盒,用于表达量检测的cDNA使用PrimeScriptTMRT reagent Kit with Gdna Eraser(RR-047A,TaKaRa,日本)反转录试剂盒,具体操作见试剂盒说明书,引物详细信息见表2。
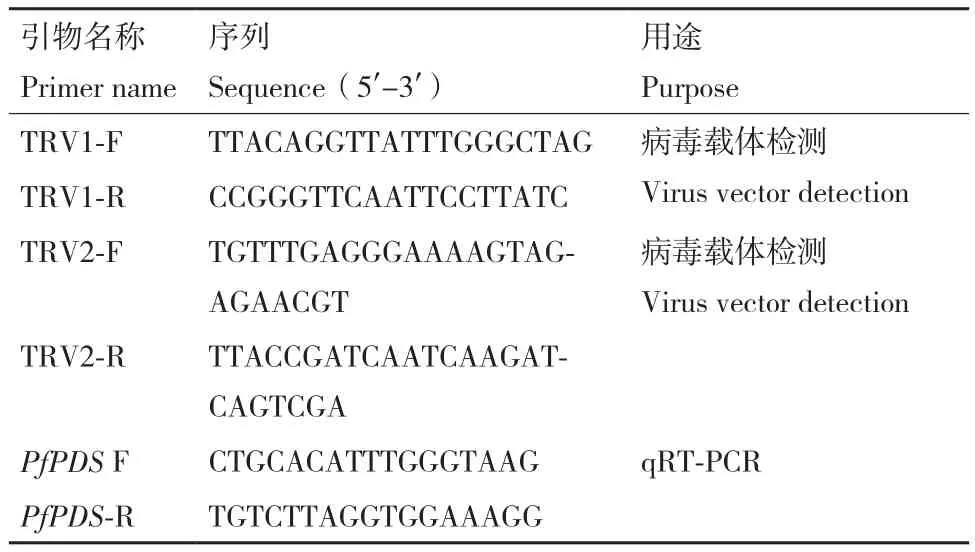
表2 病毒载体检测及表达量检测引物Table 2 Primers for viral vector detection and gene expression level detection
2 结果
2.1 小报春VIGS体系的最佳侵染方式
比较叶背注射、叶柄注射、真空渗透种子和真空渗透具有两片子叶的幼苗4种侵染方式的侵染效率,OD600均为1.0,侵染液均为无菌水中加入200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES。侵染后第16天首次观察到白化现象,白化现象均出现在新生的叶片上,侵染40 d后不再有新的植株出现白化现象(图2),白化植株表型持续变化,一直到开花,白化现象在叶片、花葶、花梗、花萼等部位均能出现(图3)。通过叶背注射法侵染小报春的效率达60%,而叶柄注射法的侵染效率为30%。真空渗透侵染法无论是侵染刚露白的种子还是带两片子叶的幼苗,白化现象均不如注射法侵染的植株表现明显,仅在叶脉处出现白化现象(图4),利用这两种方法首次观察到白化现象是在侵染37 d后。两种方法中,带两片子叶的幼苗要比刚伸出胚轴的种子侵染效率高。对于刚刚伸出胚轴的种子,压强为-25 kpa时侵染效率最高,且侵染时间越长效率越高,而对于两片子叶的幼苗,压强为-75 kpa时侵染效率最高,侵染效率与侵染时间长短无关(表3)。综上所述,小报春最佳的侵染方式为叶背注射法。

表3 真空渗透法侵染小报春萌发种子和带子叶幼苗的效果Table 3 Infection efficiency on P.forbesii when seeds with hypocotyl and cotyledons infected by vacuum infiltration

图3 PfPDS沉默后小报春的白化现象Fig.3 Whole plant albino after PfPDS gene silenced in P.forbessii

图4 真空渗透法侵染小报春后PDS基因的沉默效果Fig.4 Silencing effect of PDS gene in P.forbesii infected by vacuum infiltration method
2.2 小报春VIGS体系的最佳菌液浓度与侵染液配方
以叶背注射法侵染叶片,在侵染16 d后开始出现白化现象,在侵染20 d后不再出现新的白化植株,最高侵染效率为40%,空载组和对照组无明显变化(图2)。从16组处理结果来看(表4),侵染效率没有表现出与OD600或侵染液配方具有明显的相关性。结合2.1的结果,综合考虑节约药品与操作的方便性,选择OD600为1.0,侵染液配方为无菌水中加入200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES 作为最佳的菌液浓度和侵染液配方。

表4 不同OD600与侵染液配方侵染小报春的效率Table 4 Infection efficiency of different OD600 values and different formula of infiltration liquid on P.forbesii

图2 注射法侵染小报春后PDS基因沉默效果Fig.2 Silencing effect of PDS gene infection in P.forbesii
2.3 病毒载体检测与表达量检测
利用TRV病毒载体上的引物(表2)进行PCR,在出现白化现象的植株和空载组中均检测到了TRV1和TRV2病毒载体,对照组中没有检测到2种病毒载体(图5),说明不同的侵染方式都能使携带有病毒载体的菌液进入植株内部,并且病毒载体能够转移到新生器官中,出现白化现象的植株PfPDS表达量显著低于空载组和对照组。而真空渗透法侵染的植株PfPDS下调不明显,沉默效率低,表型变化小(图6)。比较基因沉默后小报春不同部位PDS基因表达量,发现叶片、花梗、萼片中PfPDS TRV2植株PDS基因表达量均显著低于空载组和对照组(图7)。
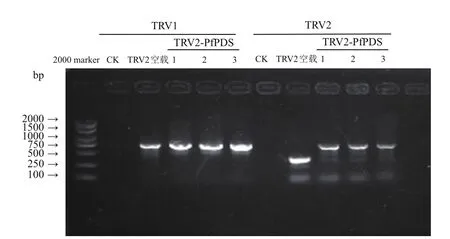
图5 基因沉默后小报春植株病毒载体检测结果Fig.5 Detection results of virus vector in P.forbessii after gene silencing
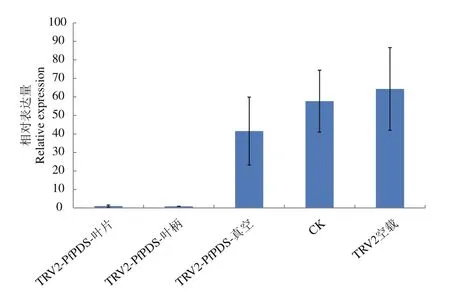
图6 使用不同方法基因沉默后小报春PDS基因的表达量检测Fig.6 Detection results of PDS gene expression after gene silencing by different methods

图7 基因沉默后小报春植株不同部位PDS基因的表达量检测Fig.7 Detection of PDS gene expression in different parts of P.forbessii after gene silencing
3 讨论
小报春是报春花科报春花属的典型花柱异型植物,本研究构建的小报春VIGS体系能够使白化植株表型持续变化,一直到开花,白化现象在叶片、花葶、花梗、花萼等部位均能出现。说明病毒载体能够在植株内部转移并且在花部器官能够表达,该体系能够用于研究花柱异型以及其它性状如花香、耐热等科学问题。
确保带有重组载体的菌液进入植株体内,是VIGS技术成功与否的决定性因素。不同植物有各自最适的侵染方式,本研究所用的注射侵染法适用于肉质、柔软的叶片,如番茄的子叶、烟草的幼嫩真叶,该类叶片组织结构松软,注射器造成较小的伤口后即可利用压力将侵染液快速的浸润到整个叶片从而完成侵染;该方法不适合叶片比较薄而脆、叶脉较多的植物,如大豆(Glycine max)、玉米(Zea mays)和小麦(Triticum aestivum)等。这类植物叶片较窄、偏纸质,用真空渗透侵染法侵染种子具有较好效果。Zhang等[14]利用抽真空方式使带有PDS基因的病毒载体进入发芽的小麦和划伤的玉米种子中,最终获得全株白化的苗子。许多木本植物叶片与草本植物相比偏革质或蜡质,较难侵染。利用幼嫩的扦插苗或组培苗则会更容易侵染,在月季(Rosa chinensis)和观赏海棠(Malus spectabilis)的研究中有采用真空渗透侵染法侵染组培苗的报道[15-16]。针对具体物种构建最适的体系是十分必要的。
八氢番茄红素去饱和酶(phytoene desaturase,PDS)是类胡萝卜素合成途径中的限制酶,参与植物类胡萝卜素的合成累积。PDS基因沉默会影响植物番茄红色的积累,番茄植株的绿色部分(叶子和绿色果实)因为缺乏该酶而导致叶绿体对光极度敏感,出现典型光漂白表型,绿色的植物叶片因此变成白色[8]。由于植物不同部位均出现容易观察的沉默表型,PDS在VIGS体系建立过程中得到广泛应用,但其最大缺点是破坏了叶绿体而影响植物的正常生长发育。通常研究植物的叶片表型时建议使用PDS基因,如要研究果实表型,则以番茄红素合成酶基因PSY1为佳,因为该基因沉默后只会导致红色的果实变成黄色,不会导致植物绿色部分发生颜色变化[17]。
Fu等[18]利用多种侵染方式对番茄果实中控制果实成熟相关的基因进行沉默后,发现同一个果实上会同时出现绿色未成熟和红色成熟的两种状态,但出现表型的部位仅在侵染的部位,不会出现在未侵染的部位。本研究中,幼苗期侵染叶片后,在整个植株的各个部位均有白化现象出现,说明病毒会在植株内转移,这种转移的能力可能与侵染的部位和时期有关,病毒更倾向于向新生部位转移。王旭等[19]将含有pTRV2-PDS菌液注射到刺萼龙葵叶背和幼根处,光漂白现象不仅在叶片上出现,在部分花瓣上也出现了白化现象。
VIGS是一种瞬时转化技术,由于瞬时转化基因没有结合到染色体上,所以VIGS基因沉默是不稳定的,侵染一段时间后沉默效果会有所衰减,表型也会恢复[20]。大部分研究所报道的VIGS表型持续时间较短,从3周到3个月不等[21-23]。小报春作为一种二年生植物,开花结实后会自然死亡。但在长日照条件下,延长小报春营养生长时间便可延长其整个生命周期。一些植株从幼苗期侵染至结实后衰老死亡整个过程中都持续表现白化现象,说明病毒载体能在小报春体内存活较长的时间,可达12个月左右。由于沉默效果持续较长,大大提高了VIGS技术在小报春相关研究中的实用性,有望在小报春基因功能研究中发挥积极作用。
4 结论
构建了PfPDS-TRV2载体,探索了最佳侵染部位、侵染液配方、菌液浓度和侵染方式,用含有200 μmol/L乙酰丁香酮(AS)、10 mmol/L MgCl2和10 mmol/L乙磺酸缓冲液(MES)的侵染液,将菌液OD600分别调至1.0,混合后通过叶背注射方式侵染小报春能够有效地沉默基因,侵染效率达60%,沉默表型可持续12个月,并能在小报春植株的各部位(从叶片到萼片)均起到沉默作用。

