芦荟大黄素对阿尔茨海默病大鼠PI3K/AKT/mTOR通路介导自噬的影响
雷 鑫,叶 树,2,王国权,汪光云,2,宋 航,2,蔡 标,2,3,4,王 艳
(1.安徽中医药大学中西医结合学院,安徽 合肥 230012;2.安徽省中医药科学院中西医结合研究所,安徽 合肥 230012;3.新安医学教育部重点实验室,安徽 合肥 230012;4.中药复方安徽省重点实验室,安徽 合肥 230012)
阿尔茨海默病(Alzheimer’s disease,AD)是一种中老年人易患的神经退行性疾病。2019年世界AD报告表明,全球老年痴呆症患者已达5 000万,且患者数量将于2050年增至1.52亿[1]。AD引发的认知功能障碍、记忆丢失与行为失调等症状不仅降低患者的生活质量,更给社会与家庭带来严重的压力[2]。研究[3]显示,海马神经细胞中出现的过度磷酸化Tau蛋白聚集形成的神经纤维缠结与病理性Aβ沉积形成的老年斑是两种典型的AD病理标志物。这两种具有神经毒性又不易清除的病理标志物是导致海马神经细胞出现不可逆损伤的主要因素。
自噬是一种在细胞内稳定发生的降解细胞内容物的动态过程。对于神经细胞而言,自噬是清理细胞内病理性Aβ和Tau蛋白,维持神经细胞内稳态的重要机制[4-5]。磷脂酰肌醇3激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(the mammalian target of rapamycin,mTOR)信号通路是一条经典的自噬相关信号通路[6]。目前研究[7-8]表明,该通路的激活会抑制自噬的上游蛋白活化,进而阻止自噬过程的启动,而在AD病理条件下大脑内会发生自噬的抑制以及自噬相关通路PI3K/AKT/mTOR的过度激活。因此,恢复AD神经细胞中受损的自噬功能,促进神经细胞自噬对神经细胞自身病理蛋白的降解可能是治疗AD的有效手段之一。芦荟大黄素是蓼科植物大黄根茎中的单体成分。有研究表明,芦荟大黄素具有促进自噬[9]、抑制病理性蛋白的聚集[10]以及调控PI3K/AKt/mTOR通路的作用[11]。这些研究中发现的芦荟大黄素的药理作用,与AD中PI3K/AKt/mTOR通路的异常激活及其导致的自噬抑制存在对应关系,这使得芦荟大黄素具有成为治疗AD的小分子类药物的潜力。
本实验通过建立SD大鼠AD模型,观察芦荟大黄素对AD模型大鼠的行为学、海马CA1区神经细胞损伤情况、自噬蛋白及其mRNA表达水平、PI3K/AKT/mTOR通路蛋白及其mRNA表达水平的影响,从自噬的角度探讨芦荟大黄素治疗AD的调控作用,为天然药物单体成分研究提供实验依据。
1 材料
1.1 动物 雄性SD大鼠30只,体质量为250~300 g,购自山东省实验动物中心,生产许可证号:SCXK(鲁)2019-0003。大鼠置于温度25~27 ℃、湿度40%~50%的饲养室常规喂养。实验前适应性喂养1周。
1.2 药物 芦荟大黄素(纯度≥98.0%,批号DST200425-007):成都德思特生物技术有限公司;Aβ25-35试剂(批号A4559-1MG,用前用无菌生理盐水配制成2 mg/mL溶液,于37 ℃恒温箱静置7 d后储存于-20 ℃,备用):Sigma公司;D-半乳糖:国药集团化学试剂有限公司。
1.3 试剂 磷酸化PI3K(p-PI3K)兔抗大鼠抗体(批号 182651):Abcam公司;磷酸化mTOR(p-mTOR)兔抗大鼠抗体(批号 5536S)、磷酸化AKT(p-AKT)兔抗大鼠抗体(批号4060S)、微管相关蛋白1轻链3 A/B(microtubule-associated protein 1 light chain 3 A/B,LC3A/B)兔抗大鼠抗体(批号 4108S)、苄氯素1(Beclin-1)兔抗大鼠抗体(批号 3495T)、死骨片1-泛素结合蛋白P62(sequestosome 1/P62,SQSTM1/P62)兔抗大鼠抗体(批号 39749T):CST公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3 phosphate dehydrogenase,GAPDH)兔抗大鼠抗体(批号 380626):成都正能生物技术有限公司;山羊抗兔IgG二抗(批号 A21020):Abbkine公司;BCA蛋白浓度测定试剂盒(批号 P0012S):碧云天生物技术有限公司;极超敏化学发光试剂盒(批号 SDGGX):山东思科捷生物技术有限公司;Trizol试剂(批号 229012):Ambion公司;SYBR荧光试剂(批号 067600):TOYOBO公司;引物设计合成:上海生工生物工程有限公司。
1.4 仪器 脑立体定位仪(型号68026):Stoelting公司;微量注射泵(型号RWD-202):瑞沃德生命科技有限公司;高速冷冻离心机(型号H3-18KR):Thermo Scientific公司;光学显微镜(型号Nikon Eclipse E100):日本尼康公司;病理切片机(型号RM2016):徕卡仪器有限公司;电泳仪(型号1645070):Bio-Rad公司;FCM凝胶成像仪(型号Tanon 5200):Protein Simple公司;Real-time PCR仪(型号7500):Applied Biosystems公司。
2 方法
2.1 动物模型的建立与给药 将30只大鼠随机分为3组:空白组、模型组、芦荟大黄素组(100 mg/kg,以纯水为溶剂,配制成10 mg/mL混悬液),每组10只。对模型组和芦荟大黄素组大鼠进行D-半乳糖(100 mg/kg)的腹腔注射,每日1次,共注射42 d。在腹腔注射D-半乳糖的第21天,用1%戊巴比妥钠盐(40 mg/kg)对大鼠进行麻醉,采用脑立体定位仪中的固定装置将大鼠头部固定,调整仪器直至颅骨表面水平,以颅骨前囟位置向后4.4 mm、左右各旁开2.2 mm的位点作为注射点穿刺,再将注射针头置入颅骨下3 mm,5 μL(10 μg)Aβ25-35缓慢注入双侧海马,注射完成后等待5 min拔针,缝合伤口。将海马神经细胞产生损伤以及大鼠学习记忆能力降低作为AD模型复制成功的标准。空白组注射等容积的生理盐水。在腹腔注射D-半乳糖的第14天进行灌胃给药,芦荟大黄素组大鼠按10 mL/kg给予芦荟大黄素混悬液,空白组和模型组给予等容积的纯水,共28 d。
2.2 Morris水迷宫试验检测大鼠学习记忆能力 腹腔注射D-半乳糖的第37天进行实验,实验每日进行1次,共6 d。在第三象限放置平台,水温控制为23~27 ℃。前4 d为大鼠训练期,此时依次从水池的4个不同象限将大鼠头朝向池壁缓慢置入水中,记录每一只大鼠的逃避潜伏期,如果大鼠不能在90 s内到达平台,则视为大鼠无法找到平台,此时记录其逃避潜伏期为90 s,并将其引导至平台处,停留15 s。在第5天仅将大鼠从第一象限置入水中,记录大鼠的逃避潜伏期并作为测试结果。在第6天实验前,将池内的平台撤去,将大鼠从第一象限置入水中,记录大鼠在90 s的时间里穿越原平台位置的次数并作为测试结果。本实验由Smart 3.0系统进行数据的采集和分析。
2.3 取材 大鼠采用1%的戊巴比妥钠(10 mg/kg)麻醉后处死。每组随机选取6只大鼠置于冰面上取脑,仔细分离两侧海马组织,置入冻存管后储存于-80 ℃冰箱备用。每组剩余4只大鼠采用心尖注射4%多聚甲醛的方式对组织进行灌注固定,灌注结束后,快速断头取脑,将分离得到的大鼠脑组织浸泡于含有4%多聚甲醛的离心管中,储存于4 ℃冰箱备用。
2.4 苏木精-伊红(hematoxylin-eosin,HE)染色观察海马CA1区神经细胞损伤情况 取4%多聚甲醛固定好的脑组织,通过组织脱水、切片(厚度设置为5 μm)后,采用HE染色法,对脑组织切片染色,最后于光学显微镜下观察,对大鼠海马CA1区神经细胞的形态学状况进行评价,于400倍镜下采集图像。
2.5 Western blot法检测大鼠海马PI3K/AKT/mTOR通路蛋白及自噬相关蛋白的表达水平 取超低温存储的海马组织提取总蛋白,采用BCA法对海马的总蛋白浓度进行定量。每组取等量总蛋白通过SDS-PAGE凝胶电泳法进行电泳分离,经PVDF转膜并以5%脱脂奶粉封闭2 h后加入兔抗大鼠一抗p-PI3K(1∶1 000),p-AKT(1∶2 000),p-mTOR(1∶1 000),LC3A/B(1∶1 000),Beclin-1(1∶1 000),P62(1∶1 000),4 ℃孵育过夜。隔日加入山羊抗兔IgG二抗(1∶20 000)孵育2 h,在加入ECL显影剂显色后通过FCM凝胶成像系统成像并获得曝光条带。以蛋白条带及其对应的内参条带的灰度值比值进行数据处理,实验独立重复3次。
2.6 qRT-PCR法检测大鼠海马的PI3K/AKT/mTOR通路蛋白及自噬相关蛋白mRNA的表达水平 取超低温存储的海马组织,采用TRIzol试剂裂解组织,提取海马细胞总RNA。逆转录形成cDNA。本实验参照SYBR Green试剂盒说明书,进行qRT-PCR体系的配制,使用ABI 7 500荧光定量PCR仪进行PCR扩增(95 ℃ 1 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 45 s,40个循环);72 ℃检测信号。每个样本基因均进行3次独立重复检测,以β-actin作为内参值,对目的基因采用2-ΔΔCT法进行计算统计,实验结果取平均值。引物序列见表1。

表1 RT-PCR基因引物信息

3 结果
3.1 芦荟大黄素对AD大鼠学习记忆能力的影响 与空白组比较,模型组大鼠逃避潜伏期明显延长(P<0.05),穿越平台次数明显减少(P<0.05);与模型组比较,芦荟大黄素组大鼠逃避潜伏期明显缩短(P<0.05),穿越平台次数显著增加(P<0.05)。见图1。
3.2 芦荟大黄素对AD模型大鼠海马CA1区形态学变化的影响 空白组大鼠海马神经细胞排列整齐,分布紧凑,细胞核清晰可见,细胞形态饱满完整;模型组大鼠海马神经细胞排列紊乱,分布稀疏,细胞核收缩不可见,胞体变形皱缩伴有明显破裂;芦荟大黄素组大鼠海马神经细胞CA1区病理有明显改善,细胞排列较为紧密,仅个别神经细胞存在损伤,细胞形态结构接近空白组。见图2。

注:A.空白组;B.模型组;C.芦荟大黄素组;与空白组比较,*P<0.05;与模型组比较,#P<0.05

图2 各组大鼠海马CA1区神经细胞形态变化(HE染色,10×40倍)
3.3 芦荟大黄素对AD模型大鼠海马自噬蛋白表达的影响 与空白组比较,模型组大鼠海马自噬蛋白P62的相对表达水平明显增加(P<0.05),Beclin-1和LC3Ⅱ/Ⅰ的相对表达水平明显降低(P<0.05);与模型组比较,芦荟大黄素组大鼠海马自噬蛋白P62的相对表达水平明显降低(P<0.05),Beclin-1和LC3Ⅱ/Ⅰ的相对表达水平明显增加(P<0.05)。见图3。

注:A.空白组;B.模型组;C.芦荟大黄素组;与空白组比较,*P<0.05;与模型组比较,#P<0.05
3.4 芦荟大黄素对AD模型大鼠海马自噬蛋白mRNA表达的影响 与空白组比较,模型组大鼠海马自噬蛋白P62 mRNA表达水平明显增加(P<0.05),Beclin-1和LC3 mRNA表达水平明显降低(P<0.05);与模型组比较,芦荟大黄素组大鼠海马自噬蛋白P62 mRNA表达水平明显降低(P<0.05),Beclin-1和LC3 mRNA表达水平明显增加(P<0.05)。见图4。
3.5 芦荟大黄素对AD模型大鼠海马PI3K/AKT/mTOR通路蛋白表达的影响 与空白组比较,模型组大鼠海马通路蛋白p-PI3K、p-AKT、p-mTOR的相对表达水平均明显增加(P<0.05);与模型组比较,芦荟大黄素组大鼠海马通路蛋白p-PI3K、p-AKT、p-mTOR的相对表达水平均明显降低(P<0.05)。见图5。
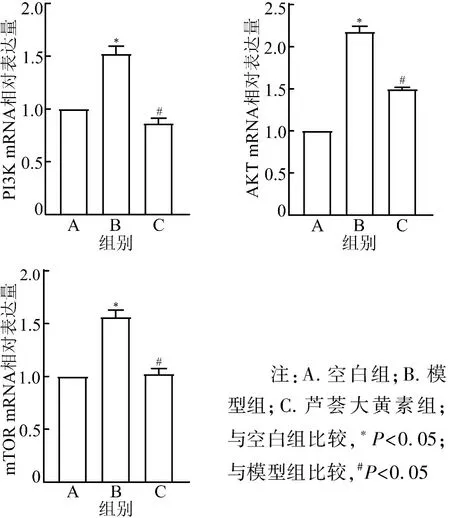
3.6 芦荟大黄素对AD模型大鼠海马PI3K/AKT/mTOR通路蛋白mRNA表达的影响 与空白组比较,模型组大鼠海马通路蛋白PI3K、AKT、mTOR mRNA相对表达水平明显增加(P<0.05);与模型组比较,芦荟大黄素组大鼠海马通路蛋白PI3K、AKT、mTOR mRNA相对表达水平均明显降低(P<0.05)。见图6。

注:A.空白组;B.模型组;C.芦荟大黄素组;与空白组比较,*P<0.05;与模型组比较,#P<0.05
注:A.空白组;B.模型组;C.芦荟大黄素组;与空白组比较,∗P<0.05;与模型组比较,#P<0.05
4 讨论
自噬作为一种细胞降解自身内容物的机制,在神经细胞代谢中具有重要作用[12]。AD自噬障碍引发的病理蛋白聚集形成的神经纤维缠结和老年斑及其导致的氧化应激与神经炎症等都是推动AD病程发展的主要因素[13]。目前研究[14-15]表明,通过药物恢复AD神经细胞中受损的自噬功能能够促进自噬对病理蛋白的降解,减少神经细胞毒性物质积累并保护神经细胞。因此,通过调控自噬来增强神经细胞对毒性蛋白的降解是治疗AD的有效手段。
芦荟大黄素作为一种天然药物单体成分受到了很多研究者的关注。有研究表明,芦荟大黄素能够改善痴呆小鼠的学习记忆能力[16],抑制Al3+引起的细胞内Al3+-Aβ42的聚集,缓解细胞毒性[17]。目前探讨芦荟大黄素对AD治疗机制研究较少。因此,本实验开展了芦荟大黄素防治AD的作用及相关机制研究。结果显示,芦荟大黄素可以显著恢复模型组大鼠的学习记忆能力,改善海马CA1区神经细胞的损伤与丢失。
自噬的调控是一种自发的动态过程。当细胞需要清理受损、老化的细胞器和危害细胞的病理蛋白质聚集体时,自噬水平会自适应地进行调节以满足需要[18]。Beclin-1、LC3、P62蛋白作为经典的自噬标志物参与了自噬过程中自噬小体形成与自噬溶酶体降解的过程[19]。Beclin-1是一种自噬效应蛋白,能够作为分子反应的“平台”,协助自噬相关蛋白(Atg)之间进行组装。研究[20]表明,AD自噬障碍会导致Beclin-1表达水平降低。LC3在自噬过程中会在Atg复合物的作用下剪切为LC3Ⅱ。LC3Ⅱ可以连接自噬体膜,形成完整闭合的自噬小体,因此LC3Ⅱ与LC3Ⅰ的比值能够反映细胞自噬强度[21]。此外,P62是一种自噬接头蛋白,其作为自噬溶酶体的消耗底物与自噬溶酶体一同降解。在自噬发生抑制时,P62由于无法与自噬溶酶体一同降解而产生堆积[22]。本实验研究发现,模型组大鼠Beclin-1与LC3Ⅱ/Ⅰ的蛋白表达及其对应mRNA表达水平明显降低,P62蛋白表达及其对应的mRNA表达水平明显提高。而芦荟大黄素组在经过治疗后,可以明显提高模型组大鼠海马Beclin-1与LC3Ⅱ/Ⅰ的蛋白表达及其对应mRNA表达水平,降低P62蛋白表达及其对应的RNA表达水平。上述结果显示,模型组大鼠海马神经细胞发生了自噬障碍,而芦荟大黄素可以改善模型组大鼠神经细胞中发生的自噬抑制,提升AD神经细胞的自噬水平。
PI3K/AKT/mTOR通路是一条经典的信号通路,该通路具有调控自噬启动的能力。当该信号通路被激活时,通路上游的PI3K会发生磷酸化,随后将磷脂酰肌醇磷酸化为磷脂酰肌醇三磷酸,磷脂酰肌醇三磷酸则会进一步结合3-磷酸肌醇依赖性蛋白激酶1去磷酸化下游的AKT[23],而磷酸化AKT则会进一步磷酸化激活mTOR[24]。最终,被磷酸化激活的mTOR通过抑制性磷酸化Unc-51自噬激活激酶1(unc-51 like autophagy activating kinase 1,ULK1),抑制ULK1对自噬过程的启动[25]。因此,通过抑制AD中过度激活的PI3K/AKT/mTOR通路,可以降低mTOR的表达水平,从而促进细胞自噬对病理蛋白的清除,改善AD症状[26-27]。本实验研究发现,模型组大鼠的p-PI3K、p-AKT、p-mTOR蛋白表达及其对应mRNA表达水平明显提高;而芦荟大黄素组在经过芦荟大黄素治疗后,p-PI3K,p-AKT,p-mTOR蛋白表达及其对应mRNA表达水平明显降低。上述结果显示,模型组大鼠海马神经细胞发生了PI3K/AKT/mTOR通路的异常激活,而芦荟大黄素可以抑制模型组大鼠海马神经细胞中过度激活的PI3K/AKT/mTOR通路。
综上所述,本研究发现芦荟大黄素能够改善AD模型大鼠海马CA1区的神经细胞损伤,发挥对AD模型大鼠的神经保护作用,该作用与抑制AD中过度激活的PI3K/AKT/mTOR通路并促进神经细胞自噬有关。今后将对芦荟大黄素在大鼠体内的最佳治疗剂量进行筛选并在后续验证中利用自噬抑制剂进行体外实验,为进一步探究芦荟大黄素改善AD的作用机制提供科学依据和理论基础。

