基于纳米金/石墨烯修饰电极的免疫传感器检测噻虫啉
姚 军,毛 慧,张 芹,赵国政,张晋华
(1.南京理工大学 环境与生物工程学院,江苏 南京 210094;2.泰州市生态环境局,江苏 泰州 225300;3.江苏省泰州环境监测中心,江苏 泰州 225300;4.南京师范大学 化学与材料科学学院,江苏 南京 210023;5.山西师范大学 磁性分子与磁信息材料教育部重点实验室,山西 临汾 041004)
噻虫啉(Thiacloprid)是在吡虫啉基础上,Bayer公司开发的具有广谱、内吸性新型烟碱类杀虫剂[1,2]。噻虫啉是目前优良的杀虫剂品种之一,其分子结构如图1所示,在我国应用广泛,前景良好[3,4]。近年来,农药管理监督力度不够,农药过度滥用,导致所种植的农作物药害,环境被严重污染,食品中毒事件频发[5-7]。因此,寻找快速准确的噻虫啉检测技术是人们的迫切希望,研究意义重大[8,9]。
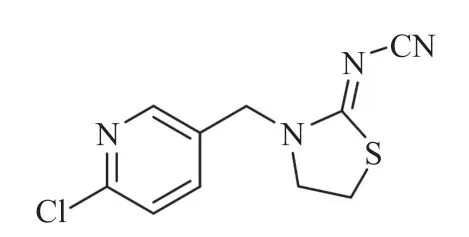
图1 噻虫啉的分子结构
目前用于噻虫啉残留检测的方法主要有高效液相色谱法[10]、液相色谱-质谱联机法[11]和固相萃取-高效液相色谱法[12]。但这些检测方法对仪器的操作性要求较高,需要一定的专业技术背景,检测时间较长,难以实现现场检测。以抗原/抗体作为生物识别物质的纳米电化学免疫传感器,具有很好的选择性、较多的种类、较低的测试费用和适合联机化的优点,同时不受样品颜色、浊度的影响,以及所需仪器设备相对简单,具有简便、快速、体积小的优点,已经广泛应用于各个相关领域。目前,石墨烯优异的电化学性能受到广泛关注[13,14],石墨烯复合物研究引起了新的热潮[15-17],由纳米金修饰石墨烯的复合材料便是其中之一[18]。Yang等[19]利用纳米金-石墨烯复合材料,检测一种模型农药对氧磷,表现出较高的灵敏度、较低检出限和较好稳定性。Han等[20]利用纳米金-石墨烯复合材料检测癌胚抗原,线性范围0.01~80 ng·mL-1,最低检测限达到3.4 pg·mL-1。
本文建构了纳米金/石墨烯复合纳米材料修饰电极的免疫传感器,基于循环伏安法(Cyclic voltammetry,CV)表征了电极表面的电化学性质,通过间接竞争法实现了体系中噻虫啉的高灵敏检测,并对香蕉、西红柿、苹果和大米实际样品进行了检测。
1 材料与方法
1.1 仪器与试剂
CHI852C电化学工作站(上海辰华仪器公司);噻虫啉(Sigma-Aldrich公司);壳聚糖(Sigma-Aldrich公司);噻虫啉抗体(南京晓庄学院生物化工与环境工程学院);牛血清白蛋白(Bovine serum albumin,BSA,南京生兴生物技术有限公司);磷酸缓冲溶液(Phosphate buffer solution,PBS,ThermoFisher公司)。试验用水为二次蒸馏水。
1.2 免疫传感器的制备
噻虫啉溶液的制备:准确称取0.05 g噻虫啉,溶于10 mL N,N-二甲基甲酰胺(N,N-Dimethylformamide,DMF)中,配得0.5 mg·mL-1噻虫啉溶液。蒸馏水对上述标准液稀释,得到0.2 mg·mL-1噻虫啉溶液。
石墨烯分散液的制备:准确称取0.05 g石墨烯[21],溶于2 mL蒸馏水,超声分散得石墨烯分散液。
玻碳电极(Glassy carbon electrode,GCE)的处理:将电极依次在直径为0.3μm和0.05μm的Al2O3抛光粉上打磨,分别在无水乙醇-蒸馏水、蒸馏水中各超声清洗5 min,蒸馏水冲洗,在2 mM K3Fe(CN)6中扫CV图,以电势差在100 mV以内为标准,衡量电极是否打磨完好。将打磨好的电极放在室温下,晾干。
通过电化学沉积将纳米金修饰在玻碳电极上,再将4μL石墨烯分散液滴涂于电极上,最后将2μL浓度为0.2 mg·mL-1的噻虫啉溶液滴涂于电极表面,40℃烘干。修饰过的电极浸泡在5%的BSA溶液中,37℃烘箱中孵育30 min,以封闭剩余的活性位点。
1.3 香蕉/西红柿/苹果样品的前处理
称取2±0.005 0 g香蕉/西红柿/苹果于10 mL样品管中,加入噻虫啉溶液和3 mL乙腈,超声30 min,离心10 min(2 000 r·m-1),将上清液转移至样品管,50℃氮气吹干,将1 mL pH=7.4的PBS加入样品管,溶解浓缩物。
1.4 大米样品的前处理
称取1±0.005 0 g大米于10 mL样品管,加入噻虫啉溶液,2 mL蒸馏水浸泡15 min,再加入2 mL乙腈,超声30min,离心10min(2 000 r·m-1),将上清液转移至样品管,50℃氮气吹干,1 mL pH=7.4的PBS加入样品管,溶解浓缩物。
1.5 电化学检测
工作电极、参比电极与辅助电极分别为纳米金/石墨烯/噻虫啉修饰的玻碳电极、Ag/AgCl电极与铂丝电极,通过CV研究不同修饰电极的电化学行为,运用差分脉冲伏安法(Differential pulse voltammetry,DPV)对杀虫剂噻虫啉进行电化学检测。
2 结果与讨论
2.1 免疫传感器检测噻虫啉的原理
纳米金/石墨烯修饰电极的免疫传感器检测噻虫啉的原理如图2所示。(1)纳米金/石墨烯/噻虫啉电极浸入噻虫啉抗体和游离噻虫啉的孵育液时,固定在电极上的噻虫啉、溶液中游离的噻虫啉分别竞争结合噻虫啉抗体;(2)噻虫啉和噻虫啉抗体之间存在特定的竞争反应,从而使抗体在电极上发生吸附;(3)所形成的抗体-抗原复合物致使电极产生位阻,降低峰值电流。基于电化学信号的差异,实现噻虫啉的定量检测。
2.2 试验条件的优化
孵育时间的优化由DPV确定。首先,用一定体积的抗体依次孵育0、10、15、20、25和30 min。纳米金/石墨烯/噻虫啉电极的DPV峰电流随孵育时间的变化趋势,如图3(a)所示,前25 min电流值快速下降,到25~30 min电流值增加。所以,选择25 min作为免疫反应时间为宜。
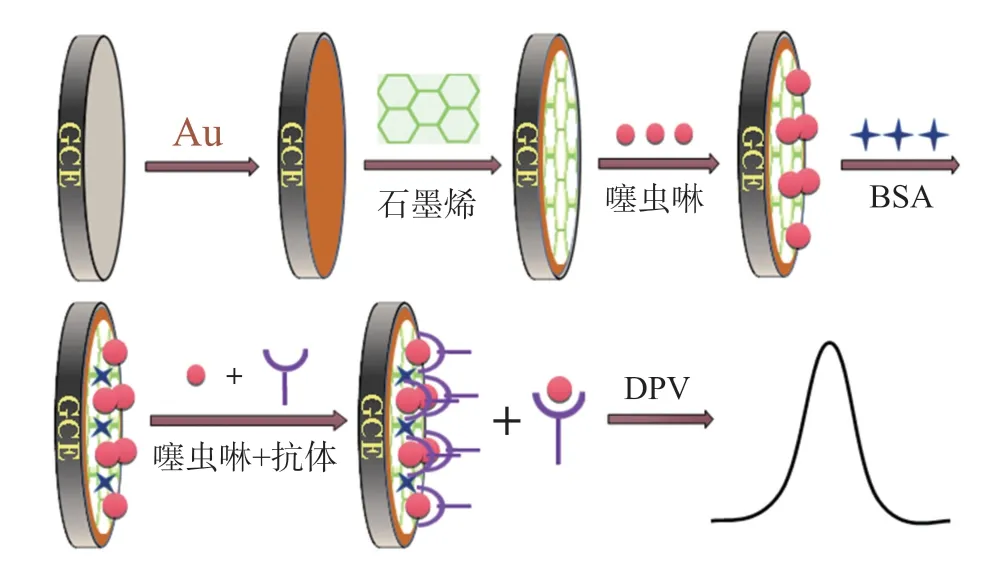
图2 纳米金/石墨烯修饰电极的免疫传感器检测噻虫啉的原理
孵育溶液中噻虫啉抗体含量的优化由DPV确定。在不同抗体浓度的50μL溶液中,浸入纳米金/石墨烯/噻虫啉电极,孵育25 min,如图3(b)所示。噻虫啉抗体含量从0μL变化至10μL时,DPV峰值电流明显降低。噻虫啉抗体体积从10μL增至20μL时,峰值电流变化不大,表示电极上的结合位点基本达到饱和。因此,选择10μL作为反应中抗体体积。
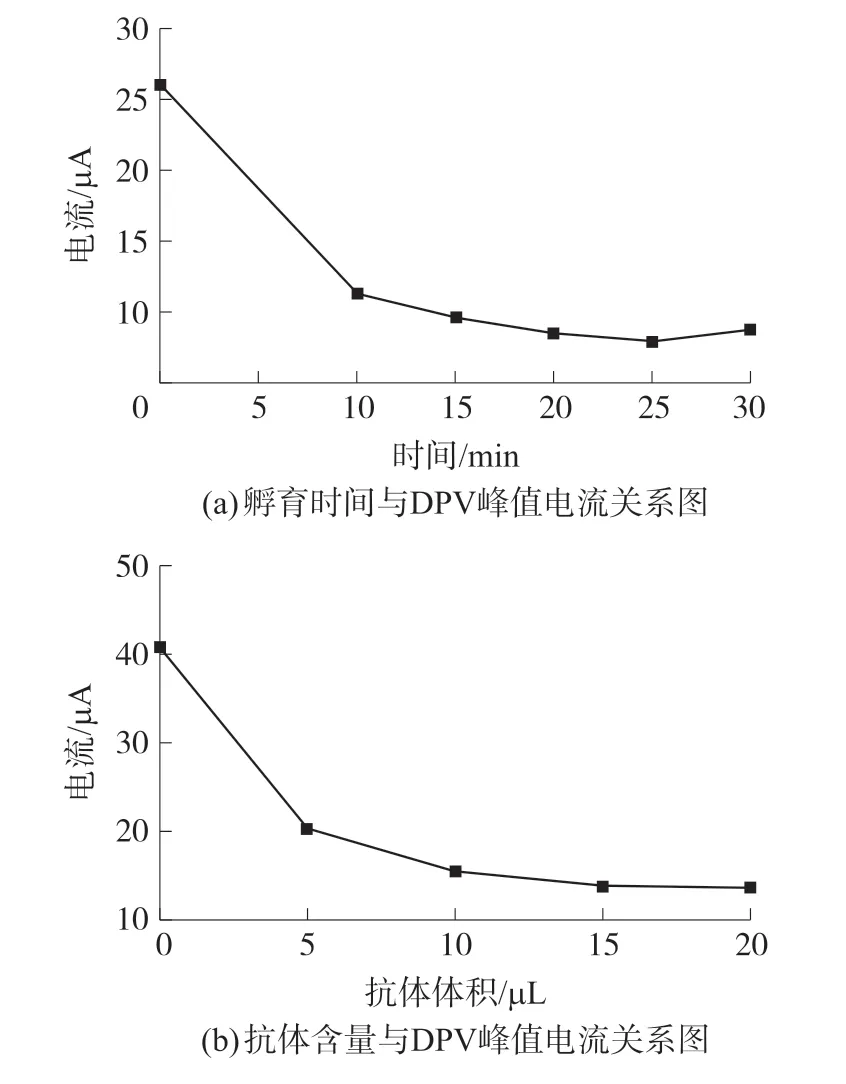
图3 孵育时间和抗体含量与DPV峰值电流关系图
2.3 免疫传感器的循环伏安分析
不同阶段修饰电极的CV曲线如图4所示。裸电极a的CV曲线存在一对明显的氧化还原峰。修饰了纳米金/石墨烯/噻虫啉之后的电极b,由于石墨烯优异的电化学活性,CV峰值电流显著增大,电子传递明显增强。放入孵育液之后的电极c,由于特异性免疫反应,电子传递受到阻碍,CV峰值电流下降,表明噻虫啉已修饰到电极上。
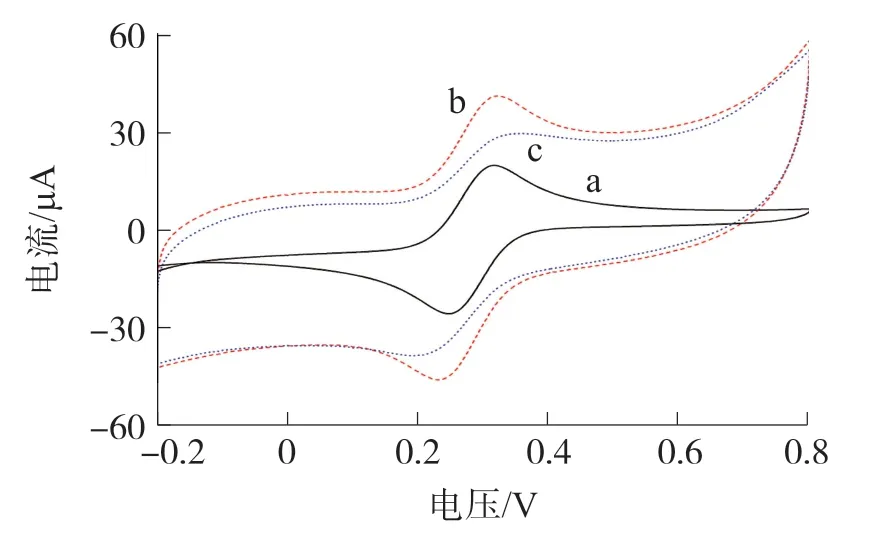
图4 不同修饰电极在2 mM K3[Fe(CN)6]PBS溶液中的CV曲线
2.4 噻虫啉的检测
孵育液中游离的噻虫啉、固定在电极表面的噻虫啉竞争分别与溶液中噻虫啉抗体反应,如图5所示,孵育液浓度分别为(a)5 000 ng·mL-1;(b)4 000 ng·mL-1;(c)3 000 ng·mL-1;(d)2 000 ng·mL-1;(e)1 000 ng·mL-1;(f)500 ng·mL-1;(g)100 ng·mL-1;(h)50 ng·mL-1;(i)10 ng·mL-1。从图5可看出,孵育液中,噻虫啉浓度的增加,导致DPV峰值电流逐渐增加。定义在仅含5μL抗体的PBS溶液中,纳米金/石墨烯/噻虫啉电极的响应电流为I0,在含有游离噻虫啉的孵育液中,电极的响应电流为I x,响应电流的差值ΔI与噻虫啉浓度在10~5 000 ng·mL-1范围内成正比,检出限为0.7 ng·mL-1,低于文献中超高效液相色谱法对噻虫啉的残留检测[22]。
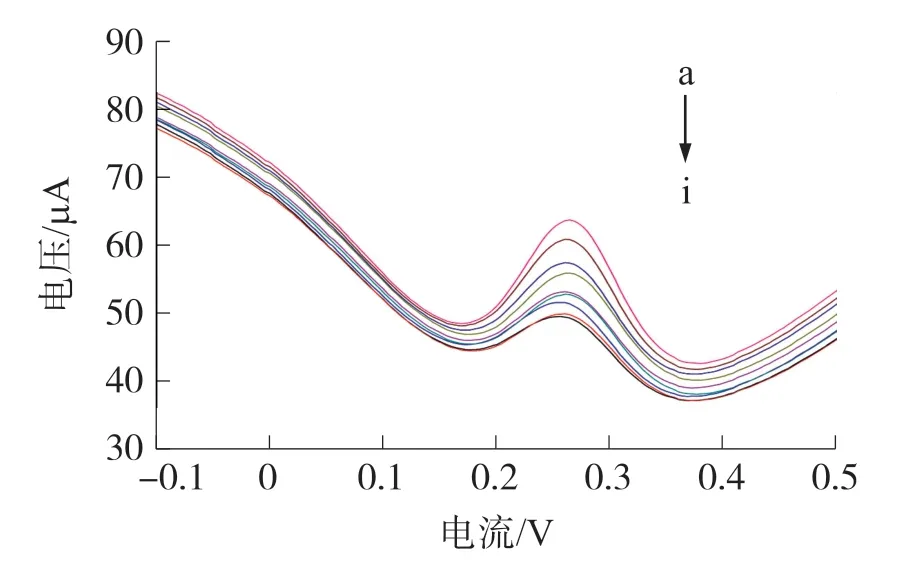
图5 不同浓度孵育液中,纳米金/石墨烯/噻虫啉电极的DPV曲线
2.5 重复性与稳定性
对纳米金/石墨烯/噻虫啉修饰电极进行5次DPV扫描,峰值电流的相对标准偏差小于5.5%,表明修饰电极重复性较好。
将纳米金/石墨烯/噻虫啉电极存放在空气中,每隔一天进行DPV扫描,峰值电流的相对标准偏差小于6.5%,表明修饰电极稳定性较好。
2.6 香蕉样品的分析
对3种加入不同量噻虫啉溶液的香蕉样品进行DPV测定,平行测定3次,见表1。如表1所示,噻虫啉的回收率在88.2%~101.1%之间,平均为95.0%。
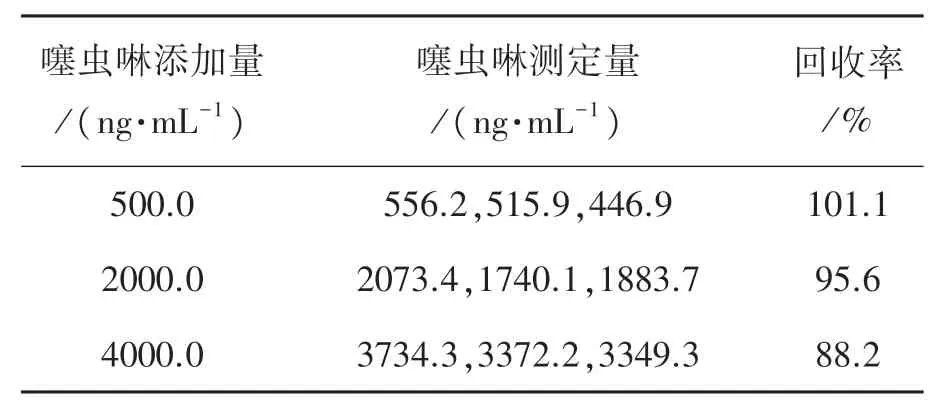
表1 香蕉样品加标处理检测噻虫啉试验结果
2.7 西红柿样品的分析
对3种加入不同量噻虫啉溶液的西红柿样品进行DPV测定,平行测定3次,见表2。如表2所示,噻虫啉的回收率在95.8%~98.6%之间,平均为97.1%。
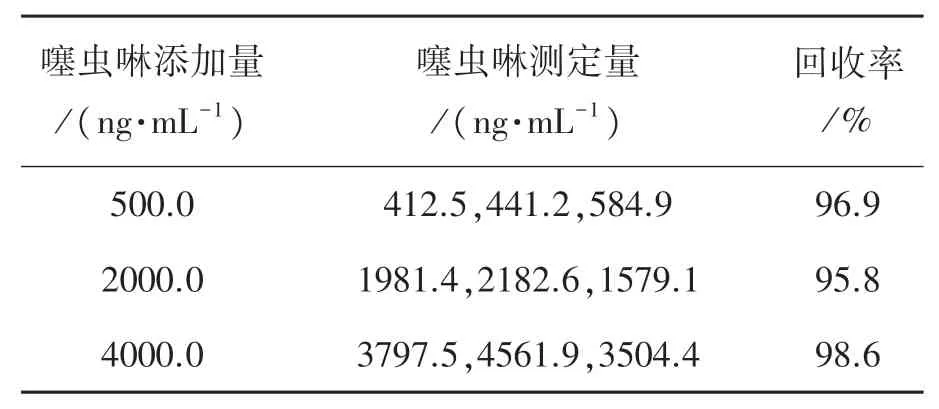
表2 西红柿样品加标处理检测噻虫啉试验结果
2.8 苹果样品的分析
对3种加入不同量噻虫啉溶液的苹果样品进行试验前处理并测定,每个浓度测定3次,根据标准曲线,噻虫啉的回收率在87.1%~113.4%之间,平均为102.9%,统计结果见表3。
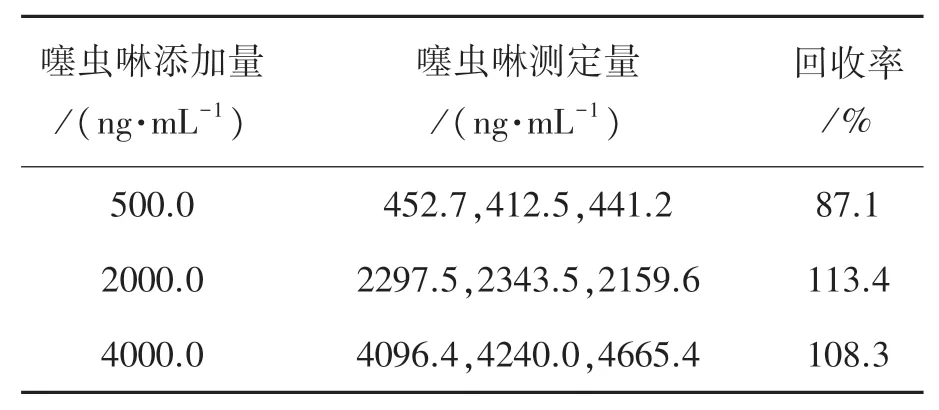
表3 苹果样品加标处理检测噻虫啉试验结果
2.9 大米样品的分析
对3种加入不同量噻虫啉溶液的大米样品进行DPV测定,平行测定3次,见表4。如表4所示,噻虫啉的回收率在92.8%~103.2%之间,平均为98.5%。
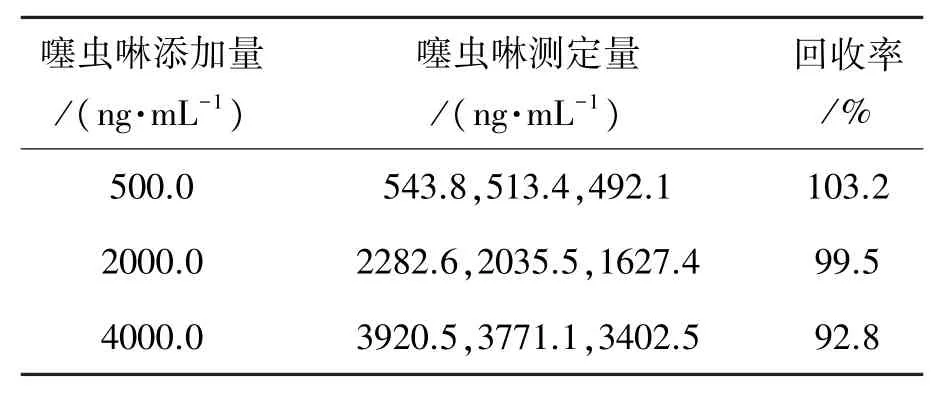
表4 大米样品加标处理检测噻虫啉试验结果
3 结束语
本文构建了一种新型纳米金/石墨烯/噻虫啉电化学免疫传感器检测噻虫啉,结合石墨烯优异的导电性能,以及纳米金优良的导电性能和生物相容性,使纳米金、石墨烯与噻虫啉抗原共同固定于玻碳电极上检测噻虫啉。响应电流的增加ΔI与噻虫啉浓度在10~5 000 ng·mL-1范围内成正比,检出限为0.7 ng·mL-1。这一新型免疫传感器具有较好的重复性、稳定性,将其应用于香蕉、西红柿、苹果与大米等实际样品的检测,取得了满意的结果。

