杜梨砧木组培扩繁技术研究*
杨冠宇,王 斐,张艳杰,马 力,李佳纯,欧春青,姜淑苓
(中国农业科学院果树研究所,农业农村部园艺作物种质资源利用重点实验室,辽宁兴城 125100)
梨是一种世界性的水果,在我国水果产业中有着举足轻重的地位,栽培面积和产量仅次于柑橘和苹果,位居第三[1]。随着我国梨产业的快速发展以及环境和气候条件的日益变化,砧木作为梨树的重要组成部分,对梨树生长的影响越来越大。我国梨生产上常用的梨砧木主要有杜梨(Pyrus betulifoliaBunge)、豆梨(Pyrus calleryanaDecne)、山梨(Pyrus ussuriensisMaxim)、川梨(Pyrus pashiaBuch.-Ham.ex D.Don)和木梨(Pyrus xerophilaT.T.Yu)等[2],其中杜梨具有抗干旱、耐寒、分布广、适应性强、结果期早、寿命长等特点[3],是应用最广泛的梨砧木之一。目前,生产中使用的杜梨砧木多为实生种子繁殖,种子来源各不相同,生产的苗木参差不齐,不利于现代化标准化梨园的建设。梨组织培养具有用材少、不受季节影响、繁殖系数高等优点,生产的苗木整齐一致,能满足短期大规模生产需要[4],并且可以加快育种进程[5],在梨无性系砧木生产和现代生物育种中具有重要作用。
目前,已有关于梨组培扩繁研究的报道,李本波[6]探究了NAA 与6-BA 等植物生长调节剂组合对杜梨继代组培苗的影响,发现NAA 浓度在0.1~0.5 mg/L、6-BA 浓度在0.5~2.0 mg/L 时组培苗生长状况较好。卢明艳等[7]在对梨砧木优系1-127 的研究中发现,组培苗适宜的增殖培养基为WPM+2.0 mg/L 6-BA+0.2 mg/L IBA。苗冉冉等[8]研究发现,津香蜜梨适宜的继代增殖培养基为MS+1.0 mg/L 6-BA+0.2 mg/L NAA,增殖系数为5.73,巴梨适宜的继代增殖培养基为MS+1.0 mg/L 6-BA+0.05 mg/L NAA,增殖系数为3.83。刘春等[9]在对京白梨的研究中发现,采用MS+3 mg/L 6-BA+0.5 mg/L NAA+1.5 mg/L GA3作为增殖培养基,可有效提高京白梨优良单株组培快繁育苗效率。李昌珠等[10]用12个基因型的欧洲梨作为试材,研究表明梨的不同基因型间离体繁殖和形态分化显著不同。在梨组织培养方面,还需加大对不同品种的研究范围,建立多品种适宜的组织培养快繁体系。
由于杜梨为野生类型,不同株系的组培特性、抗性和适应性等性状各不相同,为进一步丰富杜梨组培资源,筛选适宜的株系进行砧木苗繁育和生物育种研究,本试验以不同来源的杜梨实生种子和新梢为外植体,开展不同消毒剂和消毒时间的消毒效果以及最佳继代增殖和生根培养基的筛选研究,以期为我国梨砧木规模化生产提供技术支持,为梨遗传转化体系构建和转基因研究奠定基础。

不同杜梨砧木的组培扩繁与生根移栽情况Tissue culture propagation,rooting and transplanting of different Pyrus betulifolia rootstocks
1 材料和方法
1.1 试验材料
试验材料采集于中国农业科学院果树研究所梨育种试验园保存的来自山西、河北、辽宁等不同地区收集的实生杜梨株系,树龄均在10 年以上。其中,选取树体健壮、新梢发育良好的株系11 个,于春季新梢刚刚长至5~8 cm 时取田间幼嫩的新梢为外植体,于秋季采集21 个株系上健康成熟果实的种子为外植体,分别开展组培试验。
1.2 试验方法
1.2.1 外植体消毒与初代培养
将采回来的枝条剪成2~3 cm 的单芽茎段,种子经层积处理,然后依次用洗衣粉上清液浸泡30 min,用清水清理干净洗衣粉残留,移至无菌环境,无菌水冲洗3 遍,75%酒精浸泡30 s,再分别用0.1%HgCl2溶液处理5、8、10、12 min 或5%NaClO 溶液处理5、8、10、15 min,无菌水冲洗3~5 遍,最后将清洗干净的外植体用无菌滤纸吸干水分,接种到MS+6.5 g/L 琼脂+30 g/L 蔗糖+0.2 mg/L ZT+0.15 mg/L 6-BA+0.2 mg/L IAA+0.1 mg/L IBA+0.5 mg/L GA 的初代培养基上,置于25 ℃、光照16 h 黑暗8 h 光周期下培养。分别在上述试验材料中各选取4个株系的种子和茎段开展上述试验,每处理每个株系接种种子和茎段各5 粒(个),3 次重复。每隔3~5 d 观察1 次,及时为有污染外植体瓶中的未被污染的外植体更换培养基,40 d 后统计污染率以及成活率,筛选出最佳的消毒方法和生长良好的株系。其余株系的种子和茎段以筛选出来的最佳方案处理。
1.2.2 继代培养
以初代培养获得的2 个生长较良好的株系为试材,分别在初代培养基的基础上,设置0.1、0.15、0.2、0.25、0.3、0.5、1.0、1.5、2.0、2.5、3.0 mg/L的6-BA 梯度处理。每个处理接种3 瓶,每瓶接种5 个外植体,3 次重复。40 d 后调查外植体扩繁梢数和幼苗高度,并计算增殖倍数。
1.2.3 生根培养和移栽
生根试验采用一步生根法和两步生根法[11]2 种方法。
(1)一步生根法。取长势良好的培养苗,切取长度3~4 cm 的无根新茎,接种到分别添加0.1、0.3、0.5、1.0、2.0、3.0 mg/L IBA 的1/2MS 生根培养基上。每个处理接种2 瓶,每瓶接种5 个外植体,3 次重复。30 d 后统计生根率和生根条数。
(2)两步生根法。取长势良好的培养苗,切取长度3~4 cm 的无根新茎,接种到分别添加2.0、3.0、4.0 mg/L IBA 的MS 生根培养基上,分别暗处理2、3、4、5 d,然后转移至不添加任何生长调节剂的1/2MS 培养基中。每处理接种3 瓶,每瓶接种3 个外植体,3 次重复。30 d 后统计生根率和生根条数。
当试管苗根长3~4 cm 时,打开瓶口进行5 d的炼苗。然后清洗试管苗根部培养基,移栽至营养钵中,覆膜保湿,培养基质为草炭土∶黏土=1∶1。15 d 后,逐渐打开薄膜继续培养,待缓苗后带土移栽至田间。
1.3 数据处理与分析
试验数据用Excel 软件进行处理和统计,用SPSS 软件进行差异显著性分析。
2 结果与分析
2.1 不同消毒剂和消毒时间对杜梨不同外植体消毒效果的影响
2.1.1 不同消毒剂和消毒时间对杜梨种子消毒效果的影响
杜梨砧木种子经过灭菌后接种到初代培养基上,5 d 后出现不同程度的污染。如表1 所示,在2种不同的消毒剂处理下,随着消毒时间的延长,外植体的污染率均呈逐渐下降的趋势,存活率均呈先上升后下降的趋势。0.1%HgCl2处理10 min,虽然污染率(13.33%)略高于12 min 处理(10.00%),但外植体存活率最高(66.67%),消毒效果最好。5%NaClO 处理10 min 也具有较好的消毒效果,但存活率只有53.33%,低于0.1%HgCl2处理。综合污染率和存活率,最适合杜梨种子外植体的消毒方式为0.1%HgCl2处理10 min。上述处理共获得了14 份杜梨组培株系(图版2-A),其中,株系7-4 长势良好,用于下一步的继代增殖研究。
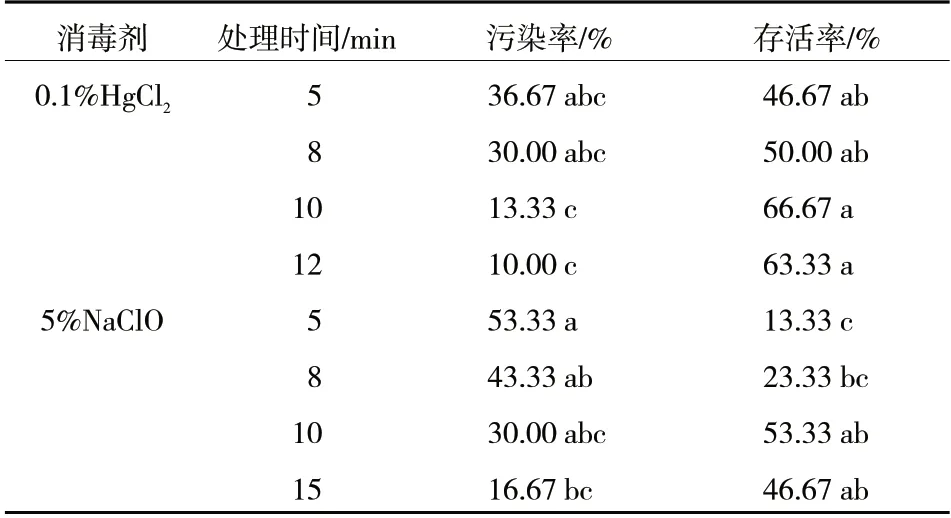
表1 不同消毒剂及消毒时间对杜梨种子消毒效果的影响
2.1.2 不同消毒剂和消毒时间对杜梨砧木茎段消毒效果的影响
杜梨茎段经过灭菌后接种到初代培养基上,3 d后出现污染,不同消毒时间和消毒剂处理下其污染率、存活率均有差异。如表2 所示,在2 种不同的消毒剂处理下,外植体的污染率和存活率也随着消毒时间延长分别呈逐渐下降和先上升后下降的趋势,2 种消毒剂分别在处理12 min 和15 min 时,污染率均降到了0,但存活率均较低。综合考虑污染率和存活率,以5%NaClO 处理10 min 效果最好,外植体存活率可达77.78%。上述处理共获得了7 份杜梨组培株系(图版2-B),其中,株系11-2 长势较好,用于下一步的继代增殖研究。
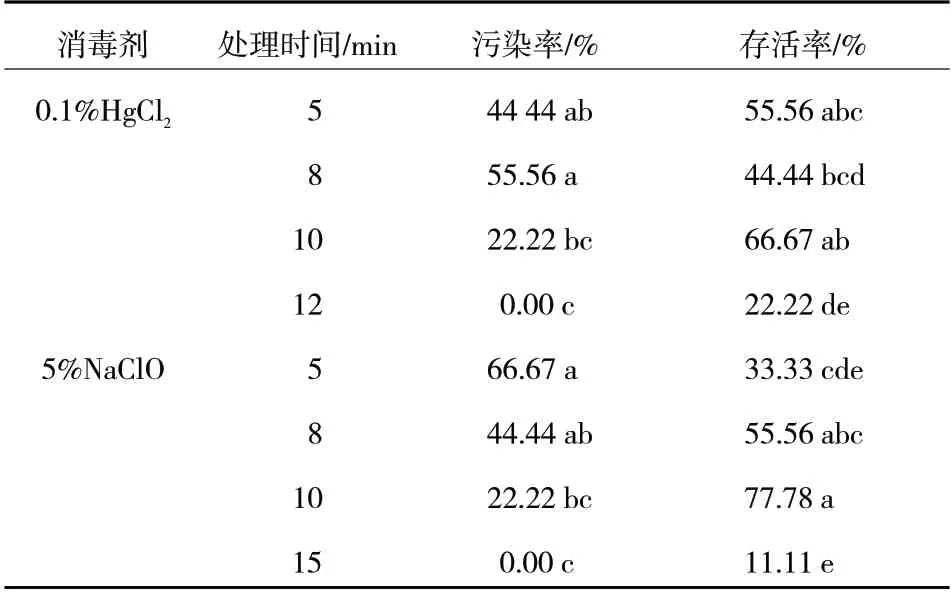
表2 不同消毒剂及消毒时间对杜梨茎段消毒效果的影响
2.2 不同浓度6-BA 对杜梨株系生长和增殖的影响
2.2.1 不同浓度6-BA 对杜梨株系7-4 生长和增殖的影响
由图版2-C 和表3 可以看出,杜梨株系7-4 组培苗在6-BA 浓度较低时,增殖系数较低,但株高较高,其中,6-BA 浓度为0.15 mg/L 时,株高最高,且叶片较大,枝条更为粗壮,适合进一步进行移栽、生根、再生等试验。随着6-BA 浓度的升高,7-4组培苗的增殖系数呈上升趋势,但浓度过高,会产生玻璃化现象且株高降低。其中,在6-BA 浓度为2.5 mg/L 时,增殖系数最高,达到6.33,但是组培苗有玻璃化现象。因此,综合考虑组培苗的生长状态,0.3~1.5 mg/L 的6-BA 浓度均可取得较好的增殖效果。
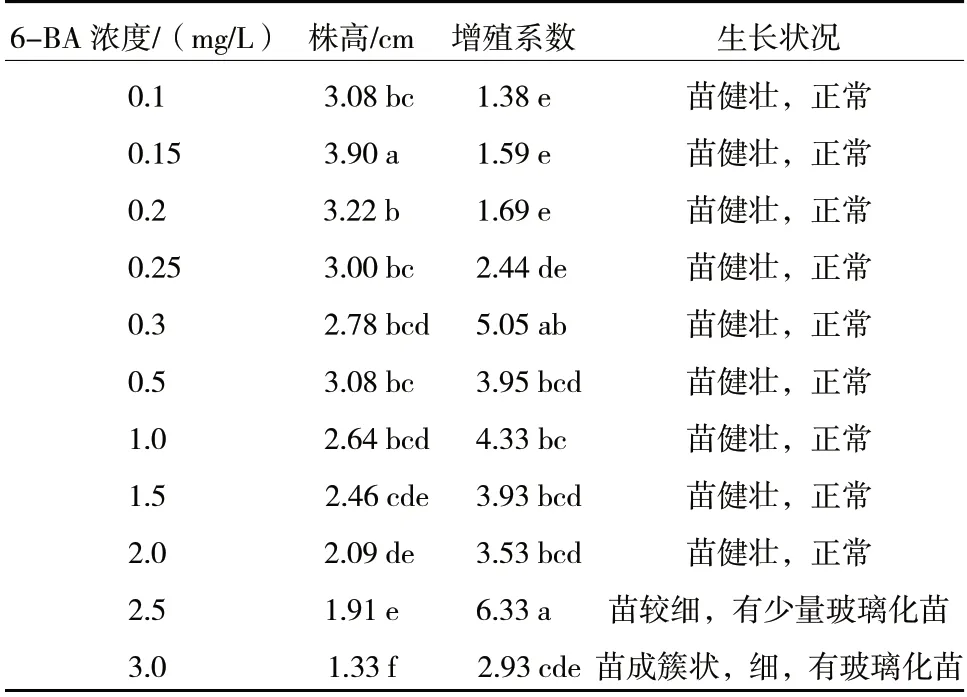
表3 不同浓度6-BA 对7-4 生长和增殖的影响
2.2.2 不同浓度6-BA 对杜梨株系11-2 生长和增殖的影响
如图版2-D、表4 所示,杜梨株系11-2 组培苗在不同6-BA 浓度处理下,整体株高和增殖系数均低于株系7-4,说明基因型对其组培苗的生长影响较大。当6-BA 浓度为0.1 mg/L 时,11-2 的株高最高,为2.32 cm,适合进一步进行移栽、生根、再生等试验。在各6-BA 浓度处理下,11-2 的增殖系数均较低,甚至不增殖,在浓度为2.0 mg/L 时,增殖系数最高,为1.88,此时的株高也较高,可作为株系11-2 增殖培养适宜的6-BA 浓度。
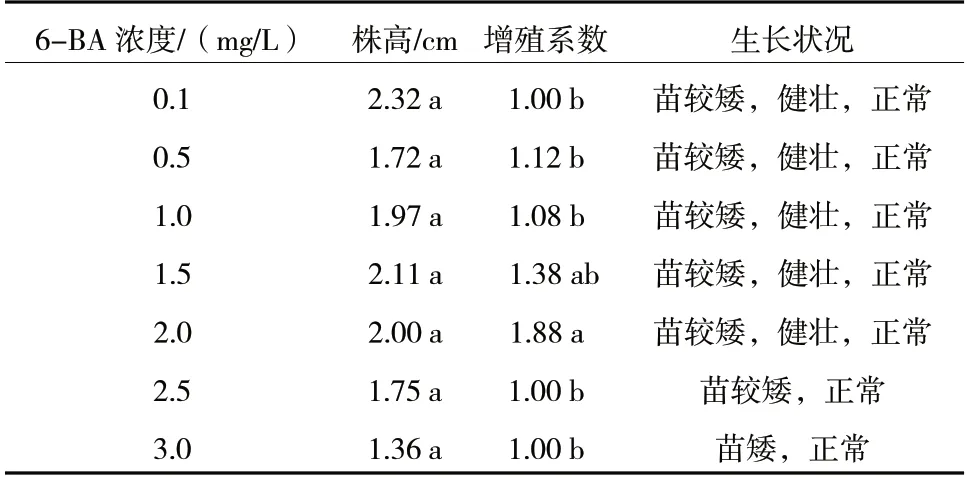
表4 不同浓度6-BA 对11-2 生长和增殖的影响
2.3 不同方法和不同浓度IBA 处理对杜梨株系7-4 生根的影响
前期试验得出11-2 苗矮,生长缓慢,不适宜进行生根试验;杜梨株系7-4 组培苗生长健壮,株高和繁殖系数均较高,对其进行了生根培养试验。如表5 所示,不同方法和不同浓度的IBA 处理对杜梨株系7-4 的生根影响较大,其中,一步生根法中不同浓度IBA 处理均能诱导其生根,但低浓度下生根率较低,浓度在0.3 mg/L 以下时,生根率在5.00%以下,当IBA 浓度增加到2.0 mg/L 时,其生根率达到最高,为85.00%,且显著高于其他处理,此时的平均生根数为3.82 条,也是所有处理中最高的。两步生根法中,前期IBA 处理天数对7-4 的生根影响较大,其中以4.0 mg/L IBA 处理3 d 效果最好,生根率(55.56%)和平均生根数(2.67 条)均较高,但低于一步生根法中的最佳浓度。因此,IBA 浓度为2.0 mg/L 的一步生根法最有利于杜梨株系7-4 的生根,将以此方法生根的7-4 组培苗进行了移栽,移栽成活率在90%以上(图版2-E)。
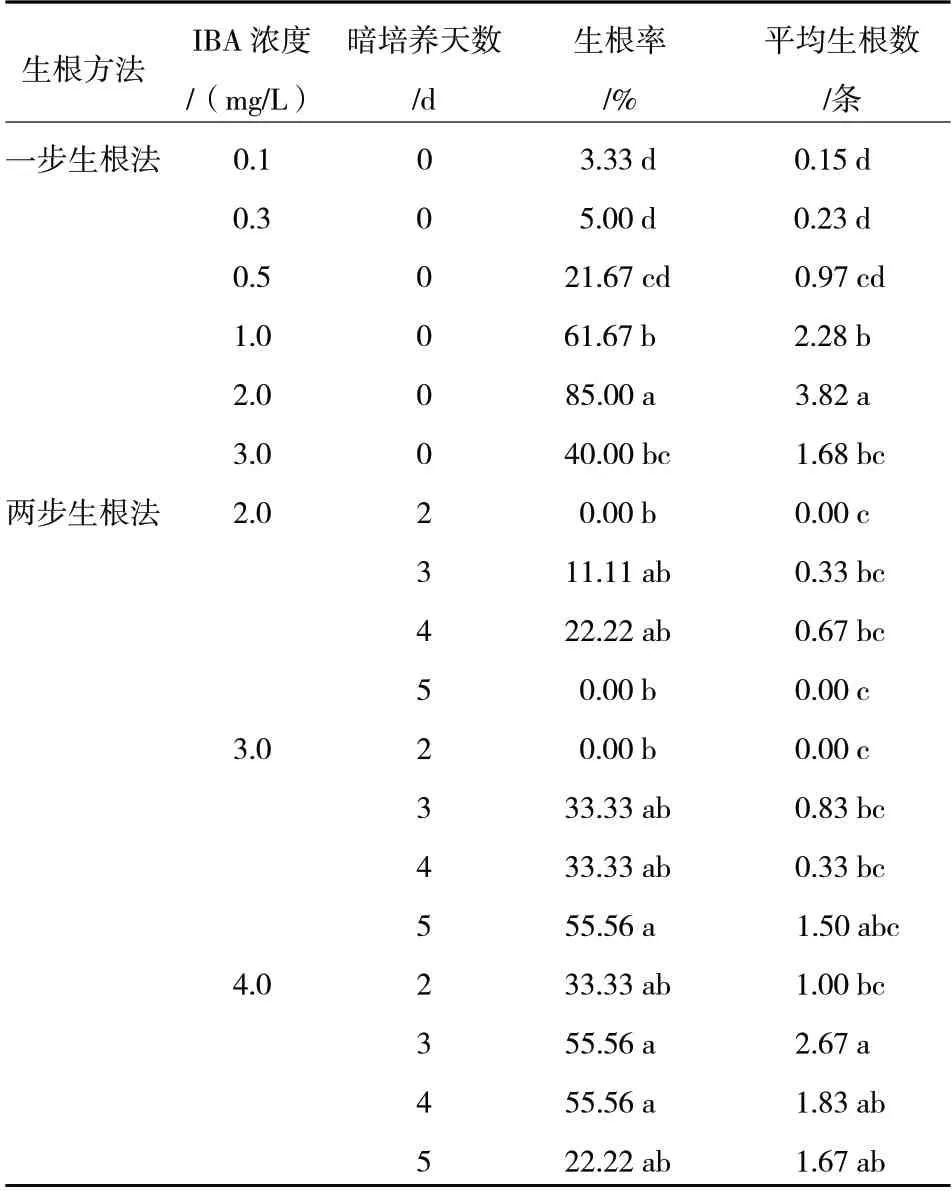
表5 不同生根方法对7-4 生根的影响
3 讨论与结论
氯化汞是一种剧毒的重金属消毒剂,次氯酸钠是一种氧化还原消毒剂,常用于植物组织培养的外植体消毒,杀菌时间过长,植物组织会中毒,生长点会被杀死,进而影响成活率;杀菌时间太短,将导致外源菌不能被完全杀死,增加污染率,合理的灭菌时间对于外植体的接种非常重要[12]。本研究中杜梨种子和幼嫩茎段分别以0.1%HgCl2消毒10 min和5%NaClO 消毒10 min 效果最好,这是由于种子具有种皮,而种皮较厚,可以使用更加强力的消毒剂,而茎段组织较为幼嫩,毒性过强的消毒剂在灭杀外源菌的同时,也提高了外植体的致死率,所以2 种外植体选用的最佳消毒剂有所不同。这与王莹等[13]对耐盐彩叶杜梨茎尖消毒试验的研究结果不同,其原因可能是选用的材料品种和试验部位不同。而本试验中种子材料采用5%NaClO 消毒10 min 也获得了53.33%的外植体存活率,虽然低于HgCl2处理,从环保的角度来看,该消毒方法也是一个不错的选择。
细胞分裂素和生长素是影响试管苗器官形成的主要因素[14]。前人研究表明,同一品种在不同培养基上的表现不同,不同品种在同一培养条件下表现也有所不同[15]。本试验中杜梨砧木茎段的增殖分化与细胞分裂素6-BA 浓度有关,在一定浓度范围内,茎段的增殖系数随着6-BA 浓度的升高而升高,但是当6-BA 超过一定浓度后,组培苗的生长状态出现异常。对于杜梨株系7-4 而言,当6-BA 浓度达到2.5 mg/L 时,组培苗开始出现玻璃化现象,并且开始变矮,虽然增殖系数有所增高,但是苗的状态已经不利于进一步的培养,植株纤细,有效茎少,多为簇状的无效茎;当6-BA 的浓度达到3.0 mg/L时,茎的增殖开始被抑制,增殖系数降低并且生成的无效茎多,不适宜进行增殖;当6-BA 的浓度为0.3、0.5、1.0、1.5 mg/L 时,其植株生长正常,其增殖系数均在3.9 以上。因此,本试验中确定7-4 株系增殖培养的最佳6-BA 浓度为0.3~1.5 mg/L。由此可知,想要进行有效的增殖,需要适当的6-BA浓度,过高或过低的6-BA 浓度都不利于增殖,6-BA的用量仅能在一定的范围内提高增殖率,这与王苏珂等[4]、汤绍虎等[16]和金青等[17]在6-BA 对梨组织培养影响的研究结果相一致。对于株系11-2 来说,在不同6-BA 浓度处理下,茎的增殖系数均较低,这可能与品种本身的基因型有关,然而除了6-BA,生长素和其他类型细胞分裂素组合也可能对其生长产生重要影响。如在邱玉宾等[18]和方明等[19]的研究中,生长素就分别对北美豆梨和杜梨的增殖产生了重要影响。本研究中仅对单一水平的生长素与不同浓度的6-BA 组合进行了试验,其他生长调节剂组合能否提高11-2 株系的增殖系数,还需要做进一步研究。
不定根诱导是组培过程中关键的一步[20],不定根的生长对组培苗在生产中大规模应用有着重要的意义,为组培苗的移栽和生长提供了良好的基础。生长素是诱导组培苗生根的重要因素,但生长素的种类和浓度都会对生根率和平均生根数有影响,浓度过高或过低都不利于组培苗的生根。目前,应用最多的生根诱导剂主要是IBA。前人研究表明,低糖低盐培养基有利于多数植物试管苗生根[21-22],而IBA 可以刺激嫩叶和嫩芽形成的IAA 的运输,从而促进生根,也可以在辅酶的作用下转化成IAA 发挥作用[23-24]。本研究以2.0 mg/L IBA 的一步生根法,在杜梨株系7-4 的生根研究中取得了良好效果,这与罗嘉亮等[25]研究的杜梨不定芽生根最理想的IBA 浓度为0.5 mg/L 的结果不同,可能是选用的杜梨株系和生长状态不同导致,但生根率与其比较有明显的提高,该结果可为7-4 株系的大规模生产应用提供有效的技术支撑。

