35 kDa透明质酸片段对脂多糖致犬炎症的作用
王家麒,郭田田,惠鑫鸿,赵方圆,惠觅宙
(青岛农业大学动物科技学院,山东青岛 266109)
细胞外基质透明质酸(又称玻尿酸)作为人类临床的应用制剂,由哈佛大学病理系的Endre Alexander Balazs主导开发已有50年。如今,人类对透明质酸的认识和应用又发生了本质性的变化。透明质酸和透明质酸片段参与了非特异性免疫炎症过程[1-3]。炎症几乎参与了人类所有疾病的病理过程,表现为红、肿、热、痛和炎性分泌物,主要由炎症细胞从血液向炎症部位渗透和聚集造成[4-5]。研究表明透明质酸和透明质酸片段通过与CD44和TLR4受体结合,促使动物白细胞向炎症部位渗透和聚集[1-6]。因此,研究透明质酸和透明质酸片段调节炎症的作用机制有重要的药学和临床医学意义。
多数小动物和小动物细胞水平的研究提示,透明质酸和透明质酸片段的功能与分子量大小有关[7-8],大量研究支持小分子透明质酸片段促进炎症,大分子透明质酸片段抑制炎症[9-19]。然而,以上大多数文献使用的透明质酸片段的分子量和生产方法均没有可靠的描述和记载。不同动物和不同组织来源的透明质酸和透明质酸片段的功能不同[20-21]。例如,裸鼹鼠和人类初乳中的透明质酸和透明质酸片段,虽然和普通透明质酸和透明质酸片段的化学成分相同,但其功能完全不同,具有抗炎性疼痛、抗衰老和抗肿瘤的功效[20-21]。这个研究结果提示不同动物和不同组织中的透明质酸和透明质酸片段可能有不同的与受体结合的立体结构,表现为不同的功能。不同种类的透明质酸酶剪切制造的小分子透明质酸片段的分子量大小和功能不同[22]。本文作者根据人类初乳含有的平均分子量35 kDa的抗炎透明质酸片段[23],使用人乳房含有的透明质酸酶PH20基因重组型蛋白,切割马链球菌制造的高分子透明质酸原料,制造35 kDa透明质酸片段(bioactive hyaluronic acid,B-HA),发现B-HA有明确的人皮肤黏膜抗炎和抗炎性疼痛的活性,即有效控制人皮肤黏膜的红、肿、热、痛和分泌炎性物质[24-36]。本文作者公布和定义了B-HA的制造方法和分子量分布[24-36],为B-HA的药学和临床医学应用奠定基础。
文献研究表明脂多糖(lipopolysaccharide,LPS)100 ng/kg静脉注射诱导犬和人产生急性炎症反应,表现为大量中性粒细胞激活后吸附和移走进入血管内皮,造成犬和人血中性粒细胞数量急剧下降[37-39];为了进一步研究B-HA对犬炎症的生物活性,探究了B-HA对LPS诱导犬的大量中性粒细胞吸附和移走进入血管内皮的影响。本试验首次使用犬研究了B-HA注射液的药理学作用,进一步为人体临床、作用机制和安全性研究奠定了基础。
1 材料和方法
1.1 材料与仪器
1.1.1 动物细胞
本试验采用雄性比格犬30只(青岛博隆实验动物有限公司),体质量(7±2) kg,在同一饲养条件下进行试验。
1.1.2 试剂与仪器
注射级分子量800~1 200 kDa的透明质酸原料购自华熙福瑞达生物医药有限公司;LPS购自北京索莱宝科技有限公司;犬肿瘤坏死因子(TNF-α)检测试剂盒、犬白介素(IL-17)检测试剂盒购自青岛百赛斯生物技术有限公司。
动物血液生化分析仪购自Abaxis(美国);多功能酶标仪(ELX808)购自美国伯腾仪器有限公司。
1.2 B-HA原料的生产与测定
试验采用了中国仓鼠卵巢细胞生产的有糖化重组人透明质酸酶PH20(纯度99.0%),通过剪切注射级分子量为800~1 200 kDa的透明质酸原料生产2% B-HA溶液。采用琼脂糖凝胶电泳法结合高效凝胶渗透色谱GPC-MALLS法测定的B-HA平均分子量是(35±8) kDa,其分子量分布在10~70 kDa之间的占92.75%±2.42%,分子量分布在10~100 kDa之间的占96.92%±2.34%。
1.3 B-HA注射液的生产
将1.2节中2% B-HA原料经0.22 μm过滤除菌,然后在无菌环境下灌装到注射液瓶中,经测定每瓶含透明质酸100 mg,透明质酸液体5 mL,其浓度为20 mg/mL。
1.4 B-HA对LPS致犬炎症反应的作用研究
1.4.1 分组及LPS致炎模型的建立
30只比格犬饲养一周后,随机分为两组:LPS+生理盐水(Saline)组和LPS+B-HA组。第一天,LPS+Saline组犬按照体质量经前肢静脉注入Saline,注射剂量为0.4 mL/kg;LPS+B-HA组犬按照体质量经前肢静脉注入B-HA,注射剂量为0.4 mL/kg。第二天,LPS+Saline组犬按照体质量静脉注入Saline和LPS溶液,注射剂量分别为0.4 mL/kg和100 ng/kg;B-HA组犬按照体质量静脉注入B-HA和LPS溶液,注射剂量分别为0.4 mL/kg和100 ng/kg。
1.4.2 血常规指标检测
试验第二天LPS注射前及注射后3 h采集两组犬的静脉血于抗凝管中,混匀后进行血液指标检测,并统计细胞数下降百分比(LPS注射前后细胞数差值/注射前细胞数×100%),主要包括中性粒细胞(Neutrophils)和淋巴细胞(Lymphocytes)。
1.4.3 外周血TNF-α和IL-17表达水平测定
试验第二天LPS注射前及注射后3 h采集两组犬的静脉血,3 500 r/min离心10 min,收集血清。两组分别选取4个样本,参照Elisa试剂盒说明书进行操作,使用多功能酶标仪测定各组样本的TNF-α和IL-17表达水平。
1.4.4 体征状态指标监测
监测两组犬在试验第二天LPS注射前及注射后3 h的体征状态,主要包括肛温和犬的精神状态(包括疲惫、发抖、疲倦、呕吐、腹泻、食欲)。
1.5 统计学分析
数据以平均值±标准差(Mean±SD)表示,用统计学软件Graph prism 6.0进行数据统计分析。使用成组t检验比较结果,*P<0.05和**P<0.01分别被认为具有显著统计学差异和极显著统计学差异。
2 结果与分析
2.1 B-HA对LPS致犬血中性粒细胞和淋巴细胞的影响
如图1和图2所示,LPS+Saline对照组中性粒细胞和淋巴细胞数目在注射LPS 3 h后明显减少,说明LPS致犬炎症模型建立成功。相较于LPS+Saline组,LPS+B-HA组的中性粒细胞减少数目显著降低(P<0.05,样本数n=15),LPS+B-HA组的淋巴细胞减少数目差异不显著(P>0.05,n=15)。
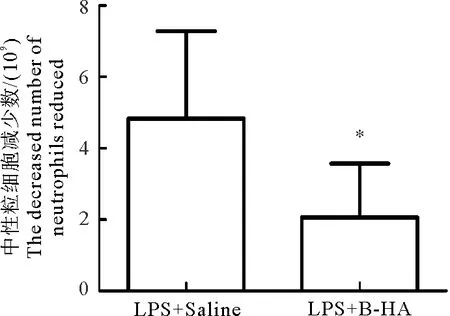
图1 B-HA静脉注射对LPS诱导的犬血中性粒细胞数减少的抑制效果
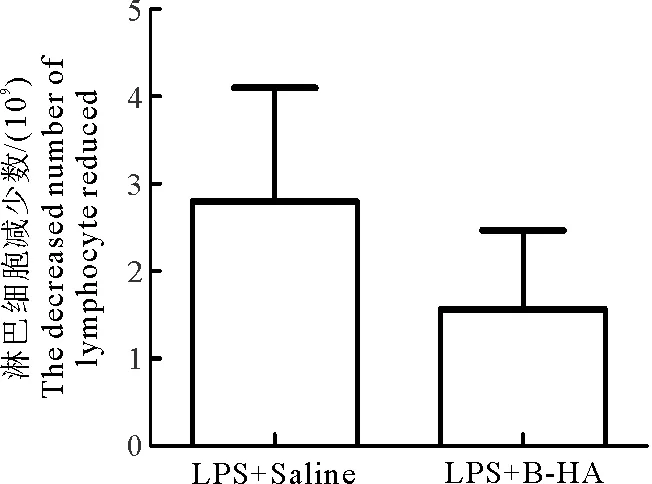
图2 B-HA静脉注射对LPS诱导的犬血淋巴细胞数减少的抑制效果
LPS+B-HA组与LPS+Saline组相比较,LPS+B-HA组中性粒细胞数目下降比例显著降低(P<0.01,n=15),淋巴细胞数下降比例差异不显著(P>0.05,n=15)。综合以上结果表明,静脉注射B-HA抑制了LPS对中性粒细胞的活化作用。
2.2 B-HA对LPS致犬炎症血清TNF-α和IL-17释放水平的影响
如表1所示,LPS+B-HA组和LPS+Saline组比较,LPS+B-HA组的TNF-α和IL-17的释放水平显著降低(P<0.01),表明B-HA对LPS引起的血清炎症因子TNF-α和IL-17升高有抑制作用。

表1 LPS+Saline和LPS+B-HA组血清TNF-α和IL-17释放水平
2.3 B-HA对LPS致犬炎症体征状态的影响
如表2、表3所示,LPS+B-HA组和LPS+Saline组比较,LPS+B-HA组的临床症状(包括颤栗、精神、呕吐、腹泻、食欲)轻微改善,但呕吐样本数增加;两组犬经LPS静脉注射后体温都升高,且LPS注射前后差值无明显差异(P>0.05),表明B-HA对LPS诱导的体温升高没有治疗作用。
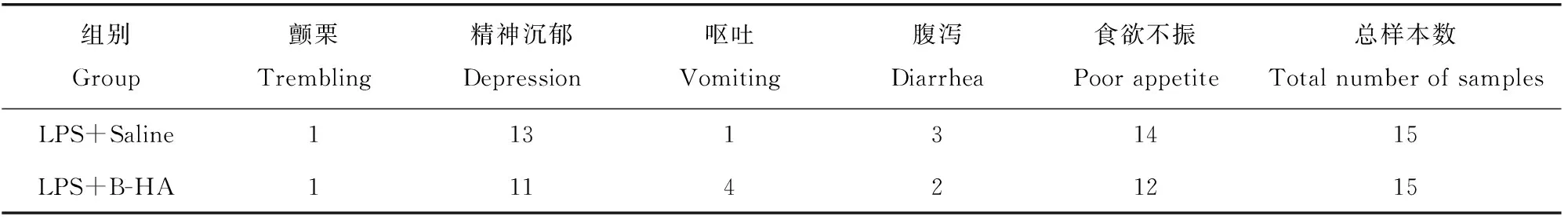
表2 B-HA对LPS引起的临床症状的样本数

表3 B-HA对LPS引起体温升高的影响
3 讨论
中性粒细胞是人体对抗有害微生物入侵的主要武器,但其作用有利有弊。有研究表明外周血中性粒细胞向炎症区域聚集参与了疾病的病理过程,对机体也有损伤作用[38-42]。本研究采用静脉注射LPS制备比格犬炎症模型,探讨了B-HA对LPS致犬炎症反应的治疗作用。结果表明B-HA抑制了LPS诱导的犬血中性粒细胞数和淋巴细胞数下降,支持B-HA通过抑制激活的外周血中性粒细胞和淋巴细胞向炎症区域聚集的研究结论[37-39]。但同时发现B-HA对淋巴细胞数下降的抑制效果差异不明显,这提示B-HA对CD44阳性人淋巴细胞的作用和对CD44阳性人中性粒细胞的作用可能不同。本试验结果为下一步人体研究奠定了基础,即探索B-HA对CD44阳性人中性粒细胞的作用机制。
TNF-α是一类由巨噬细胞和自然杀伤细胞(NK)经活化后分泌的促炎症因子,参与众多炎症性疾病的病理过程。在本研究中B-HA明显抑制了犬炎症中TNF-α的释放。凌华军等[43]通过研究透明质酸对膝关节炎模型中TNF-α水平的影响,发现透明质酸可以明显降低关节腔中的TNF-α水平,与本研究结果一致。但是,该研究还发现透明质酸的疗效随着治疗时间的延长而逐渐降低,本试验为短期试验,未发现这样的趋势,在以后的试验中可对此进一步进行探索。
IL-17与多种自身免疫病的发病机制有关,例如牛皮癣。本研究结果显示B-HA明显抑制了犬血清促炎症因子IL-17的释放。目前关于透明质酸对血清IL-17的研究较少,文礼等[33]通过对透明质酸钠在膀胱炎患者血清IL-17的影响,发现透明质酸钠可以显著抑制患者血清的IL-17的水平,与本文研究结果一致,透明质酸钠是一种更加稳定的透明质酸,是透明质酸的盐形式。
为了研究B-HA对LPS引起的临床症状,本试验分别从颤栗、精神、呕吐、腹泻、食欲和体温指标进行观察,结果表明低剂量的B-HA对LPS致犬炎症有轻微的改善,但是效果不明显。由此可推断相对低剂量的B-HA静脉注射对犬的治疗效果较差,可能是因为B-HA的治疗作用有一定的特异性或敏感性(种属或器官或组织)[44]。
文献研究提示透明质酸酶PH20可以治疗皮肤炎症牛皮癣、胰腺和肺癌,主要是通过切割人体内大分子透明质酸形成小分子透明质酸,从而产生抗炎活性[45-48],这对本研究具有重要的指导意义,我们推断B-HA作为一种小分子透明质酸可能在体内参与了众多炎症反应。本研究首次使用犬研究了B-HA的药理学作用,表明B-HA抑制了LPS诱导的犬血中性粒细胞吸附血管壁而引起的血中性粒细胞数下降。本研究结果提示静脉注射B-HA抑制了LPS诱导的外周血中性粒细胞激活并透过血管壁向炎症区域移走和聚集。本研究结果为B-HA注射液的人体临床、作用机制和安全性研究奠定基础。

