一种用于PCR的丝状真菌DNA快速粗提方法
李明晨,李跃,李敬涛,梁文星,刘思慧
(1.青岛农业大学植物医学学院/山东省植物病虫害综合防控重点实验室,山东青岛 266109;2.青岛农业大学理学与信息技术学院)
随着分子生物学的发展,对于病原菌的研究上升到分子水平。在对丝状真菌进行分子生物学鉴定时,离不开分离基因组DNA,但研究目的不同,对DNA的质量要求也不同。目前提取DNA的方法主要有CTAB(十六烷基三甲基溴化铵)法、微波法、SDS(十二烷基硫酸钠)法、尿素法、乙酸铵法等[1-4],其中CTAB提取法可以稳定高质量的提取基因组DNA[2-3]。但当需要提取的DNA样品份数较多时,经典的CTAB提取法步骤繁琐,时间长,效率较差,而且采用有机试剂反复抽提,具有一定的安全隐患[5]。有些研究对DNA的提取质量要求不高,微量DNA就可通过PCR扩增达到试验目的[6]。Zou等[7]开发了一种试纸条快速提取纯化DNA的方法,但目前还未商业化开发,所用试纸条也需要特殊处理,且在高通量筛选转化子时,是否会存在提取纯化DNA不稳定的情况从而影响检测结果也有待确定。因此在实验室条件下,探索一种快速、便捷、稳定、高效地粗提DNA方法仍然十分有必要。
利用NaOH可以使细胞处于强碱环境下,使细胞裂解暴露DNA,通过高速离心除去蛋白等杂质,取上清液以TE缓冲液中和,提供缓冲环境,防止核酸被破坏。例如,利用碱裂解法可以提取细菌质粒DNA[8],同时,碱裂解法也可以提取植物基因组DNA[2-3,5]。本研究比较了利用NaOH及CTAB提取DNA流程的异同,用两种不同提取方法对丝状真菌尖孢镰刀菌(Fusariumoxysporum)和灰霉菌(Botrytiscinerea)进行基因组提取,测定了提取DNA的浓度,并以此DNA为模板进行PCR扩增,通过观察琼脂糖凝胶电泳条带比较两种方法提取DNA的质量差别,以此确定NaOH提取DNA的稳定性和有效性。同时利用该方法提取了链格孢(Alternariaalternata)及核盘菌(Sclerotiniasclerotiorum)的基因组并进行了PCR检测。利用NaOH碱裂解法快速提取尖孢镰刀菌转化子并进行PCR的分子鉴定,为相关研究提供了一种简单、安全、高效的可用于PCR检测的丝状真菌粗提DNA方法。
1 材料和方法
1.1 真菌培养及样品收集
本研究用尖孢镰刀菌(Fusariumoxysporumf. sp.lycopersici, Fol4287)[9],灰葡萄孢(BotrytiscinereaB05.10)[10],链格孢(Alternariaalternata)及核盘菌(Sclerotiniasclerotiorum)[11]菌株作为研究材料,菌株均由本实验室保存。将-80 ℃保存的植物病原真菌菌丝接种到马铃薯葡萄糖琼脂(PDA)培养基(HB0233-12,海博生物)中,25 ℃黑暗条件下培养 48~72 h,然后将菌落边缘的新鲜菌丝切成3~5 mm的菌饼。取3~5个菌饼,放入2 mL离心管中,置于冷冻干燥机(Christ ALPHA 1-2 LD plus,德国)中抽干,加入1粒直径5 mm 钢珠或磁珠,盖上盖,放入液氮中冷冻,之后用全自动样品快速研磨仪(JXFSTPRP-48,上海净信)快速研磨90~120 s至粉状。
1.2 DNA提取方法
1.2.1 CTAB法提取DNA
(1)在真菌粉末中加入1 mL 2% CTAB提取液( 2% CTAB、100 mmol/LTris-HCl、20 mmol/L EDTA、1.4 mol/L NaCl、2% β-巯基乙醇、pH值8.0) ,加入研磨珠,剧烈振荡,于65 ℃水浴加热40 min,每隔20 min左右摇动1次,充分混合样品与提取液。
(2)将样品于室温下12 000 r/min离心7 min,吸上清液(约0.7 mL),在通风橱中加入等体积的氯仿,反复颠倒,充分混匀后室温下12 000 r/min离心10 min。
(3)吸上清液(约0.5 mL)于新的离心管中,加入等体积的异丙醇轻摇混匀,置-20 ℃冰箱 20~30 min。
(4)室温下12 000 r/min离心10 min,弃上清液,留沉淀。
(5)用75%乙醇洗沉淀2次,自然风干DNA。
(6)DNA干燥后,加入40 μL ddH2O 溶解DNA,然后保存于-20 ℃冰箱备用。
1.2.2 NaOH碱裂解法提取DNA
在粉末中加入500 μL不同浓度(0.25、0.50、0.75 和1.00 mol/L)的NaOH溶液颠倒混匀,室温下12 000 r/min离心10 min。取10 μL上清液转移到新的离心管中,加入90 μL的100 mmol/L TE buffer(100 mmol/L Tris-HCl、1 mmol/L EDTA)中和,保存于-20 ℃冰箱备用。
1.3 DNA浓度测定
将提取的丝状真菌DNA样品做适当稀释后利用BioPhotometer D30核酸蛋白测定仪(Eppendorf,德国)测定提取DNA的含量。
1.4 PCR 扩增以及电泳检测
本研究选取尖孢镰刀菌的FOXG_11456基因(F:5′-ATGAAGGTCTCTTCTTCCGT-3′;R:5′-ACCGGAGTAGTCAATGTCGA-3′),灰葡萄孢BFR2基因(F: 5′-CTTCGGATGTCAATGGCA-3′;R: 5′-AGTTTGCGGGAGATAGGGA-3′),链格孢OPA10-2(MT518874)基因(F:5′-CTCTCACATTAGTGCAGCTC-3′;R:5′-GCGGACCGTGGGCGAACGTT-3′)及RPB2(MT518873)基因(F: 5′-TGAACCGATACACTTACGCC-3′;R: 5′-ATGATAC-TGGCACAGATACC-3′),核盘菌Pyc1(XM_001586211)基因(F:5′-GCAAGGATTCTCACCAGA-TAC-3′;R:5′-CCCAACATTCCAAACTGAAC-3′)进行扩增。试验采用20 μL反应体系,基因组DNA取2 μL作为模板,利用1.1×T3 Super PCR Mix(TSE030)聚合酶(擎科生物)按照产品推荐的标准程序进行扩增。反应结束后,使用1%琼脂糖凝胶对反应体系进行电泳,对紫外投射显示电泳结果进行分析。
1.5 利用NaOH碱裂解法对尖孢镰刀菌的转化子进行PCR鉴定
首先实验室构建了11456-GFP过表达载体,采用原生质体转化的方式对野生型尖孢镰刀菌进行转化,并在筛选标记培养基上进行筛选。对获得的转化子利用NaOH方法粗提DNA,然后利用FOXG_11456-OE基因进行扩增,检测过表达基因整合情况,验证转化子。同时利用FOXG_11456基因检测尖孢镰刀菌内源基因存在情况,以此作为对照,进行PCR及电泳分析。
1.6 数据处理及分析
利用SPSS 16.0软件对数据进行统计及差异显著性分析,使用GraphPad Prism6绘制柱形图。
2 结果与分析
2.1 不同NaOH浓度提取丝状真菌DNA的浓度检测
对使用不同NaOH浓度提取的尖孢镰刀菌(Fol)DNA进行浓度检测(图1),结果显示尖孢镰刀菌用0.25、 0.50、0.75、1.00 mol/L NaOH提取的DNA浓度分别为60 μg/mL、100 μg/mL、45 μg/mL、32 μg/mL。这说明,所用不同浓度NaOH均可以提取尖孢镰刀菌基因组,但0.5 mol/L的NaOH提取DNA浓度较其他浓度提取的升高显著,因此推荐0.5 mol/L的NaOH进行丝状真菌基因组提取。
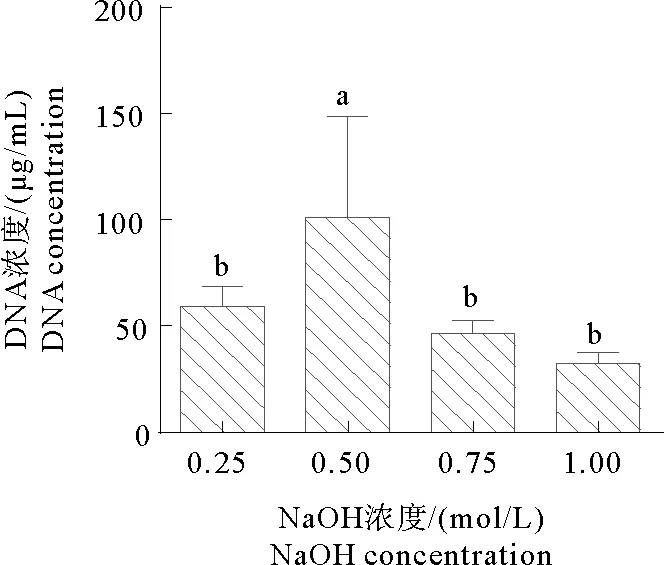
图1 不同NaOH浓度提取尖孢镰刀菌基因组的DNA浓度检测
2.2 NaOH及CTAB提取DNA的方法比较
NaOH及CTAB提取DNA的方法比较见表1。整个提取过程中,都需要用到组织研磨器进行组织破碎。然而,采用CTAB提取DNA还需要用水浴锅进行细胞裂解,利用NaOH提取DNA则无须使用水浴锅孵育。此外,两种方法所用试剂差别也较大,利用CTAB提取真菌DNA需要用到CTAB、氯仿、异丙醇及乙醇,而利用NaOH提取DNA仅仅需要NaOH,无须使用氯仿等有机试剂抽提,毒性低,对人身更加安全。此外,在样品数量基本一致的前提下,获得液氮研磨的粉状组织后,利用NaOH提取DNA用时较短,约0.5 h,而利用CTAB提取DNA用时较长,累计约2.5 h。所以,采用NaOH法提取DNA更加节约时间。

表1 利用NaOH及CTAB提取DNA的方法比较
2.3 利用NaOH和CTAB提取DNA的浓度比较
利用NaOH及CTAB两种方法提取DNA并进行浓度检测(图2),结果显示尖孢镰刀菌(Fol)用NaOH提取的量约108 μg/mL,用CTAB提取的量约为303 μg/mL;灰葡萄孢(Bc)用NaOH提取的量约159 μg/mL,用CTAB提取的量约为289 μg/mL。结果说明,虽然CTAB提取的真菌菌丝DNA的量比利用NaOH提取的要多2~3倍,但NaOH提取的DNA量理论上满足常规PCR需求,且方法简单,因此,提取尖孢镰刀菌和灰葡萄孢基因组可以用NaOH提取。
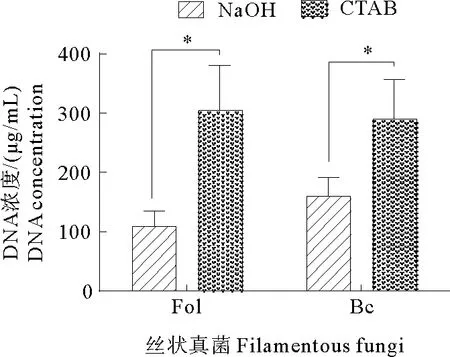
图2 两种不同方法提取尖孢镰刀菌(Fol)及灰葡萄孢(Bc)基因组DNA的核酸定量检测
2.4 NaOH和CTAB提取不同丝状真菌DNA的PCR检测
为了进一步确定NaOH提取的DNA是否满足PCR分子检测的质量需求,利用尖孢镰刀菌的FOXG_11456基因及灰葡萄孢的BFR2基因进行PCR检测NaOH提取DNA质量,利用CTAB提取的基因组作为对照。结果表明,NaOH提取基因组进行PCR检测的目标基因条带清晰特异,与CTAB法提取基因组PCR结果基本一致(图3),因此可以利用NaOH提取尖孢镰刀菌及灰葡萄孢基因组,并进行常规PCR检测。
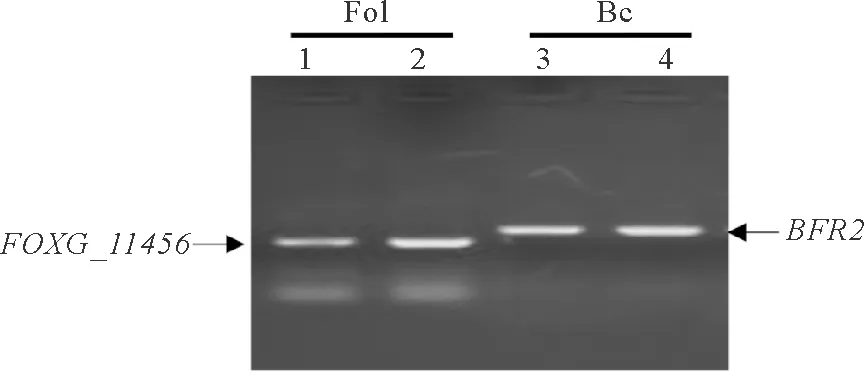
图3 不同方法提取基因组的PCR检测
为了确定上述步骤中NaOH也可以对其他丝状真菌基因组进行提取并用于PCR检测,利用链格孢(A.alternata)的OPA10-2及RPB-2基因检测NaOH提取的基因组质量(图4A)。结果表明利用NaOH提取基因组进行PCR检测时,目标基因条带清晰特异,因此可以利用NaOH提取链格孢菌基因组,并用于PCR检测。
此外,试验也对丝状真菌核盘菌(S.sclerotiorum)进行基因组提取并用于PCR检测,并利用核盘菌的Pyc1基因检测NaOH提取的基因组(图4B)。结果表明目标基因条带清晰特异,因此NaOH也适用于提取核盘菌基因组,并用于PCR检测。

A:链格孢基因组PCR检测,其中1-3为不同菌株基因组扩增产物;B:核盘菌基因组PCR检测,其中1-6为不同菌株基因组扩增产物;M:Marker DL2000。A: PCR detection of A. alternata genome and 1-3 lanes are the amplification products of genomic from different strains; B: PCR detection of S. sclerotiorum genome and 1-6 lanes are the amplification products of genomic from different strains;M: Marker DL2000.图4 利用NaOH提取链格孢和核盘菌基因组DNA的PCR检测Fig. 4 PCR detection of A.alternata and S.sclerotiorum genome DNA extracted by NaOH
2.5 利用NaOH对Fol转化子进行PCR鉴定
为了进一步确定上述步骤中NaOH提取及PCR检测可用于真菌转化子的鉴定,试验利用尖孢镰刀菌内源基因FOXG_11456检测NaOH法提取的转化子基因组,以证明转化子基因组提取良好,满足PCR检测。然后利用可以过表达的FOXG_11456-OE外源基因(上游含强启动子)进行FOXG_11456-OE过表达转化子的鉴定。PCR检测结果表明(图5),FOXG_11456基因在野生型及转化子中出现清晰特异的条带,说明基因组提取质量满足PCR要求,通过FOXG_11456-OE检测后只有转化子出现了和对照载体(vector)相同的基因扩增条带,而野生型中检测不到转入的外源基因,说明尖孢镰刀菌转化子可以利用NaOH法提取DNA并进行PCR快速检测。
3 讨论
提取真菌基因组DNA,是对丝状真菌进行分子生物学研究的重要环节。有关真菌DNA的提取方法很多,常采用CTAB及SDS等化学方法先破除细胞壁,再通过与有机溶剂抽提相结合的方式来进行核酸提取[3,12-13]。这些方法所提取的DNA质量高,稳定性好,但步骤繁琐,耗时长,在样本所需量较大时,耗费大量时间,效率低。而在后续许多研究中,部分试验对DNA的质量要求并非极其严格,可通过PCR对基因扩增达到研究目的。因此本研究提出了一种用NaOH和TE缓冲液快速粗提丝状真菌DNA的方法,并将其与传统CTAB提取法做对比。(1)在耗时方面:利用CTAB提取DNA多次离心静置,反复用有机溶剂抽提,其中还包括短时间的低温储藏,完成提取需2~3 h,耗费时间长。利用NaOH提取DNA,操作简单,省去有机溶剂反复抽提和低温下冷藏静置步骤,更无须在通风橱内操作,节省了大量时间。除去抽真空干燥处理,完成提取只需0.5 h,耗时较短。(2)在试剂方面:CTAB法所使用药品复杂多样,所需的氯仿、异丙醇等药物均具有一定毒性,易对环境造成污染,对实验室有一定要求。而本试验提出的方法使用药品单一,所用NaOH和TE缓冲液属于实验室常备药品,成本低,安全系数高。(3)在操作方面:CTAB法步骤繁琐,在提取过程中易出现操作失误而导致DNA提取质量差;NaOH法步骤单一,减少了过程出错的风险。(4)通过电泳条带的亮度比较,经过PCR扩增,NaOH所提DNA质量可满足常规PCR检测。
此外,本研究利用该方法对尖孢镰刀菌转化子进行筛选鉴定,进一步确定了NaOH在提取DNA过程中的稳定性,实验室目前也利用该方法成功鉴定了丝状真菌上百个转化子,获得多个突变体,并进行了后续进一步验证[11]。同时,为了进一步分析该方法对其他丝状真菌DNA提取的普适性,试验还提取了核盘菌及链格孢的菌丝DNA,并进行了PCR鉴定。这些结果表明该方法也能够对其他丝状真菌实现稳定的DNA提取,并应用于基因克隆及PCR检测。近年来,实验室一直使用该方法提取DNA并进行基因克隆,目的基因从200~3 000 bp均能实现稳定克隆,说明该方法提取的DNA质量完整性较好。然而,本方法使用的NaOH毕竟是一种强碱,对DNA会造成一定损害,因此,NaOH在使用过程中时间不宜过长,且尽量不要剧烈混合,尽可能保证加入NaOH后10分钟内完成离心,并最终以TE 缓冲液(100 mmol/L Tris-HCl,1 mmol/L EDTA)进行中和[14],避免长时间的碱性条件使基因组DNA片段慢慢断裂,严重破坏DNA完整性,导致无法进行有效基因克隆。同时,缓冲液中EDTA的加入,可以螯合Ca2+和Mg2+等二价金属离子,抑制部分DNase的活性,并抑制微生物生长,以便延长提取DNA的保存期限。
综上所述,用NaOH提取丝状真菌DNA是一种安全、廉价、简单、快速、高效的DNA提取方法,可用于常规基因克隆及转化子筛选鉴定,利用该方法可节约试验成本,对国内外同行具有重要的借鉴意义,在市场上也具有广泛的应用前景和利用价值。

