育龄期不同年龄段肥胖型PCOS的糖脂代谢分析
马英英 夏舟岚 陈惠娟 陆月红 马雪莲

[摘要] 目的 探討育龄期不同年龄段的肥胖型多囊卵巢综合征(PCOS)与非肥胖型PCOS两组患者糖脂代谢的特点。 方法 选择2016年1月至2019年12月来绍兴市妇幼保健院就诊的201例育龄期PCOS患者作为研究对象;根据体质量指数将研究对象分为两组:BMI≥25 kg/m2者归为肥胖组(A组),BMI<25 kg/m2者为非肥胖组(B组)。再根据患者的年龄将肥胖组和非肥胖组各分为两个亚组:20~<30岁亚组和30~<40岁亚组。对各亚组间的年龄、WHR、OGTT的血糖、胰岛素、HOMA及血脂进行分析。用SPSS 19.0统计学软件进行数据分析。 结果 肥胖组和非肥胖组中,20~<30岁亚组(A1或B1组)与30~<40岁亚组(A2组或B2组)随着年龄增加其TC、空腹胰岛素水平、OGTT后0.5 h血糖和胰岛素水平及HOMA-IR均显著增加(P<0.05)。肥胖组随着年龄增,其空腹血糖、OGTT后1 h血糖和胰岛素水平、OGTT后2 h血糖和胰岛素水平、OGTT后3 h血糖和胰岛素水平显著增加(P<0.05);非肥胖组随着年龄增长,其WHR均显著增加(P<0.05),HDL则显著下降(P<0.05)。同年龄段肥胖组和非肥胖组相比,20~<30岁组肥胖组(A1组)与非肥胖组(B1组)及30~<40岁肥胖组(A2组)与非肥胖组(B2组),随着BMI的增加,肥胖组均比同年龄的非肥胖组的BMI、WHR、LDL、空腹胰岛素水平、OGTT后1 h血糖和胰岛素水平、OGTT后2 h血糖和胰岛素水平、OGTT后3 h血糖和胰岛素水平及HOMA-IR显著增加(P<0.05)。随着年龄及BMI的增加,亚组间血脂异常率均显著升高(P<0.05),而胰岛素抵抗率、血糖调节受损(IGR)和糖尿病率也有所提高,但差异各组均不同。 结论 随着年龄的增长和BMI的增加,PCOS患者有更为严重的糖脂代谢紊乱,应早期进行血糖和血脂检查,以便及时干预并期望通过运动、饮食控制降低BMI,从而预防和延缓PCOS的远期并发症。
[关键词] 育龄期;不同年龄段;多囊卵巢综合征;糖脂代谢;肥胖型
[中图分类号] R711.7 [文献标识码] A [文章编号] 1673-9701(2022)09-0007-06
[Abstract] Objective To explore the characteristics of glucose and lipid metabolism in obese polycystic ovary syndrome (PCOS) and non-obese PCOS at different ages of childbearing age. Methods A total of 201 PCOS patients of childbearing age, treated in the Shaoxing Maternity and Child Health Hospital from January 2016 to December 2019 were selected. They were divided into two groups according to the body mass index. Those with BMI≥25 kg/m2 were classified as the obese group (group A), and those with BMI<25 kg/m2 were classified as the non-obese group (group B). According to the age of patients, the obese group and the non-obese group were further divided into two subgroups as the 20-<30-year-old subgroup and the 30-<40-year-old subgroup. The age, WHR, OGTT blood glucose, insulin, HOMA, and blood lipids were analyzed in each subgroup. Statistical analysis was performed using SPSS19.0 statistical software. Results In the obese group and the non-obese group, the levels of TC, fasting insulin, blood glucose and insulin at 0.5 hours after OGTT,and HOMA-IR increased significantly with age in the 20-<30-year-old subgroup (A1 or B1 group) and the 30-<40-year-old subgroup (A2 or B2 group) (P<0.05). In the obese group, the levels of fasting blood glucose, blood glucose and insulin at 1 hour after OGTT, blood glucose and insulin at 2 hours after OGTT,and blood glucose and insulin at 3 hours after OGTT increased significantly with age (P<0.05).In the non-obese group,the level of WHR increased significantly with age (P<0.05),while the level of HDL decreased significantly with age (P<0.05). Compared the obese group with the non-obese group of the same age, the obesity group (A1 group) with the non-obese group (B1 group) of 20-<30-year-old and the obese group (A2 group) with the non-obese group (B2 Group) of 30-<40-year-old, the levels of BMI,WHR, LDL, fasting insulin, blood glucose and insulin at 1 hour after OGTT, blood glucose and insulin at 2 hours after OGTT, blood glucose and insulin at 2 hours after OGT, and HOMA-IR were increased significantly with BMI,and the increases in the obese group were more significant than those in the non-obese group of the same age(P<0.05).With the increases of age and BMI, the incidence of dyslipidemia among the subgroups were increased significantly (P<0.05). The incidences of insulin resistance, impaired glucose regulation (IGR) and diabetes were also increased, but the differences were different in each group. Conclusion With the increase of age and BMI, PCOS patients have more serious glucose and lipid metabolism disorders. Early blood glucose and blood lipid tests should be performed to intervene in time and reduce BMI through exercise and diet control to prevent and delay the long-term PCOS complications.455B36CD-4520-458B-A52A-A8DF97DC5278
[Key words] Childbearing age; Different ages; Polycystic ovary syndrome; Glucose and lipid metabolism; Obesity
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种生殖内分泌紊乱的妇产科常见疾病,随着年龄的增长将合并多种全身代谢性疾病,比如糖尿病、高血压、高血脂等,特别是肥胖型PCOS患者。PCOS患者若不能很好地进行健康管理,其合并代谢性疾病和心血管疾病会较同龄人早10年甚至20年,因此对PCOS患者尤其是肥胖型PCOS患者进行早期识别、积极干预、终身管理具有重大意义。
本研究选择201例育龄期PCOS患者,根据其体质量指数(body mass index,BMI)分为两组:BMI≥25 kg/m2者为肥胖组(A组),BMI<25 kg/m2者为非肥胖组(B组)。再根据患者的年龄将肥胖组和非肥胖组各分为两个亚组:20~<30岁亚组和30~<40岁亚组。对各亚组患者的年龄、腰臀比(waist-to-hip ratio,WHR)、葡萄糖耐量试验(oral glucose tolerance test,OGTT)的血糖、胰岛素和胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)及血脂进行分析,为临床诊治不同年龄段的育龄期PCOS患者提供参考,尤其是肥胖型PCOS患者,现报道如下。
1 资料与方法
1.1 一般资料
选择2016年1月至2019年12月来绍兴市妇幼保健院生殖中心就诊的育龄期PCOS患者201例作为研究对象,年龄20~<40岁。PCOS诊断标准采用2003年国际鹿特丹(Rotterdam)标准[1]。根据2000年世界卫生组织(world health organization,WHO)国际肥胖特别工作组提出的亚太地区的肥胖标准,依据患者BMI将 BMI≥25 kg/m2者归为肥胖组(A组)99例,将 BMI<25 kg/m2者归为非肥胖组(B组)102例。再根据患者的年龄将肥胖组和非肥胖组各分为两个亚组:20~<30岁亚组和30~<40岁亚组,其中20~<30岁肥胖组(A1组),20~<30岁非肥胖组(B1组),30~<40岁肥胖组(A2组),30~<40岁非肥胖组(B2组)。本研究经医院医学伦理委员会批准(批准号:2018024),所有患者均经知情同意,同时签署知情同意书。
1.2 方法
1.2.1 一般情况 研究对象的年龄、身高、体重、腰围、臀围均由专人测定,并计算出BMI和WHR。测量身高、体重时均脱去外衣;腰围:髂前上棘和两腋中线第12肋下缘连线的中点水平的周径;臀围:臀部最大水平所得的周径;BMI:体重(kg)/身高2(m2)。
1.2.2 研究对象采样时间 均为月经周期第2~4天,清晨静坐半小时后抽取空腹8~12 h肘静脉血5 ml,离心收集血清以检测。
1.2.3 血糖、胰岛素和血脂测定 血糖检测方法:已糖激酶法,采用Beckmancoulteraccess(贝克曼库尔特)全自动生化分析仪测定,试剂盒购自贝克曼库尔特实验系统(苏州)有限公司;胰岛素检测采用化学发光法,采用深圳新产业生物医学工程股份有限公司提供的Maglumi 2000发光仪测定,试剂盒则由深圳新产业生物医学工程股份有限公司提供。用胰岛素抵抗指数(HOMA-IR)评价胰岛素抵抗程度,公式为HOMA-IR=FPG×FIns/22.5;血脂采用Beckmancoulteraccess(贝克曼库尔特)全自动生化分析仪测定,试剂盒均由迈克生物科技股份有限公司提供。其中血清总胆固醇(total cholesterol,TC)检测方法:CHOD-PAP法,三酰甘油(triglycerides,TG)检测方法:GPO-PAP法,高密度脂蛋白(high density lipoprotein,HDL)检测方法:直接法-过氧化氢酶清除法,低密度脂蛋白(low-density lipoprotein,LDL)检测方法:直接法-过氧化氢酶清除法,上述检测均严格按要求操作并符合质控要求。
1.3 评价标准
①糖代谢紊乱的参考 WHO1999年诊断标准: 空腹血糖≥7 mmol/L或OGTT 2 h血糖≥11.1 mmol/L为糖尿病;血糖调节受损(impaired blood sugar regulation,IGR)包括糖耐量减低(impaired glucose tolerance,IGT)和空腹血糖调节受损(impaired fasting glycaemia,IFG),OGTT 2 h血糖≥7.8 mmol/L,<11.1 mmol/L为糖耐量减低(IGT),空腹血糖受损(IFG):空腹血糖≥6.1 mmol/L,<7 mmol/L;以HOMA-IR≥2.69判定为胰岛素抵抗(insulin resistance,IR)[2]。②血脂異常指标参照我国2016年修订的中国成人血脂异常防治指南推荐,TC≥6.2 mmol/L和(或)TG≥2.3 mmol/L和(或)LDL≥4.1 mmol/L和(或)HDL<1.0 mmol/L为血脂异常[3]。
1.4 统计学方法
对所有数据使用SPSS 19.0统计学软件进行分析处理。计量资料先进行正态性检验,符合正态分布的计量资料用(x±s)表示,各组间的年龄、BMI、WHR、血脂4项(TC、TG、LDL、HDL)、血糖和胰岛素水平、HOMA等计量数据结果则均采用多组间比较方法单因素方差分析,各亚组间的两两比较用Scheffe法,P<0.05为差异有统计学意义。肥胖组和非肥胖组的血糖调节受损(IGR)率、糖尿病率、胰岛素抵抗率和血脂异常率的比较则采用χ2检验或Fisher精确概率法(在样本含量<40或有格子的期望频数<1的列联表,采用Fisher精确概率法),检验水准取α=0.05。P<0.05为差异有统计学意义。455B36CD-4520-458B-A52A-A8DF97DC5278
2 结果
2.1 肥胖组(A组)与非肥胖组(B组)的不同年龄亚组基础特征及糖脂代谢指标比较
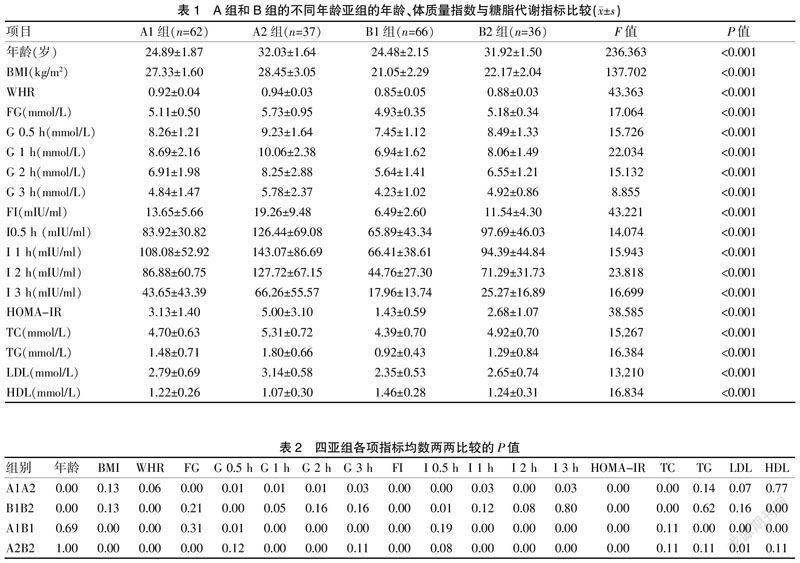
2.1.1 四个亚组患者的一般资料及多组间方差分析 四个亚组患者的BMI、WHR、血糖、胰岛素、TC、TG、LDL、HDL及HOMA-IR数值比较,差异有统计学意义(P<0.01)。见表1。
2.1.2 各亚组间指标的两两比较用Scheffe法 肥胖组中,20~<30岁亚组(A1组)与30~<40岁亚组(A2组)的平均年龄分别为(24.89±1.87)岁、(32.03±1.64)岁,且随着年龄增长,空腹血糖和胰岛素水平、OGTT后0.5 h血糖和胰岛素水平、OGTT后1 h血糖和胰岛素水平、OGTT后2 h血糖和胰岛素水平、OGTT后3 h血糖和胰岛素水平以及HOMA-IR、TC均显著增加(P<0.05),而BMI、WHR、TG、 LDL值随着年龄的增长有所上升,但差异无统计学意义(P>0.05)、HDL则随着年龄的增长有所下降,差异无统计学意义(P>0.05)。见表1~2。
非肥胖组中,20~<30岁亚组(B1组)与30~<40岁亚组(B2组)的平均年龄分别为(24.48±2.15)岁、(31.92±1.50)岁,且隨着年龄增长,WHR、TC、空腹胰岛素水平、OGTT后0.5 h血糖和胰岛素水平以及HOMA-IR均显著增加(P<0.05),HDL则显著下降(P<0.05),BMI、TG、 LDL、空腹血糖、OGTT后1 h血糖和胰岛素水平、OGTT后2 h血糖和胰岛素水平、OGTT后3 h血糖和胰岛素水平随着年龄的增长有所上升,但差异无统计学意义(P>0.05)。见表1~2。
同年龄段肥胖组和非肥胖组相比,即20~<30岁肥胖组(A1组)与20~<30岁非肥胖组(B1组)的平均年龄分别为(24.89±1.87)岁、(24.48±2.15)岁,两组年龄差异无统计学意义(P>0.05);20~<30岁肥胖组(A1组的)BMI、WHR、TG、 LDL、空腹胰岛素水平、OGTT后0.5 h血糖、OGTT后1 h血糖和胰岛素水平、OGTT后2 h血糖和胰岛素水平、OGTT后3 h血糖和胰岛素水平及HOMA-IR均显著高于20~<30岁非肥胖组(B1组),HDL则显著下降(P<0.05),而空腹血糖、OGTT后0.5 h胰岛素水平和TC值,肥胖组A1组比非肥胖组B1组有所上升,但差异无统计学意义(P>0.05)。见表1~2。
而30~<40岁肥胖组(A2组)与30~<40岁非肥胖组(B2组)的平均年龄分别为(32.03±1.64)岁和(31.92±1.50)岁,年龄差异无统计学意义(P>0.05);30~<40岁肥胖组(A2组)的BMI、WHR、 LDL、空腹血糖和胰岛素水平、OGTT后1 h血糖和胰岛素水平、OGTT后2 h血糖和胰岛素水平、OGTT后3 h血糖和胰岛素水平及HOMA-IR均显著高于30~<40岁非肥胖组(B2组)(P<0.05),A2组与B2组相比,同年龄组的肥胖型的OGTT后0.5 h血糖和胰岛素水平、TC、TG则有所增加,但差异无统计学意义(P>0.05),HDL则有所下降,但差异无统计学意义(P>0.05)。见表1~2。
2.2 肥胖组与非肥胖组的不同年龄亚组的胰岛素抵抗率、糖调节受损(IGR)率、糖尿病率和血脂异常率比较
肥胖组中,随着年龄的增长,20~<30岁亚组(A1组)与30~<40岁亚组(A2组)相比,血脂异常率随着年龄增加有所升高,分别为32.26% vs. 64.86%(P<0.05)。见表2。胰岛素抵抗率、糖调节受损(IGR)率和糖尿病率也均有所增加,分别为58.84% vs. 72.97%,19.35% vs. 32.43%,6.45% vs. 13.51%,但差异均无统计学意义(P均>0.05)。见表3。
非肥胖组中,随着年龄的增长,20~<30岁亚组(B1组)与30~<40岁亚组(B2组)相比,胰岛素抵抗率、糖调节受损(IGR)率和血脂异常率均随着年龄增加而升高,分别为1.52% vs. 44.44%,7.58% vs 25%,7.58% vs. 30.56%( P<0.05),而非肥胖组两个年龄段未发现糖尿病患者。见表3。
按同年龄段肥胖组和非肥胖组相比,20~<30岁肥胖组(A1组)与20~<30岁非肥胖组(B1组)随着BMI的增加,胰岛素抵抗率和血脂异常率均随之升高,分别为1.52%(B1组) vs. 54.84%(A1组),7.58%(B1组) vs 32.26%(A1组)(P<0.05),而糖调节受损(IGR)率和糖尿病率也有所增加,分别为7.58%(B1组)vs.19.35%(A1组),0%(B1组)vs.6.45%(A1组),但差异无统计学意义(P均>0.05)。见表3。
按同年龄段肥胖组和非肥胖组相比,30~<40岁肥胖组(A2组)与30~<40岁非肥胖组(B2组)随着BMI的增加,胰岛素抵抗率、糖尿病率和血脂异常率均随之升高,分别为44.44%(B2组) vs. 72.97%(A2组),0(B2组) vs. 13.51%(A2组),30.56%(B2组)vs. 64.86%(A2组)(P<0.05),而糖调节受损(IGR)率也有所增加,为25%(B2组) vs. 32.43%(A2组),但差异无统计学意义(P>0.05)。见表3。
3 讨论
多囊卵巢综合征(PCOS)是女性中一种较为常见的内分泌代谢性疾病,在PCOS患者中,肥胖、胰岛素抵抗甚至糖尿病及高脂血症等较为常见,是影响患者近期和远期健康的重要因素。
胰岛素抵抗是糖尿病及糖尿病的心血管并发症发生的重要机制之一[4]。胰岛素抵抗参与PCOS的发生和发展,肥胖与胰岛素抵抗密切相关[5]。在肥胖PCOS患者中,其胰岛素抵抗发生率达到70%~80%[6]。本研究发现无论是肥胖型PCOS患者还是非肥胖型PCOS患者,随着年龄的增加OGTT的5次血糖和胰岛素水平及HOMA-IR均有所增加,且同年龄段肥胖组和非肥胖组相比,随着BMI的增加,结果亦然。王亚平等[7]研究了4个年龄段组的PCOS患者,发现其胰岛素水平无显著性差异,与本研究结果有所不同,但血糖水平随着年龄的增长而增高的结论与本研究一致。对于肥胖PCOS患者的血糖和胰岛素水平的均值高于体重正常患者,这一观点与笔者观点一致,但作者未就胰岛素异常率,IGR率和糖尿病率进行分析统计。吴香春[8]的研究发现PCOS患者中存在胰岛素抵抗和高胰岛素血症的患者达40%~60%。曾利文等[9]的研究发现PCOS患者胰岛素抵抗(IR)发生率为58.40%,与之类似。本研究发现不同年龄不同BMI组间胰岛素抵抗率分别为1.52%~72.97%,其发病率随着年龄和BMI的增加均有所增加,除外肥胖型PCOS的两个年龄段差异无统计学意义(P>0.05),其余组间差异有统计学意义(P<0.05)。PCOS患者胰岛素异常发生率较高,肥胖型PCOS患者更严重。随着年龄增长,胰岛素异常的发生率逐渐升高。455B36CD-4520-458B-A52A-A8DF97DC5278
糖调节受损(IGR)是介于血糖调节正常与糖尿病的中间代谢状态,包括空腹血糖受损(IFG)和糖耐量受损(IGT)[10]。约9%血糖调节受损患者将会在34个月内进展成为糖尿病[11]。一项涵盖35项研究的荟萃分析认为,PCOS患者中糖耐量异常、糖尿病(DM)发生率明显比对照人群高[12]。本研究发现随着年龄及BMI的增加,血糖调节受损率和糖尿病率均有增加,其IGR率在7.58%~32.43%之间不等,其糖尿病率在0~13.51%之间不等,但仅非肥胖患者不同年龄组间IGR率以及30~<40岁组肥胖型和非肥胖型组间糖尿病率差异有显著性。乔杰等[13]的流行病学调查显示,PCOS 患者中IGT发生率约为35%,T2DM发生率约10%。曾利文等[9]的研究糖代谢异常发生率为38.93%,其中IFG发生率为5.13%,IGT发生率为23.64%,即IGR率为28.77%,2型糖尿病(T2DM)发生率为4.92%等[9],但作者未就不同年龄进行分组统计。
脂肪组织具有十分重要的内分泌功能,可分泌细胞因子,并通过不同的机制导致机体胰岛素抵抗和高脂血症,进而导致糖脂代谢紊乱[14-15]。邱惠麒等[16]认为肥胖型PCOS患者还存在一定程度的脂代谢异常,大约60%~70%的PCOS患者至少有一项血脂指标异常。肥胖型PCOS更易发生脂代谢紊乱。因此,是否肥胖对预防代谢相关合并症的发生十分重要,故BMI作为衡量肥胖的临床意义重大[17]。肥胖患者的血脂异常共同特点是TG、TC、LDL增高,HDL降低[18]。肥胖型PCOS患者血浆总TC和TG水平与非肥胖型PCOS患者及正常人群相比均增高[19]。肥胖人群血脂随BMI的增加表现为TC、TG和LDL均升高,而同时HDL水平则降低[20-21]。本研究发现不同年龄组和不同BMI组血脂异常发生率在7.58%~64.86%波动,随着年龄和BMI的增加各组差异均有统计学意义(P<0.001)。王亚平等[7]研究将患者按年龄分组,随着年龄的增长,TC、TG、LDL增高,而HDL下降,意味着年龄越大的PCOS患者发生心血管疾病的风险越高,与本研究观点一致。
综上所述,随着年龄及BMI的增加,PCOS患者的糖脂代谢紊乱都不同程度加重。这与BMI越来越高和长期病程密切关系。所以对肥胖及病程长的PCOS患者而言,减重治疗就显得十分必要且关键。临床工作中,为预防远期并发症,对PCOS患者尽早认识和对其糖脂代谢异常进行干预尤为重要。
[参考文献]
[1] Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Work Shop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome[J].Fertil Steril,2004,81(1): 19-25.
[2] Gheita TA,El-Fishawy HS,Nasrallah MM,et al.Insulin resis-tance and metabolic syndrome in primary gout:Relation to punched-outerosions[J].International Journal of Rheumatic Diseases,2012,15(6):521-525.
[3] 中國成人血脂异常防治指南修订联合委员会.中国成人血脂异常防治指南(2016年修订版)[J].中华心血管病杂志,2016,44(10):833-853.
[4] Paneni F,Costantino S,Cosentino F.Insulin resistance,diabetes,and cardiovascular risk[J].Curr Atheroscler Rep,2014,16(7):419.
[5] Ezeh U,Pall M,Mathur R,et al. Association of fat to lean mass ratio with metabolic dysfunction in women with polycystic ovary syndrome[J].Hum Reprod,2014,29(7):1508-1517.
[6] 丁风娟,郝翠芳.多囊卵巢综合征患者胰岛素抵抗的研究进展[J].生殖医学杂志,2019,28(3):315-319.
[7] 王亚平,陈蓉,林守清,等.不同年龄段和不同体重指数的PCOS患者特征分析[J].生殖医学杂志,2015,24(3):208-213.
[8] 吴香春.多囊卵巢综合征患者胰岛素抵抗的临床分析[J].中国性科学,2014(6):12-13.
[9] 曾利文,陈静,张 晔,等.多囊卵巢综合征患者的糖代谢特点分析[J].医学信息,2019,32(2):103-106.
[10] Buysschaert M,Bergman M.Definition of predia-betes[J]. Med Clin North Am,2011,95(2):2892-2897.
[11] Eades CE,Leese GP,Evans JM.Incidence of impaired glucose regulation and progression to type 2 diabetes mellitus in the tayside region of scotland[J].Diabetes Res Clin Pract,2014,104(1):e16-e19.455B36CD-4520-458B-A52A-A8DF97DC5278
[12] Flannery CA,Rackow B,Cong X,et al. Polycystic ovary syndrome in adolescence:Impaired glucose tolerance occurs across the spectrum of BMI[J].Pediatr Diabetes,2013,14(1):42-49.
[13] 乔杰,李蓉,李莉,等.多囊卵巢综合征流行病学研究[J].中国实用妇科与产科杂志,2013,29(11):849-852.
[14] Yao L,Herlea-Pana O,Heuser-Baker J,et al.Roles of the chemokine system in development of obesity,insulin resistance,and cardiovascular disease[J].J Immunol Res,2014,181450:1-11.
[15] Hryhorczuk C,Sharma S,Fulton SE. Metabolic disturbances connecting obesityand depression[J].Front Neurosci,2013, 7:1771-1774.
[16] 邱惠麒,曾玖芝,朱玉蓉.肥胖型多囊卵巢綜合征患者糖脂类代谢分析[J].浙江实用医学,2017,12(2):85,93.
[17] 董冰莹,那芷菁,焦娇,等.体质量指数正常的多囊卵巢综合征患者肥胖指标与糖脂代谢的相关性[J].中国医科大学学报,2019,48(6):485-488.
[18] Ollila MM,Piltonen T,Puukka K,et al.Weight gain and dyslipidemia in early adulthood associate with polycystic ovary syndrome:Prospective cohort study[J].J Clin Endocr-inol Metab,2016,101(2):739-747.
[19] 郭淑萍.肥胖与非肥胖多囊卵巢综合征患者内分泌激素比较分析[J].哈尔滨医药,2018,38(6):540-541.
[20] 杨斌芳.健康体检人群超重、肥胖与血浆同型半胱氨酸、血脂水平的相关性分析[J].中国社区医师,2018,34(32):122-123.
[21] 孙金金,孙林,陶晶.低碳水化合物饮食干预在促进肥胖型多囊卵巢综合征患者受孕中的作用[J].中国当代医药,2021,28(35):99-101.
(收稿日期:2021-04-09)455B36CD-4520-458B-A52A-A8DF97DC5278

