不同三维剂量验证系统对鼻咽癌容积旋转调强放疗计划的验证价值比较
何勇,王宇,廖雄飞
(电子科技大学医学院附属肿瘤医院·四川省肿瘤医院放疗中心,四川 成都 610041)
容积旋转调强放疗(volumetric modulated arc therapy,VMAT)作为鼻咽癌放射治疗的主要技术手段,利用单弧或多弧旋转照射,能提供高度适形的靶区剂量分布与低危及器官照射风险,同时具有剂量分布更精确、照射效率更高、治疗时间更短等优势[1-2]。由于VMAT技术在治疗过程中,多叶准直器位置、机架旋转速度等均处于运动状态,因此对放疗实施精度要求更高,计划实施前需进行三维剂量验证[3]。Delta~4、ArcCHECK是临床常用的三维剂量验证系统,可检测出不同类型和大小的多叶准直器位置误差[4];EPID EDose 5.0不仅可用于计划实施前剂量验证,还能实现在线剂量监测,在临床中的应用越来越广泛[5]。本研究拟比较三种不同三维剂量验证系统在鼻咽癌VMAT计划剂量验证中的应用价值,旨在为临床鼻咽癌VMAT计划实施前的剂量验证提供参考。
1 资料与方法
1.1 一般资料
选取2018年3月至2021年3月电子科技大学医学院附属肿瘤医院收治的127例鼻咽癌患者作为研究对象。其中,男性81例,女性46例;年龄40~69岁,平均(53.48±6.85)岁。根据美国癌症协会(American Joint Committee on Cancer,AJCC)分期手册(第八版)对患者进行分期[6],其中T分期:T2期20例、T3期61例、T4 期46例;N分期:N1期36例、N2期39例、N3期52例;临床分期:Ⅱ期23例、Ⅲ期46例、Ⅳa期58例。所有患者均行基于Pinnacle治疗计划系统(treatment planning system,TPS)制定的VMAT计划。
1.2 WMAT计划设计
使用大孔径CT模拟机(Philips公司)对患者进行扫描,层厚3 mm,CT扫描图像传输至Pinnacle系统,结合其它影像资料勾画出靶区以及危及器官。其中,靶区包括:原发肿瘤靶区(gross tumor volume,GTVT)、颈部转移淋巴结靶区(GTVn)、亚临床病灶高危临床靶区(clinical target volume,CTV1)、亚临床病灶低危临床靶区(CTV2),考虑体位固定和摆位误差将各个区域的计划靶区分别定义为PGTVT、PGTVn、PCTV1和PCTV2。
1.3 仪器设备
(1)Delta~4系统(瑞典 ScandiDos公司):中心区域半导体探头间距为0.5 cm,超过中心区域半导体探头间距为1 cm,探测范围20 cm×20 cm。(2)ArcCHECK系统(美国Sun Nuclear公司):探头尺寸0.64 mm2,间距为1 cm。(3)EPID EDose 5.0系统(瑞典ELEKTA公司):EPID为Synergy直线加速器自带,有效探测范围为41 cm×41 cm。
1.4 实验方法
(1)基于Delta~4、ArcCHECK三维剂量验证测量:测量前对Delta~4、ArcCHECK进行校准,将VMAT计划移植到CT扫描模体中,采用卷积方法重建患者体内的三维剂量分布,精度为2 mm;于测量软件中采集计划验证数据,获得验证通过率及计量-体积直方图(dose volume histogram,DVH)参数;(2)基于EPID EDose 5.0三维剂量验证测量:测量前对EPID平板进行本底和增益校准,调整平板源皮距为160 cm;无模体条件下采集患者VMAT放疗计划中的射野剂量图像,应用反卷积和卷积算法重建患者体内的三维剂量分布。
1.5 分析指标
(1)比较三种三维剂量验证系统测量结果的γ通过率,分析标准设置为:3 mm/3%、2 mm/2%、3%/2 mm、2%/3 cmm,最小阈值10%;(2)比较三种三维剂量验证系统与TPS靶区剂量学、危及器官剂量学差异,靶区参考指标为D98%、D2%、Dmean,危及器官参考指标为Dmax、Dmean,与TPS剂量差异的计算公式为Diff(%)=(Dose_三维剂量验证系统-Dose_TPS)/Dose_TPS×100%。
1.6 统计学分析
2 结果
2.1 不同三维剂量验证系统的γ通过率比较
3%/3 mm分析标准下,三种验证系统的γ通过率均>95%,组间比较差异无统计学意义(P>0.05)。3%/2 mm、2%/3 cmm、2%/2 mm分析标准下,三种验证系统的γ通过率较3%/3 mm标准逐渐下降,且2%/3 cmm、2%/2 mm标准下,基于ArcCHECK、EPID EDose 5.0系统的γ通过率高于Delta~4系统(P<0.05),但ArcCHECK、EPID EDose 5.0系统比较差异无统计学意义(P>0.05)。见表1。
表1 不同三维剂量验证系统的γ通过率比较
2.2 基于三种三维剂量验证系统与TPS的靶区剂量学差异比较
基于Delta~4、ArcCHECK、EPID EDose 5.0三维剂量验证系统计算的靶区(PGTVT、PGTVn、PCTV1和PCTV2)剂量学指标D98%、D2%、Dmean与TPS计算的剂量学指标差异值均<3%。三种三维剂量验证系统与TPS的靶区剂量学比较差异均无统计学意义(P>0.05)。见表2。
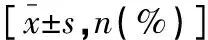
表2 基于三种三维剂量验证系统与TPS的靶区剂量学差异比较
2.3 基于三种三维剂量验证系统与TPS的危及器官剂量学差异比较
基于Delta~4、ArcCHECK、EPID EDose 5.0三维剂量验证系统计算的危及器官剂量学指标Dmax、Dmean与TPS计算的剂量学指标差异值均<3%。三种三维剂量验证系统计算的晶状体、腮腺Dmax与TPS计算的Dmax比较差异具有统计学意义(P<0.05),且ArcCHECK、EPID EDose 5.0小于Delta~4(P<0.05);三种三维剂量验证系统与TPS的其他危及器官剂量学比较,差异均无统计学意义(P>0.05)。见表3。
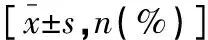
表3 基于三种三维剂量验证系统与TPS的危及器官剂量学差异比较
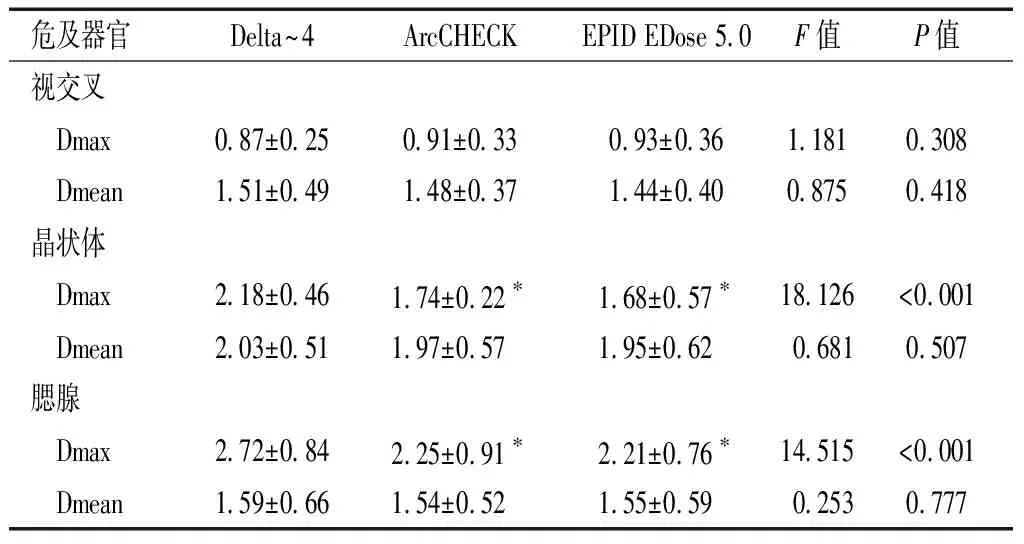
续表3
3 讨论
照射剂量的准确性是保证放疗疗效、使肿瘤原发灶不复发、放射并发症更少的重要因素[7]。为达到降低危及器官受量、提高靶区剂量分布的效果,VMAT技术在机架旋转的同时,加速器出束射线剂量率也不断变化,因此其对剂量验证的要求也更高。本研究主要对比了Delta~4、ArcCHECK和EPID EDose 5.0三维剂量验证系统在鼻咽癌VMAT计划剂量验证中的应用价值。
Delta~4和ArcCHECK是目前常用的VMAT计划三维剂量验证工具,Liang等[8]研究发现,基于Delta~4和ArcCHECK系统计算的剂量与计划系统有良好的一致性,对多叶准直器平移误差的检测也非常敏感。但以上设备价格昂贵,使用也相对不便,且基于均匀模体的剂量验证无法准确反映VMAT计划执行患者体内的剂量偏差[9]。EPID EDose 5.0三维剂量验证系统是基于EPID研发的一种剂量验证软件,除具有良好的剂量学响应、重复性与稳定性外,还具有自动化程度高、使用方便等优势。既往研究[10]认为,不同评价标准下γ通过率与治疗计划的偏差来源相关,当评价标准为3%/3 mm时,γ通过率≥95%通过状态较好;此外,部分研究[11]则指出3%/2 mm标准更符合临床需求。张朋等[12]研究也发现,三种系统在3%/3 mm标准下γ通过率均处于理想的通过状态,认为三者可很好地用于鼻咽癌VMAT计划的三维剂量验证。本研究结果显示,当评价标准为3%/3 mm时,基于三种验证系统的γ通过率均>95%;2%/3 mm、2%/2 mm标准下,基于ArcCHECK、EPID EDose 5.0系统的γ通过率高于Delta~4系统,提示三种剂量验证系统均可用于鼻咽癌VMAT计划的剂量验证,尽管在不同分析标准下三者验证结果对比存在差异,但都可以满足临床对计划验证的需求,与相关研究[12]报道相似。但本研究相对Delta~4系统,ArcCHECK、EPID EDose 5.0系统γ通过率更高,可优先考虑这两种系统。
γ通过率在评估剂量验证工作中存在不足,尚需其它更丰富的剂量信息进行辅助判断。本研究进一步比较了三种剂量验证系统靶区、危及器官剂量参数与TPS计算结果的差异,研究结果显示,基于Delta~4、ArcCHECK、EPID EDose 5.0三维剂量验证系统计算的靶区剂量学指标和危及器官剂量学指标与TPS计算的剂量学指标差异值均<3%;除危及器官晶状体、腮腺Dmax与TPS计算的Dmax存在差异外,其他剂量学指标比较均无明显差异,提示基于Delta~4、ArcCHECK和EPID EDose 5.0三维剂量验证系统计算的靶区、危及器官剂量与TPS计算的剂量差异较小。这些差异可能来自:(1)重建剂量过程需引入校准因子,而获得校准因子的过程会引入误差[13];(2)验证系统的模体摆位存在误差,会影响剂量跌落梯度较大区域的照射剂量[14];(3)靶区位于仪器边缘时,也会影响剂量的计算结果[15]。
综上所述,Delta~4、ArcCHECK和EPID EDose 5.0验证系统在VMAT计划剂量验证中可直观、快速地分析出剂量差异,均可为患者治疗计划的质量验证提供丰富的剂量参数信息,但ArcCHECK和EPID EDose 5.0验证系统相对Delta~4更好,可优先考虑。

