不同时机亚低温结合高压氧治疗重型颅脑损伤的远期疗效及对氧化应激反应的影响
马晶,王晓慧,崔大勇
(吉林大学白求恩第一医院神经创伤外科,吉林 长春 130021)
颅脑损伤是临床常见的主要由外界暴力直接引起的神经外科疾病,我国每年大约有60万人发生颅脑损伤,死亡约10万人,因其具有较高的危险性,已引起外医学界的广泛关注[1-2]。引起颅脑损伤的原因多种多样,交通事故伤为首要致病原因[3]。临床上根据颅脑损伤的严重程度分为轻、中、重、特重四种类型,其中重型颅脑损伤的主要特征为广泛颅骨骨折、脑干损伤及颅内血肿等。当脑组织发生重大损伤后,脑部血液循环不畅,加之脑细胞损伤容易诱发脑组织缺氧,短时间机体缺氧是造成致命性损伤的重要原因[4]。随着医疗技术和医疗器械的不断发展,重型颅脑损伤的死亡率明显降低,但仍需进一步提高诊疗效果,改善预后。高压氧治疗可有效提高氧分压、降低颅内压,改善脑组织供氧,促进损伤神经恢复,在临床广泛应用于颅脑损伤患者[5]。早在九十年代,亚低温治疗颅脑损伤就已得到了国内外医师的重视,将患者保持低体温可有效维持其基本生命体征,减缓病情发展[6]。目前重型颅脑损伤患者术后应用亚低温结合高压氧治疗是常见的措施,但对于治疗时机的选择临床仍存在一定的争议。本研究旨在探讨不同时机亚低温结合高压氧治疗重型颅脑损伤的远期疗效及对氧化应激反应的影响。
1 资料与方法
1.1 一般资料
选取2018年1月至2020年1月吉林大学白求恩第一医院收治的93例重型颅脑损伤患者为研究对象,根据治疗方式不同分为早期组(n=45)和常规组(n=48)。早期组中,男性29例,女性16例;年龄24~57岁,平均(37.49±8.54)岁;GCS评分3~8分,平均(6.48±0.81)分;致伤原因:交通事故伤24例,砸伤12例,高空坠伤8例,其他1例。 常规组中,男性30例,女性18例;年龄22~58岁,平均(38.46±9.13)岁;GCS评分3~8分,平均(6.19±0.93)分;致伤原因:交通事故伤26例,砸伤11例,高空坠伤9例,其他2例。本研究经本院医学伦理委员会审核通过。两组患者一般资料比较,差异无统计学意义(P>0.05)。纳入标准:(1)影像学检查提示广泛颅骨骨折、脑干损伤及颅内血肿等,明确诊断为重型颅脑损伤;(2)伤后呈昏迷状态,格拉斯哥昏迷量表评分(GCS)[7]为3~8分;(3)入院后24 h内行开颅去骨瓣减压手术者;(4)术后生命体征平稳、颅内无活动性出血者;(5)临床资料完整者。排除标准:(1)既往存在脑出血、脑外伤等脑部损伤者;(2)合并糖尿病、高血压等基础疾病者;(3)合并急性感染者;(4)合并器官损伤危及生命者;(5)入院时体温低于30 ℃者。
1.2 方法
两组患者均给予营养神经、脱水降颅压及抗感染等对症治疗。常规组术后立即使用亚低温治疗仪(珠海和佳医疗设备股份有限公司)进行头部和全身降温:将冰毯温度设置在34 ℃左右,垫在病床上直接接触患者皮肤,另使用毛巾包裹冰袋放在患者前额、腋下及腹股沟等位置,使肛温控制在33~35 ℃。当颅内压降至正常水平后维持治疗24 h。当亚低温治疗完成后进行高压氧治疗,使用医用空气加压氧舱GY3200治疗,治疗前20 min缓慢加压至2.5ATA,稳定氧分压并维持40 min,后20 min缓慢减压至患者出舱,80 min/次,1次/d。治疗过程护理人员应密切关注患者是否出现皮肤颜色概念、不正常出汗及呼吸困难等情况,若出现应立即停止治疗。早期组患者术后同时进行亚低温和高压氧治疗,操作方法同常规组。疗程均为1个月。
1.3 观察指标
(1)组织氧分压和颅内压水平:治疗前及治疗1个月后分别采用血流灌注及氧分压监测系统、颅内压监护仪进行监测。(2)氧化应激指标:治疗前和治疗1个月后采集患者清晨空腹静脉血5 mL,离心处理后取血清样本,采用分光光度法检测血清还原型谷胱甘肽(GSH)和丙二醛(MDA)水平。还原型谷胱甘肽含量检测试剂盒高于北京索莱宝科技有限公司,丙二醛酶联免疫吸附测定试剂盒购于武汉伊莱瑞特生物科技股份有限公司;操作按试剂盒说明书进行。(3)神经功能:治疗前及治疗1个月后分别用格拉斯哥昏迷量表(GCS)评分、美国国立卫生研究院卒中量表(NIHSS)评分[8]和简易精神状态评价量表(MMSE)评分[9]评估患者昏迷状态、神经功能状态和认知功能。其中GCS、MMSE评分越高,则患者昏迷程度越轻、认知功能越好;NIHSS评分越低则患者神经功能状态越好。(4)远期疗效:治疗结束后随访1年,应用格拉斯哥预后量表(GOS)[10]评分评估,分为病死、植物生存、重度残疾、中度残疾和恢复良好5个等级。
1.4 统计学分析
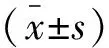
2 结果
2.1 两组患者组织氧分压和颅内压水平比较
治疗前,两组患者组织氧分压和颅内压水平比较,差异无统计学意义(P>0.05)。治疗1个月后,两组患者组织氧分压均升高(P<0.05),且早期组组织氧分压高于常规组(P<0.05);颅内压均降低(P<0.05),且早期组低于常规组(P<0.05)。见表1。
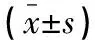
表1 两组患者组织氧分压和颅内压水平比较
2.2 两组患者氧化应激指标比较
治疗前,两组GSH和MDA水平比较,差异无统计学意义(P>0.05)。治疗1个月后,两组患者GSH水平均升高(P<0.05),且早期组高于常规组(P<0.05);MDA水平均降低(P<0.05),且早期组低于常规组(P<0.05)。见表2。
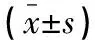
表2 两组患者氧化应激指标比较
2.3 两组患者神经功能比较
治疗前,两组患者GCS、NIHSS和MMSE评分比较,差异无统计学意义(P>0.05)。治疗1个月后,两组患者GCS、MMSE评分均升高(P<0.05),且早期组高于常规组(P<0.05);NIHSS评分均降低(P<0.05),且早期组低于常规组(P<0.05)。见表3。
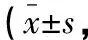
表3 两组患者神经功能比较分)
2.4 两组患者远期疗效比较
随访1年,早期组患者恢复良好率高于常规组,差异有统计学意义(P<0.05)。见表4。
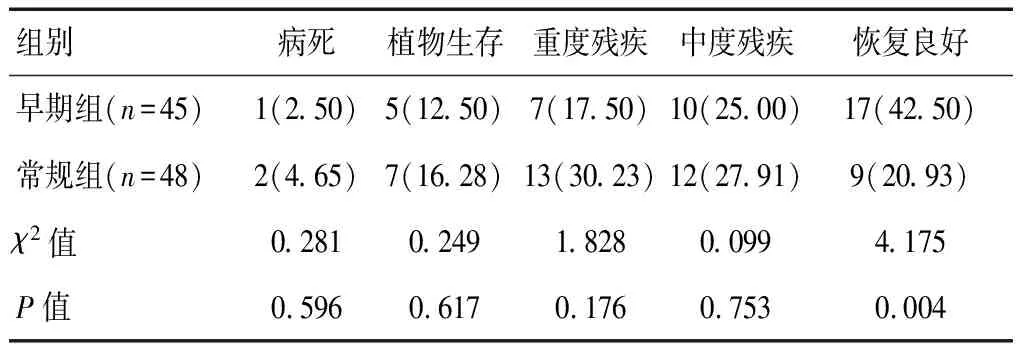
表4 两组患者远期疗效比较[n(%)]
3 讨论
重型颅脑损伤是急诊科常见的疾病种类,其发病急,预后差,有较高的致残率和死亡率,给家庭和社会带来了沉重的负担。近年来,如何降低重型颅脑损伤的残死率成为国内外医学界研究的难点和热点。多项临床研究证实,亚低温治疗是重型颅脑损伤有效的治疗手段之一,分析其作用机制主要为:(1)降低人脑代谢率和氧耗。相关研究[11]表明,机体核心温度每下降1 ℃,机体代谢率会随之降低5%左右,低温环境下氧消耗降低,葡萄糖利用率增加。(2)可减少神经细胞破坏程度,维持神经细胞和神经胶质细胞的完整性。(3)保护血脑屏障,脑损伤后血脑屏障受损导致大量有毒物质进入脑组织,从而诱发血管源性脑水肿,且脑水肿严重程度与血脑屏障损伤程度有密切联系。临床试验[12]发现,在30~33 ℃的环境下,动物血脑屏障损坏程度最低,亚低温可减缓血脑屏障受损程度。(4)降低血浆中神经元特异性烯醇化酶水平、炎性因子水平及细胞毒性产物,对脑组织有一定的保护作用。由于患者发生重型颅脑损伤后,脑细胞缺氧缺血容易形成继发性脑损伤,除开亚低温治疗外还应联合高压氧治疗,从而纠正脑部细胞缺血缺氧状态,促进脑部神经功能恢复[13]。
本研究结果显示,随访1年时间后早期组恢复良好率高于常规组(P<0.05),表明术后同时进行亚低温和高压氧治疗的临床效果更为显著,原因可能是在亚低温状态下,患者代谢下降,从而减少脑部氧耗,一定程度降低患者脑细胞缺氧风险,同时采用高压氧治疗,可进一步纠正脑缺氧状态,从而有利于患者神经功能恢复。有研究[14]表明,造成重型颅脑损伤患者病理改变的主要原因是颅内压升高,导致脑灌注不足,继而破坏血脑屏障,引发神经元水肿,故降低颅内压具有重要临床意义。本研究结果显示,治疗1个月后,早期组组织氧分压高于常规组(P<0.05),颅内压低于常规组(P<0.05),与武希青等[15]研究结果相似,表明术后早期联合亚低温和高压氧治疗可有效降低颅内压,改善脑部氧供和微循环状况,原因可能在于早期联合高压氧治疗可尽早纠正脑组织缺氧状态收缩颅内血管,减轻脑组织水肿,改善了微循环状况,中断了恶性循环过程。GSH是细胞内的自然抗氧化剂,可直接清除氧自由基,间接提高抗氧化水平,是减少再灌注过程中氧自由基损伤的重要机制[16];MDA是脂质过氧化反应的产物,可有效反应机体细胞受自由基攻击的程度[17]。本研究中治疗1个月后,早期组GSH水平高于常规组(P<0.05),MDA水平低于常规组(P<0.05),原因可能是进行亚低温联合高压氧治疗,脑部耗氧降低,并提高氧分压,降低颅内压,从而可改善患者脑部组织供氧,脑组织摄氧完全则刺激GSH水平升高,而GSH水平升高,则可提高机体抗氧化能力,从而可减轻患者脑组织损伤,使血脑屏障得以修复;同时患者脑部组织供氧状态得以改善,可有效降低机体内自由基水平,MDA水平降低。此外,早期组GCS、MMSE评分高于常规组(P<0.05),NIHSS评分低于常规组(P<0.05),表明术后早期同时行亚低温和高压氧联合治疗可有效改善患者体内应激氧化反应和神经认知功能。
综上,术后同时进行亚低温和高压氧治疗可有效降低重型颅脑损伤患者颅内压,改善其脑部供氧和神经功能,减轻氧化应激反应,且远期疗效好。但本研究仍存在一定的局限性,如样本量少、神经功能评定方式受主观因素影响等,后续研究可通过扩大样本量、选取客观评价指标进一步完善。

