血清SCCA、CYFRA21-1水平与食管鳞癌患者同步放化疗近期疗效的关系
丁柏英,曾淑超,郭英杰,张景旭,张凤志
(1.承德市第三医院放疗科;2.承德市中医院肿瘤科,河北 承德 067000)
食管癌是常见的消化道恶性肿瘤,发病率、死亡率居于常见恶性肿瘤中第4位,其中食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是食管癌的主要类型,占80%以上[1]。由于ESCC起病隐匿,病情进展迅速,多数患者确诊时已为疾病晚期,丧失了最理想的手术时机。因此,同步放化疗已成为中晚期ESCC患者的标准治疗方案,但放化疗周期长,患者个体差异大,不同患者对放化疗的治疗反应性存在明显差异[2]。探寻能够预测ESCC同步放化疗近期疗效的分子标志物对于指导ESCC患者个体化治疗意义重大。鳞状细胞癌抗原(squamous cell careinoma antigen,SCCA)是广泛认可的肿瘤标志物,在肺癌、乳腺癌和食管癌等很多恶性肿瘤中均存在表达异常[3]。细胞角蛋白片段19抗原21-1(cytokeratin 19 fragment,CYFRA21-1)可作为食管癌诊断的肿瘤标志物,与食管癌的发生发展具有相关性,但单一应用对于食管癌的临床评估存在一定局限性[4-5]。本研究拟评价血清SCCA、CYFRA21-1水平与ESCC同步放化疗近期疗效的关系。
1 资料与方法
1.1 一般资料
将2017年4月至2020年3月在承德市第三医院行同步放化疗治疗的120例ESCC患者纳入为研究对象。纳入标准:(1)经病理组织学检查确诊为ESCC;(2)III~IV期患者,符合同步放化疗适应症;(3)美国东部肿瘤合作组(eastern cooperative oncology group,ECOG)评分为0~2分;(4)预计生存期≥3个月;(5)既往未接受抗肿瘤治疗。排除标准:(1)合并其他恶性肿瘤;(2)伴有自身免疫性疾病;(3)伴有严重心脏疾病;(4)未完成同步放化疗疗程者;(5)既往有胸腹部放化疗史者;(6)临床资料不齐全者。所有患者中,男性75例,女性45例;年龄40~78岁,平均(65.21±9.12)岁;临床分期:III期66例,IV期54例,参照国际抗癌联盟(Union for International Cancer Control,UICC)与美国癌症联合会(American Joint Committee on Cancer,AJCC)共同制定的TNM分期标准;肿瘤直径:<5 cm者49例,≥5 cm者71例。
1.2 方法
1.2.1 血清SCCA、CYFRA21-1的测定 患者在入院后、抗肿瘤治疗前均采集外周静脉血3 mL,离心(3 000 rpm,r=7.5 cm)10 min,取上清液,置于-80 ℃环境下保存;应用酶联免疫吸附法(enzyme-linked immunosorbent assays,ELISA)进行血清SCCA的测定,试剂盒为上海泽叶生物科技有限公司产品;应用电化学发光法进行CYFRA21-1的测定,试剂盒为上海原鑫生物科技有限公司产品。
1.2.2 放化疗治疗方法 放疗采用三维适形放疗(three dimensional conformal radiotherapy,3D-CRT),处方剂量为2.0 Gy/次,5次/周,总剂量为50~60 Gy,5~6周完成。化疗予以紫杉醇70 mg/m2静脉滴注,d1和d8;奈达铂30 mg/m2静脉滴注,d1~d3,进行两个周期化疗,两个周期间隔21 d。
1.3 观察指标
疗程结束后,参照实体瘤疗效标准(response evaluation criteria in solid tumour 1.1,RECIST1.1)[6]进行治疗疗效评价。靶病灶完全消失,为完全缓解(complete response,CR);相比基线时,靶病灶最大径减少≥30%,为部分缓解(partial response,PR);靶病灶最大径增加≥20%,或出现新发病灶,为进展(progressive disease,PD);处于PR与PD之间为稳定(stable disease,SD)。将CR和PR归为缓解组,SD和PD归为未缓解组。
1.4 统计学分析
2 结果
2.1 放化疗近期疗效
120例患者中,CR 33例(27.50%),PR 47例(39.17%),SD 33例(27.50%),PD 7例(5.83%)。缓解组80例(66.67%),未缓解组40例(33.33%)。
2.2 放化疗前血清SCCA、CYFRA21-1截断值的确定
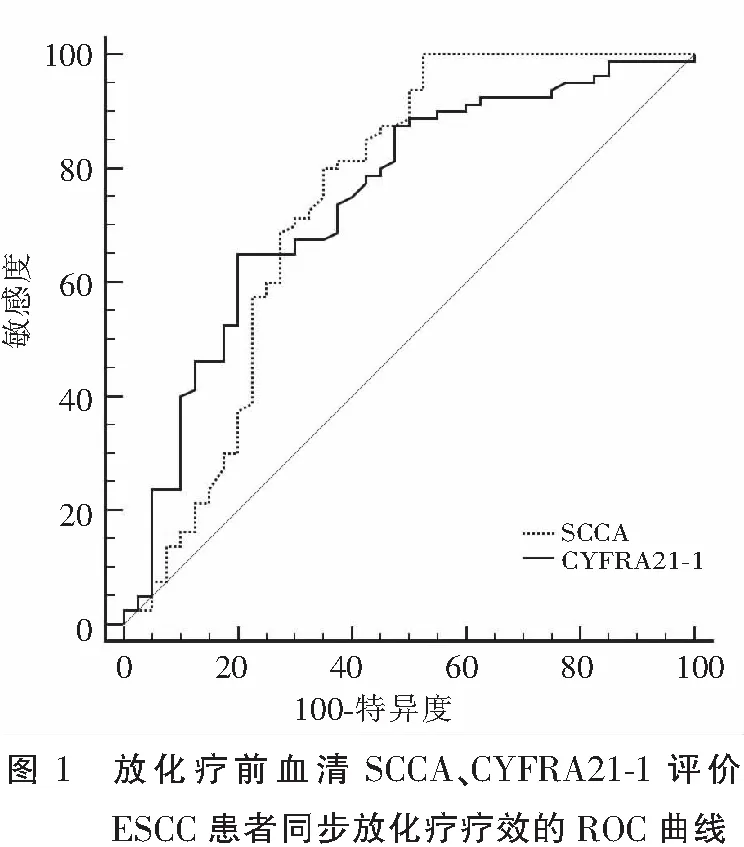
缓解组血清SCCA、CYFRA21-1水平均高于未缓解组(P<0.05)。采用ROC曲线分析治疗前血清SCCA、CYFRA21-1水平与放化疗疗效的关系,其曲线下面积(area under curve,AUC)分别为0.747(95%CI:0.659~0.822)、0.746(95%CI:0.659~0.821),截断值分别为5.43 ng/mL、3.59 ng/mL,敏感度分别为100.00%和65.00%,特异度分别为47.50%和80.00%。见表1及图1。
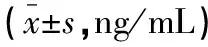
表1 缓解组与未缓解组血清SCCA、CYFRA21-1水平比较
2.3 ESCC患者同步放化疗疗效与临床病理参数的关系
单因素分析显示,ESCC患者同步放化疗近期疗效与年龄、性别、肿瘤位置、临床分期、肿瘤直径和有无淋巴结转移均无相关性(P>0.05);与血清SCCA、CYFRA21-1水平具有相关性(P<0.05),SCCA高表达(>5.43 ng/mL)、低表达(≤5.43 ng/mL)组放化疗缓解率分别为54.84%(34/62)和76.67%(46/60),差异有统计学意义(χ2=6.436,P=0.014);CYFRA21-1高表达组(>3.59 ng/mL)、低表达组(≤3.59 ng/mL)放化疗缓解率分别为57.35%(39/68)和78.85%(41/52),差异均有统计学意义(χ2=6.126,P=0.013)。见表2。
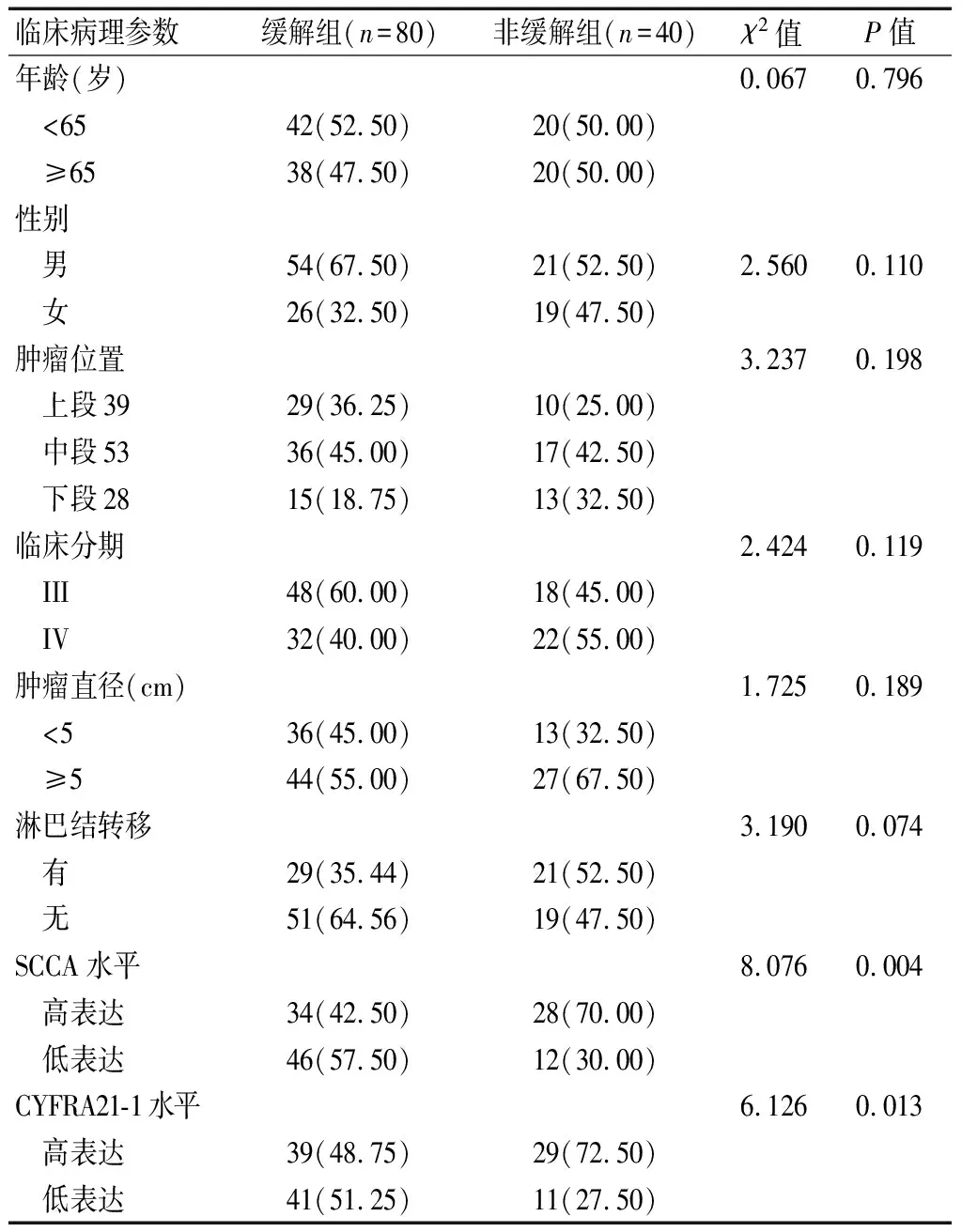
表2 ESCC患者同步放化疗疗效与临床病理参数的关系[n(%)]
2.4 ESCC患者同步放化疗疗效的Logistic回归分析
以ESCC患者同步放化疗疗效为因变量,以临床分期、肿瘤直径、有无淋巴结转移和血清SCCA水平、CYFRA21-1水平为自变量行Logistic回归分析,结果显示,SCCA高表达、CYFRA21-1高表达是ESCC患者同步放化疗疗效的独立危险因素(P<0.05)。见表3。
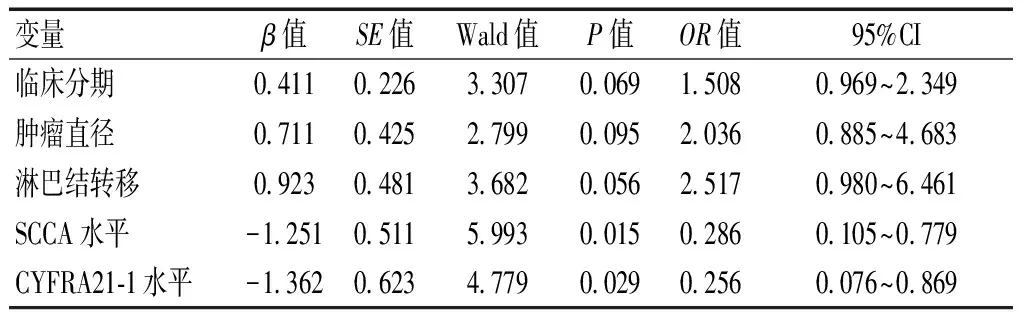
表3 ESCC患者同步放化疗疗效的Logistic回归分析结果
3 讨论
同步放化疗已成为局部进展期ESCC的主要治疗手段,能够明显改善患者预后。但部分研究[7]报道,ESCC患者放化疗后肿瘤完全缓解率仅为35%~52%,提示大部分患者对放化疗不敏感。因此,寻找可靠的标志物来预测ESCC放化疗疗效尤为重要。血清肿瘤标志物不仅可作为早期诊断和病情进展评估的指标,还越来越多地被用于肿瘤疗效的预测[8]。血清SCCA、CYFRA21-1是近年来备受关注的血清肿瘤标志物,被发现在多种恶性肿瘤中存在异常表达[9-10]。本研究旨在探讨SCCA、CYFRA21-1在ESCC同步放化疗疗效的评估价值。
张文等[11]检测SCCA在肺腺癌患者血清中表达,发现化疗后PR患者血清SCCA相比化疗前显著下降,而在SD患者中无明显改变,在PD患者化疗后相比化疗前显著上升,提示血清SCCA水平有助于疗效的评价。本研究显示,缓解组血清SCCA水平显著低于未缓解组,SCCA高表达(>5.43 ng/mL)放化疗缓解率显著高于低表达(≤5.43 ng/mL)组,提示放化疗治疗前血清SCCA高表达患者有着较差的近期疗效。进一步Logistic回归分析显示,SCCA高表达是ESCC患者同步放化疗疗效的不利因素,有助于临床治疗策略的制定。
CYFRA21-1是上皮细胞形成的重要结构蛋白之一,在鳞状上皮有着广泛分布,在肺癌的诊断中发挥着重要作用,对于消化道肿瘤也存在一定的阳性表达。李洋等[12]对118例ESCC患者进行检测发现,CYFRA21-1在ESCC患者中存在高表达,对于ESCC的诊断和分期评估有重要价值。血清CYFRA21-1可能有助于预测ESCC患者的放化疗敏感性[13]。本研究显示,缓解组血清CYFRA21-1水平低于未缓解组,CYFRA21-1高表达(>3.59 ng/mL)放化疗缓解率显著低于低表达(≤3.59 ng/mL)组,且Logistic回归模型显示,CYFRA21-1高表达是ESCC患者同步放化疗疗效的不利因素,这与杨颖等[14]报道类似。这可能是因为血清CYFRA21-1水平越高,肿瘤负荷越重,对治疗反应性越差[15]。由此可见,血清CYFRA21-1水平也有助于预测ESCC患者同步放化疗疗效。
综上所述,血清SCCA、CYFRA21-1与ESCC患者同步放化疗近期疗效相关,高SCCA、CYFRA21-1水平往往提示较差疗效,这可为ESCC患者的临床治疗提供参考依据。

