零换水条件下复合益生菌对罗非鱼生长性能、肌肉品质及养殖水体环境的影响
陈丽婷,吴剑峰,赵玉兵,严 欣,肖 俊,罗永巨,项桂德,梁军能
(1.广西壮族自治区水产科学研究院/广西水产遗传育种与健康养殖重点实验室,广西 南宁 530021;2.广西诺亚生物科技发展有限公司,广西 柳州 545000)
【研究意义】我国的水产养殖业正朝集约化方向发展[1],但高密度养殖带来的水质恶化、养殖动物免疫力下降、病害频发等问题,是制约我国集约化养殖高速发展的重要原因[2]。目前精养系统改善水质的办法通常是直接换水,但这会增加养殖动物的应激,同时给养殖尾水处理及水域环境造成较大压力。国务院在党的十八大后提出“全面加强生态环境保护,坚决打好污染防治攻坚战”的意见,明确提出了建设生态文明的重要举措。当前,世界各地水产养殖业正蓬勃发展,发展水资源节约型、环境友好型的生态健康养殖,将成为未来养殖业的焦点[3]。因此,开展水资源节约型、生态健康养殖研究,对指导水产养殖业的可持续发展具有重要意义。【前人研究进展】目前益生菌在畜牧业和人类健康中的应用已较为广泛,因其无耐药性、环保、安全等优点而受到关注,但在水产养殖中应用起步较晚。水质在水产养殖中起到至关重要的作用,在水体中直接添加益生菌,不仅可改善养殖水质,还能改善养殖动物的肠道健康。在养殖水体中添加益生菌用以改善水质、促进养殖动物的健康和生长的方法是目前较推崇的生态养殖方式之一[4-8]。Iribarren 等[9]在水体中添加益生菌后,有效抑制了水体中病原微生物的生长繁殖,改善了水质;李咏梅等[10]在凡纳缤对虾养殖水体中添加益生菌后改善了水质并提高了对虾的生长性能;徐晨等[11]在生物絮团养殖模式下,养殖水体中添加益生菌能够促进异育银鲫的生长;Giatsis 等[12]在罗非鱼养殖水体中添加芽孢杆菌7 d 后,其肠道菌群变化显著;Xia 等[13]在罗非鱼水体中添加乳酸乳球菌也产生同样效果,并且增强了机体对疾病的抵抗能力。在零换水条件下,学者们的研究多集中在添加不同碳源[14-15],或不同碳氮比所构建的生物絮团系统,对水质[16]及养殖动物的生长、体成分、消化酶[17]以及抗氧化和免疫[18]等的影响,或者在零换水构建的生物絮团条件下,研究不同营养水平对养殖动物生长及营养的贡献[19-21],以及研究在零换水条件下添加生物藻土[22]、碳水化合物[23]对养殖池中微生物菌落结构的影响。而在零换水条件下添加益生菌的研究报道较少。唐汇娟等[24]在饲料中添加糖蜜,并在养殖水体中泼洒芽孢杆菌,养殖周期55 d,全程不更换水体,结果表明这种方式在一定程度上改善了罗非鱼的生长成活率和生长速率;王淼等[25]等每周泼洒1 次异养硝化细菌,维持10周,结果提高了尼罗罗非鱼的抗氧化能力,也维持了池塘水质;孙博超等[26]在凡纳滨对虾发育到蚤状幼体时开始投喂益生菌,直到发育成仔虾后5 d 停止,整个过程中不换水,结果表明益生菌组合不仅能够抑制弧菌繁殖还能提高凡纳滨对虾幼体的成活率。【本研究切入点】上述研究结果表明,添加益生菌能增强鱼体的免疫力并且提高生长性能,而在水体中直接添加益生菌还能改善水质,但在零换水条件下添加益生菌的研究鲜有报道,且主要集中在单一菌种的研究上,而单一菌种往往在生态作用中不足以应对复杂多变的养殖水域环境[27],因此,探讨复合益生菌对养殖水质的影响,寻找在零换水条件下适合罗非鱼养殖的益生菌组合,对促进罗非鱼的健康、生态养殖发展具有重要意义。【拟解决的关键问题】以罗非鱼为养殖对象,全池泼洒复合益生菌,以正常更换养殖水的养殖模式为对照,研究添加复合益生菌对罗非鱼养殖水质、生长、肌肉品质的影响,以期为促进零水交换条件下的生态、健康养殖技术的发展提供参考。
1 材料与方法
1.1 试验材料
供试罗非鱼(Oreochromis mossambicus)规格整齐,体质健壮,个体质量为12.1(±0.5)g,由广西壮族自治区水产科学研究院国家级广西南宁罗非鱼良种场提供,试验开始前驯化2 周。商品饲料来源于南宁通威饲料有限公司,粗蛋白含量为36%。复合益生菌由广西诺亚生物科技发展有限公司提供,该复合益生菌组合包括细黄链霉菌、荚膜红假单胞菌、酵母菌、乳酸菌4 个菌种,活菌含量≥3×109CFU/mL。罗非鱼养殖于广西罗非鱼良种场的室内水泥池(长12 m,宽5 m,高1.8 m),水深1.5 m,养殖用水为曝气自来水。
1.2 试验方法
试验处理水体中添加复合益生菌菌液(活菌含量≥3×109CFU/mL),每90 m3水体添加菌液50 mL,试验开始的首月每隔1 周按相同剂量补充添加1 次菌液,试验第2 个月开始至试验结束,每隔1 个月按相同剂量补充添加1 次菌液;以正常更换养殖水的养殖模式为对照,对照不添加益生菌,模拟正常的养殖管理,试验开始第1、2 个月,每隔2 周更换养殖水体的50%,第3 个月开始到试验结束,每周更换养殖水体的50%。养殖试验设3 个重复,一共6 个池,每个池作为1 个处理。
试验处理和对照的养殖池均使用微孔增氧进行24 h 曝气后放养罗非鱼。试验开始后,将规格整齐的罗非鱼种2 700 尾,随机分成6 组,每组450 尾,养殖密度7.5 尾/m2。每天投喂2 次(8:00—9:00,17:00—18:00),投喂量按体重的3%计,每15 d 测量鱼体质量后调整1 次投喂量。试验鱼经分组后驯养适应1 周,养殖试验于2020 年6 月18 日开始,至10 月28 日结束,共133 d。
1.3 测定指标及方法
1.3.1 生长指标测定 试验结束后,罗非鱼停食24 h,统计成活率及饵料系数;每处理随机挑选6尾,测量质量、体长,计算增重率、特定生长率。

1.3.2 品质测定 取肌肉测量水分、粗灰分、粗脂肪以及氨基酸。每个处理选取3 尾鱼,取每尾鱼体一侧第3~8 肋骨之间的腹肌约7 g,测定肌肉氨基酸;取鱼体另一侧第3~8 肋骨背鳍间的肌肉约10 g,测定常规成分。常规成分的水分测定参照GB 5009.3-2010,采用105℃烘箱恒重法;粗脂肪测定参照GB/T 5009.6-2003,采用索氏抽提法;灰分测定参照GB 5009.4-2010,550℃马弗炉灼烧法;粗蛋白测定参照GB 5009.5-2010,采用凯氏定氮法。氨基酸测定釆用Hetach L-8800 氨基酸自动分析仪,由四川威尔检测中心测定。
1.3.3 水质分析 试验第1 天开始采集水样进行水质检测,之后每周于9:00 采集1 次直到试验结束。采样用对角线方式选择等距的3 个点,采集上层水,3 个点的水样混合后现场检测。温度和溶解氧使用雷磁便携式溶氧测定仪(JPB-607A型)检测,pH、氨氮、亚硝酸盐采用奥克丹水质分析仪(OCT-B 型)检测。
1.3.4 生物菌落结构分析 将试验结束前最后1次采集的水体3 L,利用真空抽滤,水体全部经过0.22 μm 滤膜,将滤膜含菌一面向内折叠后置于无菌EP 管中,在液氮中速冻后,置于5 kg 干冰中包埋后送实验室进行16S rRNA 高通量测序。
用 CTAB 法提取滤膜中的DNA,PCR 扩增使用Phusion®混合液和保真酶,引物区域为16S V4 区,扩增区域包括16S V3~V4 区。PCR 产物目的条带利用Qiagen 公司的胶回收试剂盒进行产物回收产物。
使 用TruSeq®DNA PCR-Free Sample Preparation Kit 建库试剂盒进行文库构建,构建好的文库经过Qubit 和Q-PCR 定量,检测合格后使用Novaseq PE250 进行上机测序。
利用Qiime 分析工具对测序数据进行质量控制,将一致性为97%的序列进行OTUs 聚类,对出现频率高的代表序列的物种进行注释。根据注释结果,选取每个样品在门水平最大丰度排名前10 的物种生成物种相对丰度累加的柱形图;在属水平上,筛选相对丰度排名前35 的物种绘制成热图。用Qiime(Version 1.7.0)计算观测条数(Observed-species)及α 多样性指数(Shannon、Simpson、Chao1、ACE、Goods-coverage),采用R 软件(Version 2.15.3)绘制稀释曲线(Rarefaction curve)、等级聚类曲线(Rank abundance)、维恩(Venn)图。
试验数据统计使用SPSS 15.0,采用单因素方差分析(One-way ANOVA)和Duncan氏法进行多重比较,检验组间差异的显著性。
2 结果与分析
2.1 添加益生菌对罗非鱼生长性能的影响
试验结束时,添加益生菌的试验处理罗非鱼均重为485.32(±0.12)g,对照个体均重为455.93(±31.46)g,试验处理略高,但差异不显著;成活率方面,试验处理的成活率显著高于对照,而饵料系数显著低于对照。此外,试验处理的增重率和特定生长率均高于对照,但差异不显著(表1)。
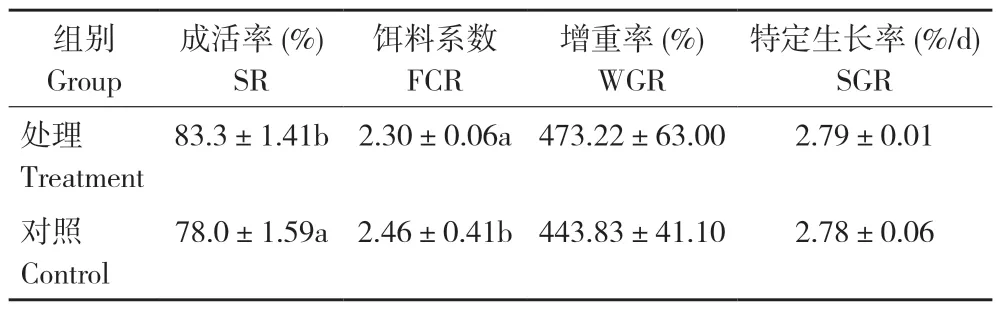
表1 添加益生菌对罗非鱼生长性能的影响Table 1 Effects of adding probiotics on growth performance of tilapia
2.2 添加益生菌对罗非鱼肌肉品质的影响
由表2 可知,试验处理罗非鱼的粗蛋白、粗脂肪水平均显著高于对照,但差异不显著;水分和粗灰分与对照相比差异不显著。由表3 可知,试验处理罗非鱼的肌肉氨基酸总量、必需氨基酸和鲜味氨基酸含量均高于对照,但差异不显著。
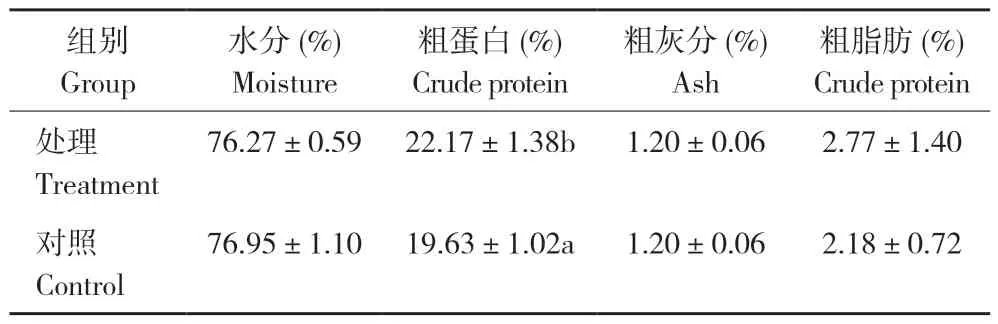
表2 添加益生菌对罗非鱼体成分的影响Table 2 Effects of adding probiotics on body composition of tilapia
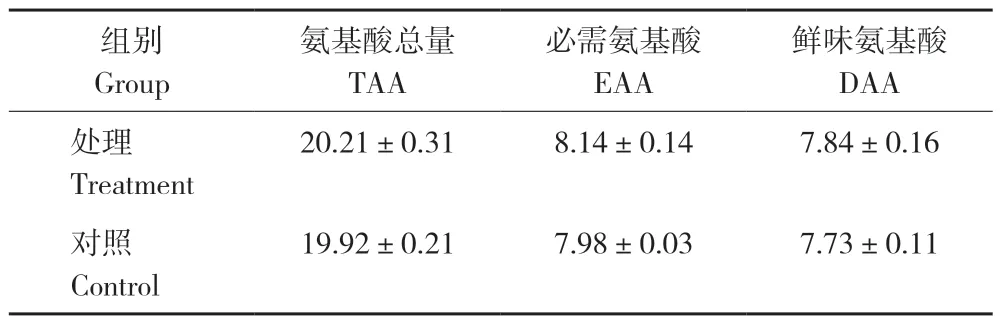
表3 添加益生菌对罗非鱼氨基酸的影响Table 3 Effects of adding probiotics on amino acid of tilapia
2.3 添加益生菌对养殖水体水质的影响
试验期间,养殖池水温为26.5~30.5℃,pH为7.0~8.0。试验处理水体的溶解氧为6.50 mg/L,对照为6.48 mg/L,差异不显著,而氨氮浓度显著高于对照,亚硝酸盐氮浓度显著低于对照(表4)。
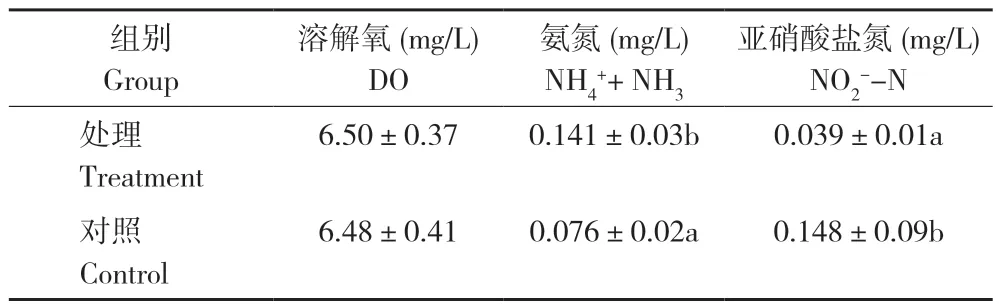
表4 添加益生菌对养殖水体水质的影响Table 4 Effects of adding probiotics on aquaculture water quality
2.4 添加益生菌对养殖水体生物菌落的影响
Goods-coverage 指数表明,本研究测序深度达99%,说明测序基本包含了所有物种。Simpson 指数评估优势种群的集中程度,值越小,说明群落多样性越高;Shannon 指数反映群落多样性,值越大,说明群落多样性越高[28],结合Observed-species、Chao1 和ACE 指数可知添加益生菌试验处理系统中的微生物物种丰富度较高(表5)。

表5 添加益生菌对微生物群落丰富度和多样性指数的影响Table 5 Effects of adding probiotics on bacterial community richness and diversity index
稀释曲线主要反映样品测序数据量的合理性,如果曲线已趋向平坦,说明测序数据量已渐进合理,后续没有必要进行更多数据量的测序。图1 显示试验处理与对照的稀释曲线均已趋于平坦,证明所得测序数据量已饱和且测序数据合理,具有代表性,可进一步作数据统计分析。

图1 稀释曲线Fig.1 Rarefaction curve
等级聚类曲线可反映测序物种的丰度和均匀度。从水平方向上看,曲线的宽度反映物种的丰富度,曲线在横坐标轴上跨度越大,代表越高的物种丰度;从垂直方向上看,物种的均匀度由曲线的平滑度反映,物种分布越均匀,则曲线越平缓[29]。由图2 可见,添加益生菌试验处理养殖水体的物种丰度大于对照。维恩图可比较直观地显示对照和试验处理之间共有、特有的OTUs,本研究从试验处理和对照分别检出OTUs 数目869、717 个,其中共有的OTUs 数目为557 个,试验处理特有的OTUs 数目为312 个,对照中特有的OTUs 数目为160 个(图3)。
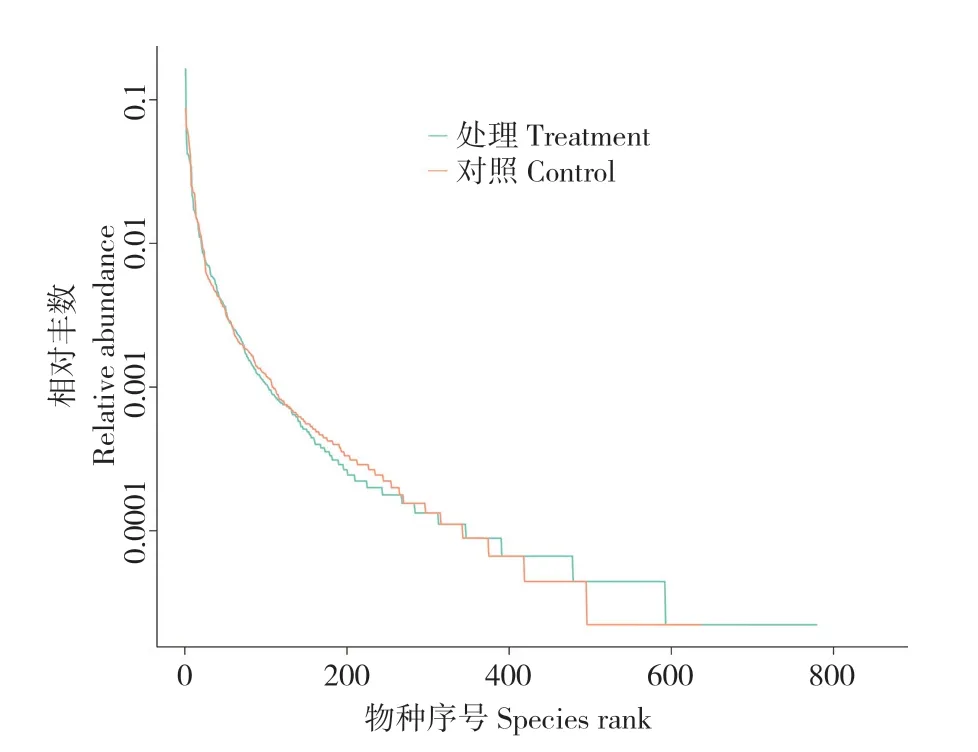
图2 等级聚类曲线Fig.2 Rank abundance curve

图3 细菌数目的维恩分析Fig.3 Venn analysis of the number of bacteria
由图4 可知,在细菌门水平上,试验处理和对照中丰度较高的前10 个门分别为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝藻门(Cyanobacteria)、疣微菌门(Verrucomicrobia)、梭杆菌门(Fusobacteria)、螺旋体菌门(Saccharibacteria)、未分类(Candidatedivision-SRI)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)。其中,试验处理的优势菌门(平均相对丰度>1%)[30]是变形菌门(41.41%)、放线菌门(35.99%)、拟杆菌门(8.28%)、梭杆菌门(5.8%)、疣微菌门(3.4%);对照的优势菌门为变形菌门(53.69%)、拟杆菌门(18.40%)、放线菌门(8.05%)、梭杆菌门(5.7%)、疣微菌门(4.9%)、未分类(2.36%)、绿弯菌门(1.39%)。
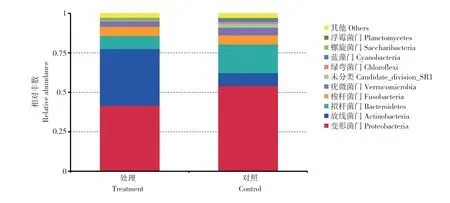
图4 生物菌落在门水平上的相对丰度分析Fig.4 Analysis of relative abundance of biological colonies at phylum level
3 讨论
3.1 添加益生菌对罗非鱼生长的影响
鱼类终生生活在水中,水质的好坏对其健康及生长至关重要,保持充足的溶解氧和适宜的pH值是维持水产养殖动物正常生长的基础。本试验过程中,添加益生菌的试验处理和对照养殖水体的溶解氧和pH 值均保持相对稳定,且符合渔业水质标准[31],为罗非鱼的生长提供了有利条件。水体中的亚硝酸盐氮是主要污染源之一,亚硝酸盐氮通过影响养殖动物的耗氧、氨氮排泄以及渗透压等影响机体健康。周鲜娇等[32]用不同浓度的亚硝酸盐氮胁迫健康的凡纳滨对虾,结果发现,亚硝酸盐氮浓度升高,对虾死亡率随之增加;黄翔鹄等[33]、吴中华等[34]在研究亚硝酸盐氮对凡纳冰对虾的毒性实验中也同样发现高浓度的亚硝酸盐氮导致对虾免疫力下降,由此可见,维持水体中较低浓度的亚硝酸盐氮水平是保障养殖动物健康的条件之一。本研究中,添加益生菌试验处理的养殖水体亚硝酸盐氮显著低于对照,说明复合益生菌对降低亚硝酸盐氮方面起积极作用,从而提高罗非鱼的成活率,该研究结果与王梦亮等[35]、沈锦玉等[36]的报道相似。养殖水体中添加益生菌后,通过改变水体菌群结构,抑制病原菌生长繁殖,促进有益菌生长,从而增强养殖动物机体的免疫力[37],吸附霉菌毒素等[38-39]。本试验中,添加益生菌试验处理的罗非鱼成活率显著高于对照,认为与添加益生菌的作用效果有关。一般认为,在水体中添加益生菌后,可通过影响肠道功能等促进生长、降低饵料系数[24,40],光合细菌能够分泌消化酶如蛋白酶、脂肪酶等帮助消化和吸收,促进营养物质吸收[41-42],还能够合成多种维生素和促生长因子[43],从而提高饲料利用率。本试验中添加的荚膜红单胞菌属于光合细菌,具有类似功能,试验处理添加该复合益生菌后,罗非鱼生长在一定程度上有所提高。细黄链霉菌能够产生木聚糖酶,而木聚糖酶在提高饲料利用率和防止动物结肠炎方面有利[44]。本试验中,试验处理的饵料系数显著低于对照,可能是添加益生菌起到了节约饲料的作用。
3.2 添加益生菌对罗非鱼肌肉品质的影响
肠道作为鱼体与外界进行物质交换的主要场所之一,肠道微生物数量、群落结构与养殖的水体环境息息相关。王淼等[25]在养殖水体中泼洒复合益生菌改变了罗非鱼的肠道菌群结构。研究发现,益生菌进入肠道之后,通过抑制有害菌繁殖,促进有益菌生长,特别是改变厚壁菌门和拟杆菌门的比例,从而影响脂肪沉积,进而改善肌肉风味[45-46]。此外,益生菌还能够将脂肪氧化成为小分子物质,而肠道菌群中发生代谢反应产生的风味物质能够转移到肌肉中,增加肌肉中肌苷酸、脯氨酸、苯丙氨酸等滋味物质[47],从而提高风味。夏雨等[48]在饲料中添加乳酸菌饲喂凡纳滨对虾,增加了幼虾肌肉的弹性和咀嚼性。张天阳[49]用150 mL 乳酸菌液饲喂育肥猪时,显著提高了最长肌的粗蛋白含量,邬理洋[50]研究发现单独或混合饲喂微生态制剂、牛膝多糖均可提高育肥猪背最长肌的粗蛋白含量和粗脂肪含量。本试验中,添加益生菌试验处理罗非鱼的粗蛋白含量显著高于对照,粗脂肪含量、氨基酸总量、必需氨基酸和鲜味氨基酸含量也高于对照,与上述报道相类似。可见,添加益生菌可改变水体的菌群结构,提高水体中有益菌的占比,也能通过影响罗非鱼肠道菌群结构的方式,改善罗非鱼的肌肉品质。
3.3 添加益生菌对养殖水质及菌群结构的影响
本研究添加的复合益生菌组合包括细黄链球菌、荚膜红假单胞菌和酵母菌和乳酸菌。乳酸菌能改善养殖水质[51],在水体中通过发挥竞争性抑制的作用,防止有害菌大量繁殖[52];而且乳酸菌能够将水体中的大颗粒物质如残饵、粪便和死藻等通过氧化、氨化、固氮、硝化和反硝化等作用转化为磷酸盐、硝酸盐等物质[53]。荚膜红假单胞菌是光合细菌的一种,光合细菌被广泛应用于水产养殖,具有繁殖速度快、生命力强、营养要求低的特点,并且荚膜红假单胞菌含有天然胡萝卜素,可作为营养物质[54]。本研究中,添加复合益生菌后,在试验过程零换水的情况下,开展养殖试验133 d,与正常换水的对照相比,试验处理养殖水体的亚硝酸盐水平显著低于对照,说明使用益生菌组合能够有效降解水体中的亚硝酸盐含量。但在氨氮去除方面,试验处理养殖水体总的氨氮含量为0.141 mg/L,对照为0.076 mg/L。养殖水体中的氨氮分为离子氨(NH4+)和非离子氨(NH3),非离子氨对鱼鳃造成损害,而离子氨则被认为不易造成伤害,两者的相互转化受水体中pH 和温度的影响。渔业水质标准要求非离子氨≤0.04 mg/L[31]。本试验过程中,养殖水体水温26.5~30.5℃,pH7.0~8.0,溶解氧6.50 mg/L,均在罗非鱼生长适宜范围内,使得氨氮主要以离子氨的形式存在,并未对养殖鱼造成严重影响[55]。添加益生菌试验处理在零换水条件下开展养殖,能够使养殖水质持续稳定,保持适宜的温度、pH和溶解氧,并且亚硝酸盐含量均持续低于更换水质的对照,说明该益生菌组合能够有效改善养殖水体环境,维持良好且持续稳定的水域生态环境,这可能得益于该益生菌组合能够有效建立一套完整的生态系统。但试验过程中,对养殖水体氨氮的去除效果仍不够理想,后续考虑补充芽孢杆菌等菌株作进一步试验。
维系养殖水体的动态平衡是生态健康养殖的必要条件,而水体中微生物在促进物质循环和能量流动中起关键作用[56]。在养殖水体中添加益生菌后可改善水体菌群的多样性,可能与益生菌不仅能抑制有害菌生长繁殖,还能在物质循环中起积极作用有关,如分解大分子有机物等,从而改善了水质,促进其他水体有益菌生长繁殖[40]。细菌群落的丰富度和均匀度多采用Simpson 指数,而群落中较为常见的物种数目多样性则通过Shannon体现,Chaol指数越大,代表物种数量越多,群落丰富度越高。本研究中,添加益生菌试验处理的Chaol 指数显著高于对照,Shannon 指数和Simpson 指数与对照无差异,Observed-species、Chao1 和ACE 指数也很好地验证了这一点,且试验处理中特有的OTUs 数目远高于对照。这说明在零换水条件下,添加益生菌组合能够提高水体细菌菌落的多样性,为维持有效、稳定的养殖生态环境提供保障。郑佳佳等[57]在水体中添加复合益生菌改变了水体菌群结构,创造了良好的养殖环境,与本研究结果相似。
本研究中试验处理和对照的优势菌门存在一定差异,试验处理的优势菌门数量占比94.88%,以变形菌门、放线菌门为主要菌种;对照的优势菌门数量占比89.84%,以变形菌门、拟杆菌门为主。两种水体均为养殖水体中较常出现的有益菌种类,未出现弧菌等有害菌群,可能因为添加该复合益生菌后其在养殖水体中更能快速定植,占据有利地位,抑制有害菌生长繁殖,该研究结果与陈景豪等[58]的研究结论相类似。放线菌门、拟杆菌门和变形菌门等具有重要的脱氮功能[59],在试验处理养殖水体中占比85.68%,在对照中占比80.14%,且试验处理中的放线菌数量占比高于对照,说明添加益生菌后改变了原有的菌群结构。放线菌门可通过抗生等竞争性作用占据优势地位[60],从而抑制其他有害菌群的生长;变形菌门大部分属于异养型细菌,在COD 降解和脱氮过程起主要作用[61-62],变形菌门中最主要的纲为β-变形菌纲,研究表明其与反硝化作用密切相关;拟杆菌门的细菌与DNA、脂类和蛋白质等有机物质的转换密切相关,在处理废水过程中发挥重要作用[57]。疣微菌门和绿弯菌门对有机质的降解和硝化发挥重要作用[63-64]。本研究中试验处理和对照养殖水体中均含有丰富的变形杆菌门、酸杆菌门和拟杆菌门,但在试验处理养殖水体中优势更明显,表明在零换水的条件下添加该益生菌组合,对有机物的转化利用以及维持水体稳定具有积极作用。
4 结论
本研究针对传统水产养殖通过频繁更换水体的方式缓解养殖过程中出现的水质恶化问题,采用添加复合益生菌的方式进行零换水养殖,研究其对水质改善、菌群结构以及罗非鱼生长和肌肉品质的影响,结果显示,添加益生菌组合能够持续、有效地改善并维持良好、稳定的养殖水环境,养殖全程水温26.5~30.5℃,pH7.0~8.0,溶解氧6.50 mg/L,亚硝酸盐0.039 mg/L,均在罗非鱼生长适宜范围内,水体的菌群多样性提高,节约了换水产生的经济成本,同时减少了鱼类应激,维持机体稳定的生理健康,提高了成活率和肌肉品质,降低了饵料系数。此外,添加益生菌组合能够做到零换水,有效控制了养殖尾水的排放,为推进节约型和环境友好型的水域环境建设提供了新思路。

