甘肃省党参根结线虫病发生、分布及病原种类鉴定
石明明 李惠霞 刘永刚 李文豪 倪春辉 韩变 连芸芸 姜伟







摘要 为明确甘肃省党参根结线虫病的发生、分布及病原种类,在甘肃省党参主产区调查、统计田间根结线虫病发生情况,并通过形态学和分子生物学方法进行种类鉴定。结果表明,甘肃省6个党参主产区均有根结线虫病发生,病田率、病株率分别为40.7%、13.2%,病情指数为10.4。依据根结线虫各虫态的形态测量值和雌虫会阴花纹等特征,将危害党参的根结线虫初步鉴定为北方根结线虫Meloidogyne hapla Chitwood,1949。rDNA-ITS区段和28S rDNA D2D3区段序列比对和系统发育树显示,6个根结线虫群体无核苷酸差异,与多个北方根结线虫聚为一支且有较高的置信度。利用特异性引物Mh-F/Mh-R扩增得到北方根结线虫的特异性片段,大小为462 bp。故综合形态学和分子生物学特征,将危害甘肃省党参的根结线虫鉴定为北方根结线虫。
关键词 党参;北方根结线虫;鉴定;发生
中图分类号: S435.67
文献标识码: A
DOI: 10.16688/j.zwbh.2021203
Abstract In order to clarify the occurrence, distribution and species of the root-knot nematode disease of Codonopsis pilosula in Gansu, China, the disease incidence in the field of C.pilosula was surveyed in main growing areas of Gansu province, and the species was identified using morphological and molecular biological methods. The results showed that root-knot nematode disease occurred in six main growing areas of C.pilosula. It was found that 40.7% of fields and 13.2% of plants were infected, and the disease index was 10.4. Based on morphometrics of nematodes and perineal patterns of females, the nematodes were identified as Meloidogyne hapla Chitwood, 1949. Sequence alignment of rDNA-ITS and 28S rDNA D2D3 and phylogenetic analysis revealed that there was no difference in nucleotide among six populations of root-knot nematodes on C.pilosula, which clustered with M.hapla with high confidence. Moreover, a specific fragment of 462 bp in size was obtained from the tested samples using the specific primers Mh-F/Mh-R. Therefore, the root-knot nematode infecting C.pilosula in Gansu was identified as M.hapla by using morphological and molecular methods.
Key words Codonopsis pilosula;Meloidogyne hapla;identification;occurrence
黨参Codonopsis pilosula (Franch.) Nannf.为桔梗科党参属植物[1],是中国传统名贵中药材。其味甘、性平,临床上常用于补中益气、止渴、健脾益肺和养血生津[2]。甘肃省是我国党参的主产区,有“千年药乡”之称[3],据统计,党参种植面积约为4.22万 hm2,总产量达10 250万 kg,居于全国前列[4]。甘肃省因其独特的地理条件,所产党参主根肥大粗壮、肉质甜味重香气浓,销往东南沿海各大城市,广受欢迎[5]。近年来,党参市场需求量增加,种植面积也不断扩大,党参病害日益严重,常见病害有根腐病、锈病、紫纹羽病、白粉病和霜霉病[4],但对党参线虫病报道较少。
根结线虫(root-knot nematode, RKN)隶属于垫刃目Tylenchida异皮科Heteroderidae根结线虫属Meloidogyne[6]。其分布广泛,适应性强,寄主多样,常造成严重的经济损失[7]。迄今为止,国内外已经报道的根结线虫有100多种[8-9],广泛寄生于粮食作物、经济作物、蔬菜、果树、观赏植物和杂草[10]。其中,对经济有重大影响的种类有南方根结线虫M.incognita、花生根结线虫M.arenaria、爪哇根结线虫M.javanica和北方根结线虫M.hapla等4种[11]。北方根结线虫是冷凉地区植物的重要根结线虫种类,主要分布在北纬34°到43°[12],能侵染甘草Glycyrrhiza uralensis、薄荷Mentha canadensis、当归Angelica sinensis、白芷Angelica dahurica和桔梗Platycodon grandiflorus等60多种药材[13],造成主根生长受阻,植株须根增多,呈须根团,严重影响药材质量。甘肃省定西市和陇南市宕昌县地处北纬34°到36°之间,气候凉爽阴湿,且大面积种植党参、当归和黄芪等中药材。
2020年,我们在甘肃省渭源县党参上首次发现北方根结线虫[14],本试验拟对甘肃省党参主产区根结线虫病进行调查,以探明该线虫病的发生和分布情况,同时鉴定根结线虫种类,为该地区党参根结线虫病防治提供理论依据。
1 材料与方法
1.1 材料
供试样品:2020年9月-11月,采用田间随机取样法对甘肃省党参种植区进行系统调查,采集党参病株,同时收集病株根际土壤约500 g,共179份样品,装入自封袋中,带回实验室备用。
LB固体培养基:酵母提取物10 g、胰蛋白胨10 g、NaCl 5 g、琼脂粉15 g,加蒸馏水定容至1 L,121℃高压灭菌25 min,冷却至50℃加入100 mg/mL氨苄青霉素1 mL,倒入培养皿中凝固后备用。
试剂:琼脂糖,广州赛国生物科技有限公司;2×Taq PCR Master Mix、蛋白酶K、DL2000 DNA Marker、氨苄青霉素,生工生物工程(上海)股份有限公司;线虫裂解液(10 mmol/L Tris HCl,50 mmol/L KCl,2.5 mmol/L MgCl2,0.45%NP40,0.45%Tween20,pH 8.3)、pMDTM18-T载体、大肠杆菌Escherichia coli DH5α感受态细胞,宝日医生物技术有限公司;DNA凝胶回收试剂盒、核酸染料,北京擎科生物科技有限公司;其他试剂均为国产分析纯。
仪器:OLYMPUS SZX16体视显微镜,日本奥林巴斯公司;HPX-Ⅱ-80培养箱,上海跃进医疗器械有限公司;Axio Lab.A1显微镜,德国Carl Zeiss公司;T100PCR仪,美国Bio-Rad 公司;DYY-5型稳压稳流电泳仪,北京六一仪器厂;Essential V6凝胶成像分析系统,英国UVITEC公司。
1.2 方法
1.2.1 党参根结线虫病发生情况调查
调查地点为甘肃省党参主产区,调查品种为‘白条党’,调查时间为2020年9月-11月。调查时记录经纬度、海拔、生境和前茬作物等信息,带回实验室进一步分离鉴定并统计病田率、病株率和病情指数。
参照刘纪霜等[15]和张锋等[16]的分级标准统计党参根结线虫病发生情况。0级:所有须根都无根结;1级:只有少数须根有根结, 根结数在10个以下,根结百分率小于10%;2级:大部分须根有根结,根结数10~50个,根结百分率11%~25%;3级:须根有较多根结,根结百分率为26%~50%;4级:须根有许多串珠状根结,根结百分率为51%~75%;5级:根结互相连接成须根团,根结百分率为76%~100%。
病田率=发病田数/调查总田数×100%;
病株率= 发病株数/调查总株数×100%;
病情指数=∑(各病级植株数×病级值)调查总株数×最高病级值×100。
1.2.2 根结线虫的分离和形态学鉴定
1.2.2.1 雌虫的分离和形态观察
将洗净的党参病株根系置于体视显微镜下,用解剖刀将根结表皮轻轻剖开,可见乳白色的球状物即为根结线虫雌虫,用毛刷或软镊子夹出,4℃保存备用。
将收集到的雌虫置于盛有0.9%NaCl溶液的载玻片上,观察形态特征并拍照。每个样本挑取20头,参照谢辉[17]的方法测量形态值。拍照后的雌虫用于会阴花纹的制作。
会阴花纹的制作:将雌虫置于盛有一滴45%乳酸的载玻片上,先用解剖刀将雌虫颈部切去,轻轻挤压虫体使内含物排出,将含有会阴花纹的虫体后部切下。用特制的毛针清理会阴部角质层,将其转移到另一滴纯甘油中,用毛针拨正铺平,盖上盖玻片,用指甲油封固,进行形态观察并拍照。
1.2.2.2 2龄幼虫的分离和形态观察
參照杨艳梅等的方法[18],将卵块置于盛有一滴蒸馏水的培养皿中,(28±1)℃恒温培养箱中孵化2~3 d,得到大量2龄幼虫。
每个样本挑取20条2龄幼虫,置于盛有一滴蒸馏水的载玻片上。用酒精灯外焰加热,每隔2~3 s在显微镜下观察虫体,若虫体突然伸直,表明线虫死亡。将死亡的线虫置于载玻片上进行形态观察并拍照,参照谢辉[17]的方法测量形态值。
1.2.3 分子生物学鉴定
1.2.3.1 线虫DNA的提取
线虫DNA的提取参照王江岭等[19]和王曦茁等[20]的方法并稍作改进:将卵块中孵化的单条2龄幼虫挑至ddH2O中清洗2~3次,随后转移到含有10 μL线虫裂解液的PCR管中。用灭菌解剖刀将线虫切成数节,短暂离心后,加入1 mg/mL的蛋白酶K 1 μL,置于PCR仪中,65℃1 h,95℃10 min,得到线虫DNA粗提取液。
1.2.3.2 目的片段的PCR扩增
采用线虫rDNA-ITS通用引物TW81/AB28[21]、28S rDNA D2D3区段通用引物D2A/D3B[22]及北方根结线虫的特异性引物Mh-F/Mh-R[23]进行PCR扩增。引物委托生工生物工程(上海)股份有限公司合成,引物序列如表1所示。
PCR反应体系:DNA模板3 μL,2×Taq PCR Master Mix 12.5 μL,10 μmol/L上、下游引物各1 μL,ddH2O补足到25 μL。
PCR程序:95℃预变性3 min;95℃变性30 s,退火温度(表1)退火30 s,72℃延伸1 min,34个循环;72℃延伸10 min,4℃保存。
取扩增产物5 μL经1.2%的琼脂糖凝胶电泳检测,最后在凝胶成像分析系统中观察并拍照。
1.2.3.3 扩增产物的测序及数据分析
参照DNA凝胶回收试剂盒说明书,回收该根结线虫rDNA-ITS序列和28S rDNA D2D3区段序列的扩增产物,将回收后的产物与pMDTM18-T载体连接,连接产物转化至大肠杆菌DH5α感受态细胞中,均匀涂布于LB固体培养基上,用无菌牙签挑取单克隆进行菌落PCR鉴定,最后委托北京擎科生物科技有限公司双向测序。采用Clustal W对所得的序列和近源种的序列进行比对分析,用Gblock 0.91b 选择保守区域,并用MeModeltest vesion 2.3进行核苷酸替换模型的选择,最后用MrBayes构建系统发育树。以大豆孢囊线虫Heterodera glycines(登录号KY964273)和禾谷孢囊线虫Heterodera avenae(登录号KY468873)为ITS系统发育树外群,以禾谷孢囊线虫Heterodera avenae(登录号为KX573052和LT159825)为28S rDNA D2D3区段序列系统发育树外群。
2 结果与分析
2.1 甘肃省党参主产区根结线虫病的发生与分布
如表2所示,党参主产区定西市临洮县、渭源县、漳县、陇西县、岷县和陇南市宕昌县均发生党参根结线虫病,平均病田率为40.7%,病株率为13.2%,病情指数为10.4。
其中岷县的病田率和病株率均最高,分别为62.3%和21.2%,其次为临洮县,陇西县病田率和病株率最低,分别为23.0%和5.7%。病情指数以临洮县最高,为29.8,其次为岷县,为12.7,陇西县最低,为3.2。
2.2 党参根结线虫病症状
党参感染根结线虫后,地上部表现为植株矮小黄化,生长缓慢,类似肥水不足。在田间,发黄的病株常呈现块状分布,严重时全田可发病,植株死亡(图1a)。病株地上部整体呈簇状,生长受到抑制。地下部症状明显,初期幼根根尖膨大,逐渐变成小米粒大小不规则的瘤状物,初期乳白色,表面光滑,后期变深褐色。生长后期党参根部主要表现为主根弱化,须根增多,大量的根结连接成须根团(图1c~d),刨开根结可见针头大乳白色的雌成虫。
2.3 党参根结线虫形态学特征
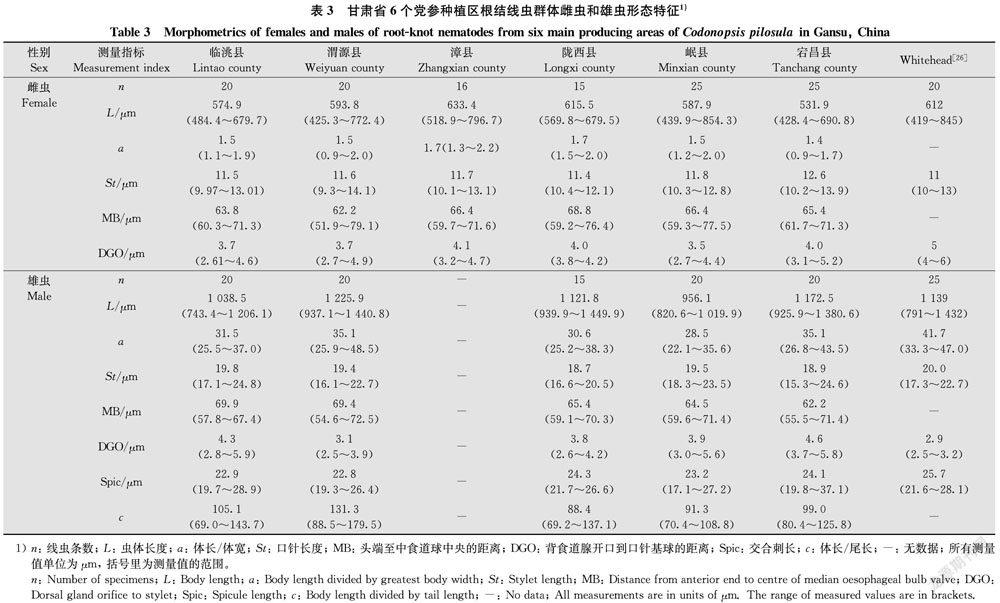
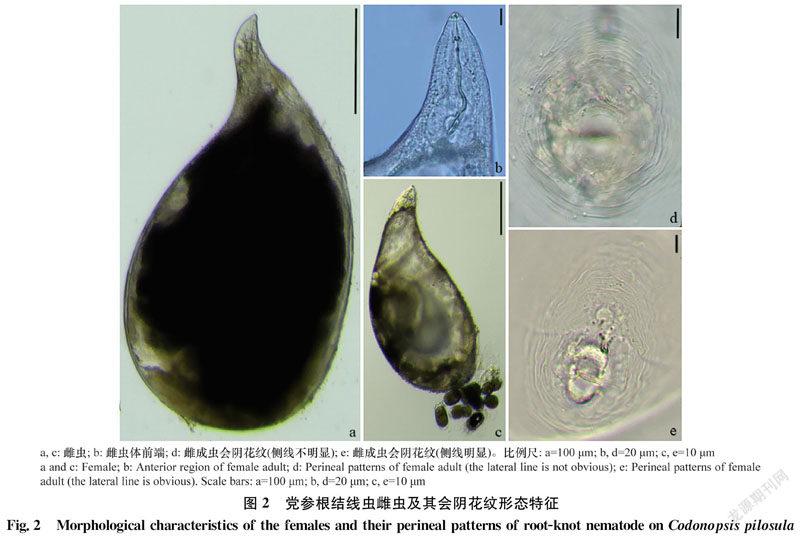
党参上分离到的根结线虫雌虫形态测量值见表3。雌虫虫体为柠檬形或梨形(图2a,c),乳白色,平均体长531.9~633.4 μm,体宽364.3~397.0 μm,虫体前端突出如颈,后端呈圆球形。口针强壮(图2b),长11.4~12.6 μm,背食道腺开口到口针基部球的距离3.5~4.0 μm。中食道球发达,近圆形,头端到中食道球中央的距离62.2~68.8 μm。雌虫会阴花纹整体呈卵圆形,背弓略平缓,有些群体刻线明显,有些不明显(图2d),肛门处有刻点。所观察的线虫群体会阴花纹特征与北方根结线虫的一致。
分离到的根结线虫雄虫形态测量值见表3。雄虫虫体蠕虫形(图3a),体长956.1~1 225.9 μm,口针粗壮(图3b),长18.7~19.8 μm,背食道腺开口到口针基部球的距离3.1~4.6 μm。尾部钝圆,杀死后稍向腹面弯曲,交合刺成对,针状,长22.8~24.3 μm (图3c)。
分离到的根结线虫2龄幼虫形态测量值见表4。虫体细长,两端稍尖细(图3d),长367.1~383.1 μm,体宽15.0~16.2 μm,唇区无明显缢缩,口针发达(图3e),长10.2~11.1 μm,口针基部球明显,呈圆形,宽1.5~1.8 μm,高1.2~1.4 μm。背食道腺开口到口针基部球的距离2.8~3.2 μm,中食道球长10.5~11.2 μm,中食道球宽7.5~8.3 μm,排泄孔至頭端的距离64.9~67.9 μm。尾部形态多变,尾长39.0~45.5 μm,尾部透明区清晰,这些形态特征均与北方根结线虫的相符。
2.4 分子生物学特征
利用通用引物TW81和AB28扩增得到rDNA-ITS片段,6个群体的片段大小均为557 bp,序列一致性为100%。Blastn比对结果显示,6个根结线虫群体rDNA-ITS序列(GenBank登录号MW690027-MW690032)与北方根结线虫(GenBank登录号MT490918、MN752202等)一致性为99.46%~100.00%。基于GTR+I+G模型构建的系统发育树显示,6个根结线虫均聚在一起,置信度为58%,且与上述13个北方根结线虫序列聚为一大支,置信度为94%,与其他16个根结线虫序列可明显区分开(图4)。
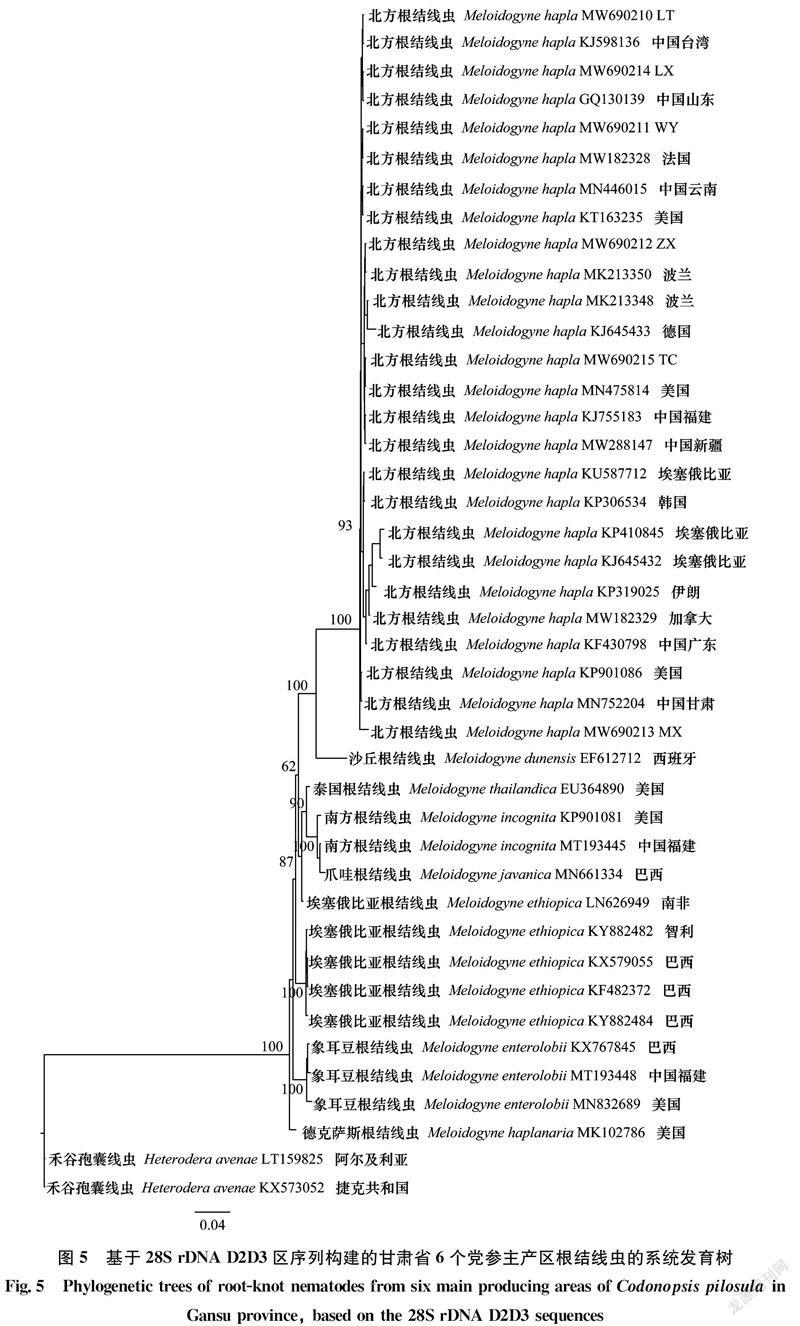
利用通用引物D2A和D3B扩增得到28S rDNA D2D3区段,6个群体的片段大小均为762 bp。Blastn比对结果显示,这6个根结线虫群体序列(GenBank登录号MW690210-MW690215)与北方根结线虫(GenBank登录号MK213348、KJ645233等)一致性为99.60%~100.00%。基于GTR+I+G模型构建6个地区党参根结线虫28S系统发育树显示,该根结线虫28S rDNA D2D3序列与上述21个北方根结线虫序列聚为一支,置信度达100%,与14个其他根结线虫序列可明显区分开(图5)。
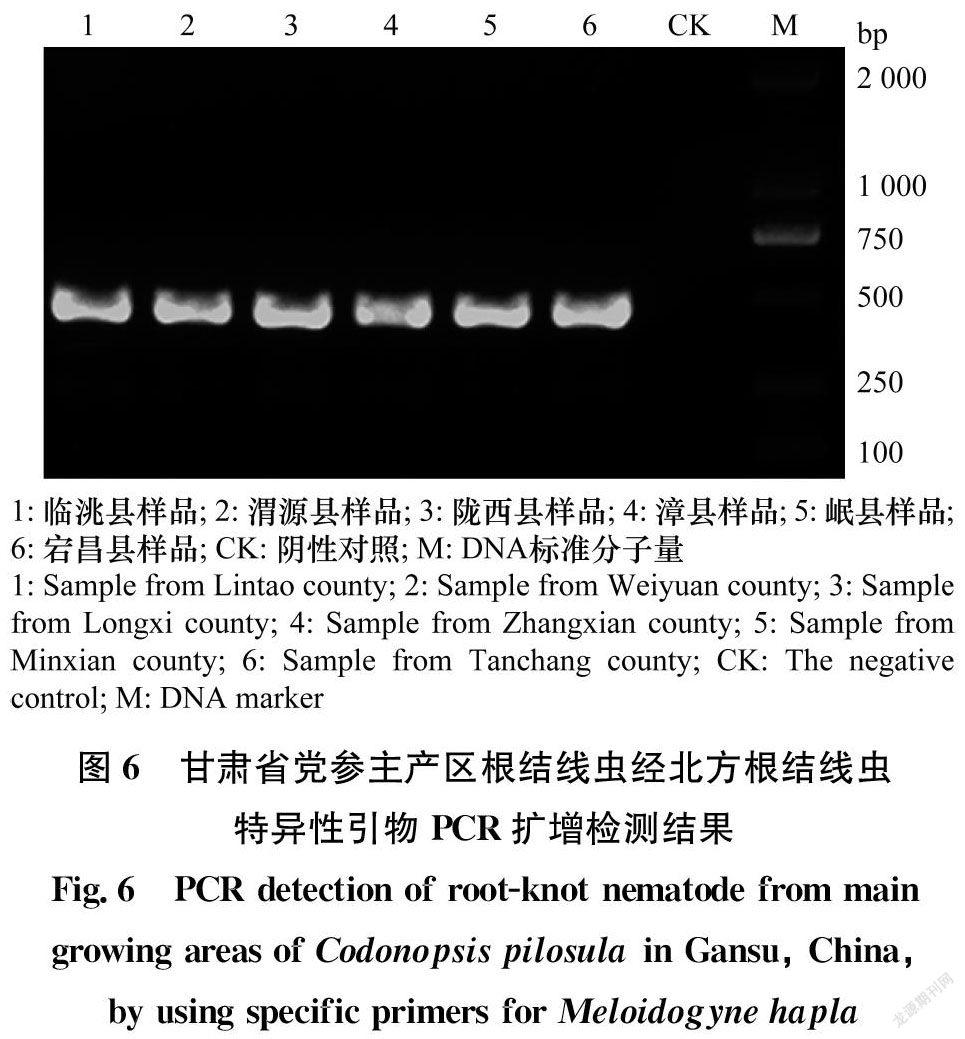
利用北方根结线虫特异性引物Mh-F/Mh-R扩增均得到大小为462 bp的特异性片段(图6),而对照样品没有扩增到条带。综上所述,形态学特征结合rDNA-ITS序列、28S rDNA D2D3区序列和北方根结线虫特异性片段扩增结果,将上述6个党参根结线虫群体均鉴定为北方根结线虫Meloidogyne hapla Chitwood, 1949。
3 讨论
党参作为经济价值较高的药材,近年来在甘肃省种植面积逐年扩大[24],但随着市场需求量的增加,党参田连作现象愈加严重,加重了土传病害的发生。2020年,本课题组在定西市渭源县部分党参植株上发现根结线虫病[14],但未对甘肃省其他种植区进行详细的调查。基于此,本试验对甘肃省6个党参种植区进行系统调查,结果显示,甘肃省6个党参种植区均发现根结线虫病,其中定西市岷县最为严重,病田率和病株率分别为62.3%和21.2%,病情指数为12.7。其次为临洮县、宕昌县、漳县和渭源县,陇西县发病最轻。
根结线虫的鉴定通常采用形态学特征和分子生物学特征相结合的方法。雌虫会阴花纹是根结线虫重要的形态学鉴别特征[25],本试验收集了甘肃省不同地区党参根结线虫雌成虫的会阴花纹,发现其背弓缓,侧线在部分群体中不存在,肛门处有刻点,这与杨艳梅等[18]在云南紫茎泽兰上发现的北方根结线虫雌虫会阴花纹形状相似。除2龄幼虫中食道球到头端的距离偏大外,本研究6个地区雌雄虫和2龄幼虫其他测量值均与Whitehead[26]所描述的北方根结线虫测量值基本相符。本试验发现党参根结线虫2龄幼虫尾部存在多种不同的形态,尾尖常出现不规则的形状,与简恒等描述结果一致[27]。综上,将甘肃省党参种植区的党参根结线虫初步鉴定为北方根结线虫Meloidogyne hapla。由于根结线虫近缘种形态差异较小且测量值重叠,根结线虫雌虫的会阴花纹存在一定程度的种内变异[28-29],故很难单独依靠形态准确鉴定种类,因此,还需结合分子生物学的方法进行准确鉴定。本试验扩增了6个党参种植区根结线虫rDNA-ITS和28S rDNA D2D3区序列并构建系统发育树,结果显示:6个根结线虫群体的序列均无核苷酸差异,且与江苏、新疆、云南北方根结线虫群体有较高的相似性。特异性扩增与冯光泉等[23]结果一致,说明甘肃省党参主产区根结线虫种类单一,均为北方根结线虫。
北方根结线虫最早由Cunningham[30]在长岛的马铃薯上发现,后经Chitwood描述并命名[31]。在我国,该线虫最先由杨宝君[32]在北京月季、葡萄上发现,随后在全国17个省市均有发现。甘肃省是北方根结线虫新分布区,党参是其新寄主,且党参种植区因其独特的地理和气候条件,适合北方根结线虫生长发育,有逐步扩大加重的趋势。定西市岷县和陇南市部分乡镇为甘肃省主要的党参育苗基地,其他各县区党参苗多从这两地输出,而调查发现该地区党参根结线虫病发病最为严重,这将非常有利于党参根结线虫病在其他主产区传播,因此,急需引起当地主管部门的重视,并采取相应的防治措施阻断其传播蔓延。
甘肃省地理位置特殊,气候复杂,适合多种中药材生长[33],除党参外,还种植黄芪、当归、柴胡、独活、黄芩、防风和甘草等中药材[24]。赵来顺等[13]发现北方根结线虫可寄生豆科、伞形科和唇形科等多种中药材,因此,应警惕该地区除党参外其他中药材受北方根结线虫的危害。另外,马铃薯是北方根结线虫的模式寄主,而该地区是我国重要的马铃薯种植基地,且中药材常与马铃薯倒茬轮作,因此,在甘肃省中南部,北方根结线虫在党参上的侵染规律和对党参产量的影响,以及对马铃薯和其他中药材的危害情况均有待进一步研究。
参考文献
[1] 焦红军. 党参的药理作用及其临床应用[J]. 临床医学, 2005(4): 89-92.
[2] 樊长征,洪巧瑜. 党参对人体各系统作用的现代药理研究进展[J]. 中国医药导报, 2016, 13(10): 39-43.
[3] 李成义,刘书斌,李硕,等. 甘肃党参栽培现状调查分析[J]. 中国现代中药, 2016, 18(1): 102-105.
[4] 张玲. 甘草黄芪党参在甘肃的气候适应性及种植区域评述[J]. 甘肃农业科技, 2020(5): 50-55.
[5] 蔺海明. 甘肃省中药材产业现状与发展取向[J]. 中国现代中药, 2011, 13(6): 16-19.
[6] 段玉玺. 植物线虫学[M]. 北京: 科学出版社, 2011.
[7] 宫远福. 东北地区根结线虫的种类分布及南方根结线虫氯离子通道基因分析[D]. 沈阳:沈阳农业大学, 2020.
[8] 章淑玲,欧高政,陈美玲. 甘薯根结线虫病病原—象耳豆根结线虫的鉴定[J]. 福建农林大学学报(自然科学版). 2021, 50(1): 23-28.
[9] JONE J T, HAEGEMAN A D, DANCHIN E G J.et al. Top 10 plant-parasitic nematode in molecular plant pathology [J]. Molecular Plant Pathology, 2013,14(9): 946-961.
[10]刘维志. 植物病原线虫学[M]. 北京:中国农业出版社, 1988.
[11]冯志新. 植物线虫学[M]. 北京:中国农业出版社, 2001.
[12]吴晓晶. 北方根结线虫对温度和无机化合物适应性研究[D]. 沈阳:沈阳农业大学, 2020.
[13]赵来顺,杨彦杰. 北方根结线虫中草药寄主初步调查[J]. 植物病理学报, 1990, 20(2): 81-82.
[14]LI Wenhao, LI Huixia, LIU Yonggang, et al. First report of north root-knot nematode Meloidogyne hapla on Codonopsis pilosula in China [J]. Plant Disease, 2020, 104(8): 2295-2296.
[15]刘纪霜,黄金玲,张正淳,等. 罗汉果根结线虫病田间发病情况调查及病原鉴定[J]. 广东农业科学, 2011, 38(24): 66-68.
[16]张锋,张彦龙,洪波,等. 陕西设施蔬菜根结线虫的种类鉴定及分布[J]. 西北农业学报, 2011, 20(12): 178-182.
[17]谢辉. 植物线虫分类学[M]. 2版. 北京: 高等教育出版社, 2005.
[18]杨艳梅,刘沛,董涵,等. 云南省紫茎泽兰根结线虫病病原种类鉴定[J]. 植物保护学报, 2020, 47(3): 657-665.
[19]王江嶺,张建成,顾建锋. 单条线虫DNA提取方法[J]. 植物检疫, 2011, 25(2): 32-35.
[20]王曦茁,汪来发,杨佐忠,等. 四川省茂县花椒根结线虫病病原鉴定[J]. 植物保护, 2014, 40(4): 84-88.
[21]SUBBOTIN S A, WAEYENBERGE L, MOENS M. Identification of cyst forming nematodes of the genus Heterodera (Nematoda: Heteroderidae) based on the ribosomal DNA-RFLP [J]. Nematology, 2000, 2(2): 153-164.
[22]TIAN Zhongling, MARIA M, BARSALOTE E M.et al. Morphological and molecular characterization of the rice root-knot nematode, Meloidogyne graminicola, Golden and Birchfeild, 1965 occurring in Zhejiang, China [J]. 农业科学学报, 2018, 17(12): 2724-2733.
[23]冯光泉,董丽英,陈昱君,等. 三七病原根结线虫的分子鉴定[J]. 西南农业学报, 2008(1): 100-102.
[24]张艳. 甘肃省中药材产业发展现状、存在问题与建议[J]. 农业科技与信息, 2017(22): 6-7.
[25]赵鸿,彭德良,朱建兰. 根结线虫的研究现状[J]. 植物保护, 2003, 29(6): 6-9.
[26]WHITEHEAD A G. Taxonomy of Meloidogyne (Nematodea: Heteroderidae) with descriptions of four new species [J]. The Transactions of the Zoological Society of London, 1968, 31: 263-401.
[27]简恒. 植物线虫学[M]. 1版. 北京: 中国农业大学出版社, 2011.
[28]TAYLOR A L, SASSER J N. 植物根结线虫[M]. 杨宝君,曾大鹏 译. 北京: 科学出版社, 1983.
[29]GOMES A C M M, ALMEIDA M, CORREA V R.et al. Meloidogyne luci n.sp. (Nematoda: Meloidogynidae), a root-knot nematode parasitising different crops in Brazil, Chile and Iran [J]. Nematology, 2014, 16(3): 289-301.
[30]CUNNINGHAM H S. The root-knot nematode (Heterodera marioni) in relation to the potato industry on Long Island [J]. Agricultural Experiment Station, 1936: Bulletin No.667.
[31]CHITWOOD B G. ‘Root-knot nematodes’. Part 1. A revision of the genus Meloidogyne Goeldi, 1887 [J]. Proceedings of the Helminthological Society of Washington,1949, 2: 90-114.
[32]楊宝君. 十五种根结线虫病害的病原鉴定[J]. 植物病理学报, 1984, 14(2): 107-112.
[33]何晋武,祁永安,石利兵. 甘肃省中药材产业发展现状及对策研究[J]. 中国农业资源与区划, 2011, 32(5): 60-64.
(责任编辑:杨明丽)

