基于傅里叶变换红外光谱技术分析壬基酚和双酚A对斑马鱼胚胎的影响
刘芳,田斐,史文俊
1. 华南师范大学地理科学学院,广州 510631 2. 中国水产科学研究院南海水产研究所,广东省渔业生态环境重点实验室,农业农村部南海渔业资源环境科学观测实验站,广东珠江口生态系统野外科学观测研究站,广州510300 3. 中国科学院广州地球化学研究所,广州 510640 4. 华南师范大学环境研究院广东省化学污染与环境安全重点实验室,华南师范大学环境理论化学教育部重点实验室,广州510006
环境激素(environmental hormone, EH),又称“环境内分泌干扰物(environmental endocrine disruptors, EEDs)”,是一类通过干扰人和动物体内激素的合成、释放、转运、代谢、与受体结合、功能表达等一系列生物过程,从而影响有机体稳定性的保持、生殖、发育或者行为的外源物质[1]。环境激素可导致生物体生殖功能下降[2]、生殖器官异常[3]、免疫力降低[4]、神经系统功能障碍[5]和癌症[6]等症状。环境激素大多数是化学性质稳定的脂溶性化合物,极易经食物链富集进入人体,生物半衰期较长且在人体内没有特定的代谢系统,导致在人体内富集并长期缓慢地发挥作用,对人类及整个生态系统造成潜在的危害。
近几十年来,随着我国经济高速发展和城市化规模迅猛扩张,大量化学物质被应用于工农业生产当中[7],其中大部分化学物质最终通过各种途径汇入水环境中,对水生态系统造成危害[8]。壬基酚(nonylphenol, 4-NP)和双酚A(bisphenol A, BPA)是2种在环境中普遍检出的雌激素物质。例如,在我国北京污水处理厂进水中4-NP平均浓度为19.26 μg·L-1,最高达到了25.75 μg·L-1,出水4-NP平均浓度为4.57 μg·L-1,最高达到了7.93 μg·L-1,污水处理厂对4-NP去除率可达到75.3%[9]。类似地,在我国北京污水处理厂中BPA是含量最大的化合物,进水最高浓度为1.574 μg·L-1,出水总平均浓度为0.049 μg·L-1,去除率可达96%以上[10]。此外,在我国烟台污水处理厂出水中4-NP最高浓度达到了0.662 μg·L-1;BPA最高为0.195 μg·L-1,该研究发现污水处理厂附近河流中的4-NP和BPA的浓度甚至比污水处理厂中最高浓度还要高,分别达到了1.946 μg·L-1和1.772 μg·L-1[11]。这也不难理解4-NP和BPA在地表水中的频繁检出。研究发现4-NP在美国30个州139条河流中最高浓度达到了40 μg·L-1[12]。在西班牙,4-NP在地表水中浓度最高达到了644 μg·L-1[13]。在我国太湖流域,4-NP的检出浓度最高也达到了208 μg·L-1[14]。此外,在我国太原工业地区地下水中4-NP浓度最高为151 μg·L-1[15]。类似地,BPA在工业发达地区地表水浓度显著高于其他地区。例如,在我国黄浦江和珍珠河口地区,BPA浓度高达4 μg·L-1[16-17],珠江口BPA最高浓度为3.92 μg·L-1[16,18]。在美国BPA地表水最高浓度为12 μg·L-1[19]。由于4-NP和BPA具有较强的雌激素活性,对水体中生物具有潜在的生态风险。
傅里叶变换红外光谱(FTIR)作为一种基于化合物中官能团和极性键振动的结构分析技术,已广泛应用于大分子化合物结构分析以及蛋白质的二级结构解析[20-21],是获取分子结构信息的有力工具,被广泛应用于临床医学、药学、化工化学、环境分析和材料学等领域。近年来,FTIR技术被运用到毒理学研究中。Henczová等[22-23]利用FTIR技术研究了重金属铜、镉和铅对不同鱼类的毒性效应。Cakmak等[24]利用FTIR技术研究发现17β-雌二醇显著改变了虹鳟鱼肝脏组织的成分、结构以及功能,并认为FTIR技术可以成功解决生态毒理学问题。Llabjani等[25]运用FTIR技术检测低浓度多溴二苯醚(polybrominated diphenyl ether, PBDE)、苯并芘、雌二醇和林丹对靶细胞的生物学效应,研究发现极低剂量的PBDE即可诱导靶细胞的生物学改变,其诱导靶细胞发生的生物学改变主要是脂质、蛋白质二级结构和DNA/RNA构象变化等。此外,Llabjani等[26]还利用FTIR技术研究了PBDE和多氯联苯(polychlorinated biphenyls, PCB)的联合毒性效应,结果表明PBDE和PCB126相互之间可能存在拮抗作用,但PBDE与PCB153联合作用产生的生物学改变比单一物质作用要显著。我们团队前期利用FTIR分析了实验中常用助溶剂对绿藻和浮萍的毒性,结果表明,甲醇和乙醇在很低浓度暴露下,仍然会对浮萍和绿藻的生长及生物大分子产生影响;丙酮在经济合作与发展组织(OECD)建议浓度(0.01%V/V)对浮萍和绿藻的毒性较弱;二甲基亚砜(DMSO)在0.1%V/V浓度下对浮萍的影响也很小。这表明,FTIR可以灵敏地分析实验中常用的助溶剂对生物的毒性[27]。总的说来,近年国内外利用FTIR技术研究污染物的生态毒理效应取得了一定的进展,但尚处起步阶段。因此,本研究利用FTIR技术分析了环境中常见的雌激素物质4-NP和BPA对斑马鱼胚胎的毒性。
1 材料与方法(Materials and methods)
1.1 主要试剂
壬基酚(4-NP,纯度≥98%,Adamas),双酚A(BPA,纯度≥99%,CNW)。实验用其他试剂均为分析纯。4-NP和BPA分别溶于DMSO中配成储液,置于-20 ℃冰柜中保存备用。
1.2 斑马鱼饲养和胚胎收集
成年斑马鱼(Daniorerio)购买于广州市花地湾花鸟鱼虫市场,实验室驯养一个月后,用于本实验。成年斑马鱼饲养在包含有内置循环泵装置的玻璃鱼缸中,鱼缸体积为45 L,每个鱼缸饲养30条雌性和雄性斑马鱼。自来水经过活性炭过滤后,曝气2 d以上方可用于实验。用于暴露的水中氧饱和度>80%,温度和pH分别控制在(26±1) ℃和7~8范围内;光暗周期比为14 h∶10 h。每天早上和下午分别喂食冰冻红虫(chironomid larvae)和丰年虾(Artemiasalina)2次。由于缸内具有循环系统,每周更换一次水。饲养期间,每天及时用虹吸法吸出鱼缸的粪便和残饵,防止斑马鱼生病,确保实验正常进行。
产卵前一天,将3条雌鱼和6条雄鱼放入产卵缸的孵化器内,中间有隔板将雌鱼和雄鱼分开,它们能够通过隔板的缝隙看到对方,但是不能相互靠在一起。孵化器下面的筛板将鱼与缸底隔开,防止鱼提前产卵和吞食鱼卵。将鱼放入孵化器后避光,次日早晨,抽走雌鱼和雄鱼之间的隔板,并给以充足的光照,雌雄斑马鱼会在光照的刺激下互相追逐完成交配产卵等过程,30 min后收集胚胎。将受精卵收集起来,用胚胎培养液冲洗,并在倒置显微镜下观察其发育情况。挑选发育正常且处于囊胚期(受精后2~4 h)的受精卵用于接下来的暴露实验。胚胎培养液配制方法:按照ISO 7346/3标准配制母液(294.0 mg·L-1CaCl2·2H2O,123.3 mg·L-1MgSO4·7H2O,63.0 mg·L-1NaHCO3,5.5 mg·L-1KCl),将母液按体积比为1∶4稀释,通气24 h以上,调节pH值到7.8±0.2,方可使用。
1.3 暴露实验
暴露容器采用玻璃培养皿,每个培养皿加30 mL试液和20颗胚胎。暴露溶液是加了目标化合物的胚胎培养液。斑马鱼胚胎暴露于一系列名义浓度的4-NP和BPA中,同时设置溶剂对照组。处理组浓度设置分别为:200、400、600、800、1 000和1 200 μg·L-14-NP;2、4、6、8、10和12 mg·L-1BPA。目标化合物处理组和溶剂对照组均含有0.01%(V/V)的DMSO助溶剂。每个处理组设置3个平行,因此每个处理组有60个胚胎用于毒性评估。暴露时间为96 hpf (hours post fertilization)。暴露期间,胚胎放入人工气候箱中进行培养,温度保持为(26±1) ℃,光暗周期比为14 h∶10 h。每天在倒置显微镜下观察胚胎的发育情况。根据Nagel[28]的方法,每天记录胚胎的致死、亚致死和致畸情况,如表1所示。
1.4 ATR-FTIR检测及多变量分析
参照我们前期研究[27],暴露结束后,随机取斑马鱼幼鱼(胚胎)放到10%福尔马林(V(甲醛)/V(PBS))中固定,之后放在氟化钡窗片上并置于干燥盒去掉斑马鱼幼鱼(胚胎)的水分,待水分去掉后,将斑马鱼幼鱼(胚胎)放到布鲁克红外光谱仪上进行红外光谱分析。红外光谱采用Bruker Optics公司的Bruker Vector 70傅里叶变换红外光谱仪与衰减全反射(ATR)附件、MCT检测器。测定条件:光谱范围4 000~600 cm-1,分辨率8 cm-1,扫描累加次数64次。扫描时扣除H2O和CO2的干扰,以不放入任何样本的空白扫描作为背景。
在进行多变量分析之前,检测样本获取的红外图谱需进行预处理。首先,运用OPUS软件,分别对ATR-FTIR原始图谱截取细胞生物化学指纹图谱区域段(1 800~900 cm-1),然后根据酰胺酶Ⅰ(1 650 cm-1)对图谱进行基线化校正和标化。原始图谱经预处理后,采用MATLAB R2010a和图标用户界面的工具包进行多变PCA-LDA分析。多变量分析处理结果通过得分图和集群矢量图直观显示。

表1 斑马鱼胚胎及幼鱼在不同时间的异常率的测试终点和评分系统Table 1 Assignment of zebrafish embryo-larval abnormalities scoring and endpoints
1.5 化合物在暴露水溶液中的实际测定浓度
为了测定4-NP和BPA在暴露水中的实际浓度,本研究对溶剂对照组和各处理组进行了化学分析。由于暴露水溶液每天都更新,所以所有处理组的水样只在暴露第1天开始暴露时(0 h)和换水前(24 h)这2个时间点收集进行检测。通过分析2个时间点水样中4-NP和BPA的浓度,来表征它们在暴露期间的变化情况。
4-NP和BPA浓度采用高效液相色谱法分析(HPLC-FLD,Agilent 1200 series,USA),采用Zorbax Eclipse XDB-C18色谱柱(150 mm×4.6 mm,5 μm)。色谱条件如下。4-NP:流动相A乙腈和流动相B水(80∶20,V/V),流速1 mL·min-1,柱温30 ℃,荧光检测器激发波长为230 nm,发射波长为290 nm,进样体积100 μL,PTM-gain为17。BPA:流动相A乙腈和流动相B水(50∶50,V/V),流速1 mL·min-1,柱温30 ℃,荧光检测器激发波长为230,发射波长为290,进样体积20 μL,PTM-gain为18。
1.6 数据分析
斑马鱼胚胎发育毒性,参照文献中的方法[29],用FTI指数来表示,鱼类致畸指数(fish teratogenicity index, FTI)按以下公式来计算:FTI=(Eother×1+Esubl.×2+Elethal×3)/N。式中:FTI表示鱼类致畸指数;Eother表示出现其他效应的胚胎数;Esubl.表示出现亚致死效应的胚胎数;Elethal表示出现致死效应的胚胎数;N表示每个重复所用的胚胎总数。
剂量效应曲线用Origin 8软件拟合得到LC50和EC50。处理组与对照组之间的差异显著性分析由SPSS14.0统计软件完成,在不同的处理组之间采用单因子方差分析(One-way ANOVA)进行差异显著性检验,用Duncan’s法对浓度组与对照组间数据进行差异显著性分析,其中*表示在P<0.05上有显著差异。所有结果表示为平均值±标准误差(Mean±SD)。
2 结果(Results)
2.1 暴露水溶液中4-NP和BPA实测浓度
BPA在暴露开始时(0 h)的实测浓度都非常接近它们的名义浓度,在24 h浓度都稍有降低。另外,4-NP和BPA在溶剂对照组中均没有检测到。4-NP在0 h检测浓度与名义浓度非常接近,但是暴露24 h后,浓度下降了19.9%~28.5%。由于浓度梯度较多,为了便于记录和简洁,在图表中分别以L1、L2、M1、M2、H1、H2代表4-NP和BPA从低到高的实测浓度(表2)。
2.2 4-NP和BPA对斑马鱼早期胚胎形态学发育的影响
不同浓度4-NP和BPA暴露下,斑马鱼胚胎的96 hpf存活率、72 hpf孵化率以及FTI指数如图1所示。结果显示,暴露96 h后,当4-NP≥332 μg·L-1时,斑马鱼胚胎的存活率显著下降(P<0.05),且随着暴露浓度的增加,存活率逐渐降低。849.5 μg·L-1和1 038.5 μg·L-14-NP暴露后,斑马鱼胚胎全部死亡。以胚胎死亡率作为效应终点,4-NP对斑马鱼胚胎的96 h-LC50为481.7 μg·L-1。当4-NP≥332μg·L-1时,均显著降低斑马鱼胚胎72 hpf孵化率(P<0.05);同时,斑马鱼胚胎72 hpf孵化率分别只有33%、5%、0%、0%和0%。4-NP≥332 μg·L-15个处理组中FTI指数显著高于对照组(P<0.05),且随着暴露浓度的增加,FTI指数增加。以FTI指数作为效应终点,4-NP对斑马鱼胚胎的96 h-EC50为362.6 μg·L-1。
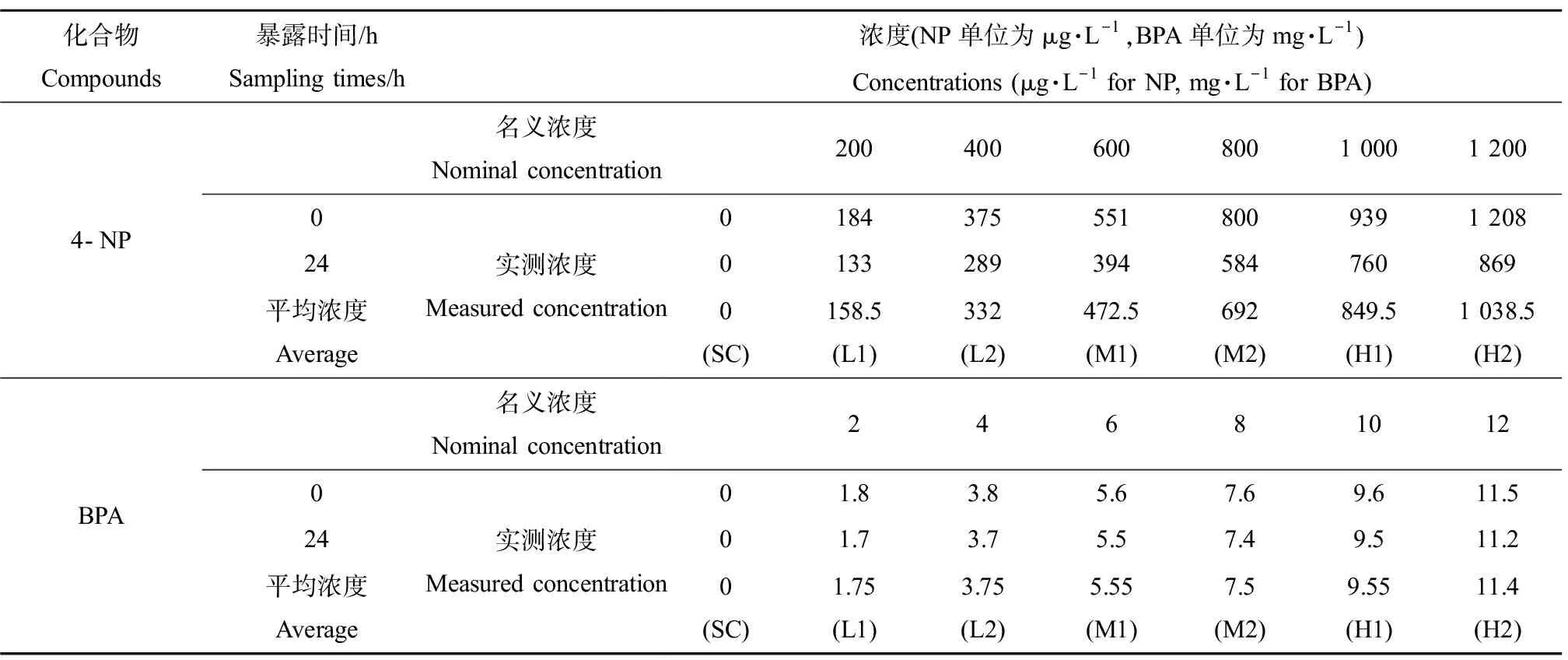
表2 壬基酚(4-NP)和双酚A(BPA)在暴露实验中名义浓度和实测浓度Table 2 The nominal and measured concentrations of nonylphenol and bisphenol A in the exposure experiment
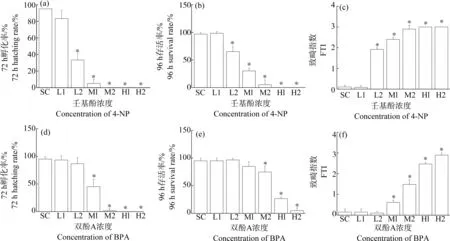
图1 4-NP和BPA对斑马鱼胚胎形态发育的影响注:FTI表示鱼类致畸指数,SC表示溶剂对照;4-NP实测浓度中,L1, 158.5 μg·L-1; L2, 332 μg·L-1; M1, 472.5 μg·L-1; M2, 692 μg·L-1; H1, 849.5 μg·L-1; H2, 1 038.5 μg·L-1;BPA实测浓度中,L1, 1.75 mg·L-1; L2, 3.75 mg·L-1; M1, 5.55 mg·L-1; M2, 7.5 mg·L-1; H1, 9.55 mg·L-1; H2, 11.4 mg·L-1;*表示P<0.05。Fig. 1 Effects of 4-NP and BPA on morphological development of zebrafish embryosNote: FTI means fish teratogenicity index; SC means solution control; for the measured concentrations of 4-NP, L1, 158.5 μg·L-1; L2, 332 μg·L-1; M1, 472.5 μg·L-1; M2, 692 μg·L-1; H1, 849.5 μg·L-1; H2, 1 038.5 μg·L-1; for the measured concentrations of BPA, L1, 1.75 mg·L-1; L2, 3.75 mg·L-1; M1, 5.55 mg·L-1; M2, 7.5 mg·L-1; H1, 9.55 mg·L-1; H2, 11.4 mg·L-1; *represents P<0.05.
暴露96 h后,当BPA≥7.5 mg·L-1,斑马鱼胚胎的存活率显著下降(P<0.05),且随着暴露浓度的增加,存活率显著降低。以胚胎死亡率作为效应终点,BPA对斑马鱼胚胎的96 h-LC50为8.8 mg·L-1。BPA≥5.55 mg·L-1处理组中,斑马鱼胚胎72 hpf孵化率显著降低(P<0.05),这4个处理组斑马鱼胚胎72 hpf孵化率分别只有30%、0%、0%和0%;这些处理组中,FTI指数显著高于对照组(P<0.05),且随着暴露浓度的增加,FTI指数增加。以FTI指数作为效应终点,BPA对斑马鱼胚胎的96 h-EC50为7.9 mg·L-1。
2.3 ATR-FTIR分析4-NP和BPA对斑马鱼胚胎的影响
由于4-NP浓度≥692 μg·L-1时,斑马鱼胚胎存活率非常低,导致样品量不足。这里我们利用ATR-FTIR分析了较低浓度4-NP对斑马鱼胚胎的影响。在4-NP处理组中,PCA-LDA一维和二维得分图均显示,处理组与对照组相比差异显著(P<0.05),高浓度的处理组(332 μg·L-1和472.5 μg·L-1)比低浓度处理组(158.5 μg·L-1)区分度更高,差异更显著(P<0.001)(图2(a)~(b))。通过PCA-LDA分析,进一步发现不同处理组斑马鱼胚胎ATR-FTIR图谱组间差异波数(如图2(c)),cluster vector图显示引起组间差异的波数所对应的主要生物标记物如表3所示。当4-NP≥158.5 μg·L-1时,对酰胺Ⅱ、脂质和蛋白磷酸化等波数有显著影响。
在BPA处理组中,PCA-LDA一维和二维得分图均显示,当BPA处理组浓度≥3.75 mg·L-1时,处理组与对照组相比差异显著(P<0.05)(图2(d)~(e))。通过PCA-LDA分析,进一步发现不同处理组斑马鱼胚胎ATR-FTIR图谱组间差异波数(如图2(f)),cluster vector图显示引起组间差异的波数所对应的主要生物标记物如表4所示。当BPA≥1.75 mg·L-1时,对酰胺Ⅰ、酰胺Ⅱ、脂质和碳水化合物等波数有显著影响。
3 讨论(Discussion)
鱼类对污染物暴露特别敏感,尤其是在其生命发育的早期阶段[30]。本研究结果表明,4-NP、BPA暴露均可抑制斑马鱼的早期胚胎发育,且抑制效应随着处理浓度的升高而增强。
孵化率是胚胎发育阶段重要的毒理学指标。前人研究结果显示,4-NP对黑头软口鲦[31]、玫瑰无须鲃[32]、斑马鱼[33]和奥尼罗非鱼[34]的96 h-LC50分别为135、379、960和264.6 μg·L-1。BPA对斑马鱼胚胎的96 h、120 h-LC50分别为13.9 mg·L-1[35]和5 mg·L-1[36]。以96 hpf孵化率作为效应终点,BPA对斑马鱼胚胎EC50为5.25 mg·L-1[37]。本研究显示,随着4-NP和BPA暴露浓度的提高,斑马鱼胚胎的存活率呈下降趋势,个体死亡的数量增加。以斑马鱼胚胎96 hpf死亡率作为效应终点,4-NP和BPA对斑马鱼胚胎的96 h-LC50分别为481.7 μg·L-1和8.8 mg·L-1。对斑马鱼胚胎的毒性强弱顺序为4-NP>BPA。鱼类致畸指数(FTI)被用于表征污染物对鱼类胚胎发育的毒性效应[38]。本研究中,以FTI指数作为效应终点,4-NP和BPA对斑马鱼胚胎的96 h-EC50分别为362.6 μg·L-1和7.9 mg·L-1。以上结果表明,4-NP对斑马鱼的存活和致畸的毒性要远强于BPA。
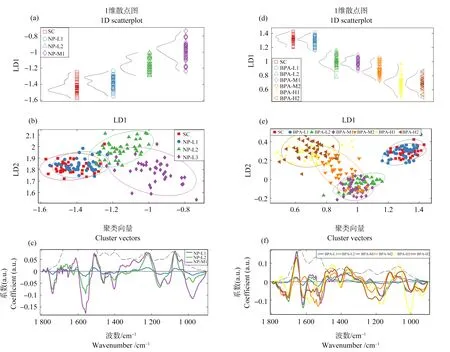
图2 利用傅里叶红外分析4-NP和BPA对斑马鱼胚胎的影响注:SC表示溶剂对照;4-NP实测浓度中,L1, 158.5 μg·L-1; L2, 332 μg·L-1; M1, 472.5 μg·L-1; M2, 692 μg·L-1; H1, 849.5 μg·L-1; H2, 1 038.5 μg·L-1;BPA实测浓度中,L1, 1.75 mg·L-1; L2, 3.75 mg·L-1; M1, 5.55 mg·L-1; M2, 7.5 mg·L-1; H1, 9.55 mg·L-1; H2, 11.4 mg·L-1。Fig. 2 Effects of 4-NP and BPA on zebrafish embryo by using ATR-FTIRNote: SC means solution control; for the measured concentrations of 4-NP, L1, 158.5 μg·L-1; L2, 332 μg·L-1; M1, 472.5 μg·L-1; M2, 692 μg·L-1; H1, 849.5 μg·L-1; H2, 1 038.5 μg·L-1; for the measured concentrations of BPA, L1, 1.75 mg·L-1; L2, 3.75 mg·L-1; M1, 5.55 mg·L-1; M2, 7.5 mg·L-1; H1, 9.55 mg·L-1; H2, 11.4 mg·L-1.
FTIR作为一种基于化合物中官能团和极性键振动的结构分析技术,已广泛应用于大分子化合物结构分析以及蛋白质的二级结构解析[20-21,39],是获取分子结构信息的有力工具,被广泛应用于临床医学、药学、化工化学、环境分析和材料学等领域。本研究运用ATR-FTIR红外光谱以及多变量分析研究不同污染物对斑马鱼胚胎的特征性变化。并运用多变量方法PCA-LDA提取ATR-FTIR光谱的复杂数据进行判别分析。研究结果表明,该方法能够有效鉴别一系列低于引起胚胎形态发育异常的低剂量污染物的剂量-效应关系。以生化指纹区PCA-LDA结果作为效应终点,4-NP和BPA对斑马鱼胚胎的96 h-EC50分别329.2 μg·L-1和7.2 mg·L-1。红外光谱分析技术及多变量分析方法为更好地研究低剂量污染物的生物学效应提供了一种全新的手段,生化指纹区PCA-LDA结果可以作为一个新的效应终点[27]。本研究结果表明,4-NP(158.5、332 μg·L-1和472.5 μg·L-1)暴露斑马鱼胚胎,主要影响了胚胎的脂质(1 739 cm-1)、酰胺Ⅱ(1 511~1 558 cm-1)、DNA/RNA(1 072 cm-1, 1 226 cm-1)以及蛋白磷酸化水平(975 cm-1)。随着暴露浓度的增加,与对照组相比,在~1 740,~1 580,~1 225和~970 cm-1差异程度逐渐增加。Larsen等[40]采用表面增强激光解析电离飞行时间质谱(SELDI-TOF-MS)以及酶联免疫吸附测定(ELISA)方法研究发现,暴露于29 μg·L-14-NP的大西洋鳕鱼和大比目鱼幼鱼体内蛋白质水平发生显著变化。Aravindakshan和Cyr[41]的研究结果表明4-NP可以降低connexin 43蛋白磷酸化水平,从而使细胞间隙连接通讯受到损害。此外,研究发现4-NP可以改变脂质代谢[42],并对生物体产生遗传毒性[43]。本研究结果表明,较低浓度BPA(1.75、3.75和5.55 mg·L-1)暴露斑马鱼胚胎,主要影响了胚胎的蛋白质(1 500~1 680 cm-1)、脂质(1 700~1 740 cm-1)、脂肪酸(1 488 cm-1)、碳水化合物(1 168 cm-1),而较高浓度BPA(8、10和12 mg·L-1)对斑马鱼胚胎产生遗传毒性(1 064 cm-1, 1 226 cm-1)。Larsen等[40]采用SELDI-TOF以及ELISA方法研究发现,暴露于59 μg·L-1BPA的大西洋鳕鱼和大比目鱼幼鱼体内蛋白质水平发生显著变化。BPA可以使前脂肪细胞加速分化为成熟的脂肪细胞,从而导致脂质在细胞内积累[44]。微藻细胞内碳水化合物和脂肪酸的含量随着BPA处理浓度的增加而提高[45]。Park和Choi[43]同样证明BPA对大型溞和摇蚊幼虫产生遗传毒性。
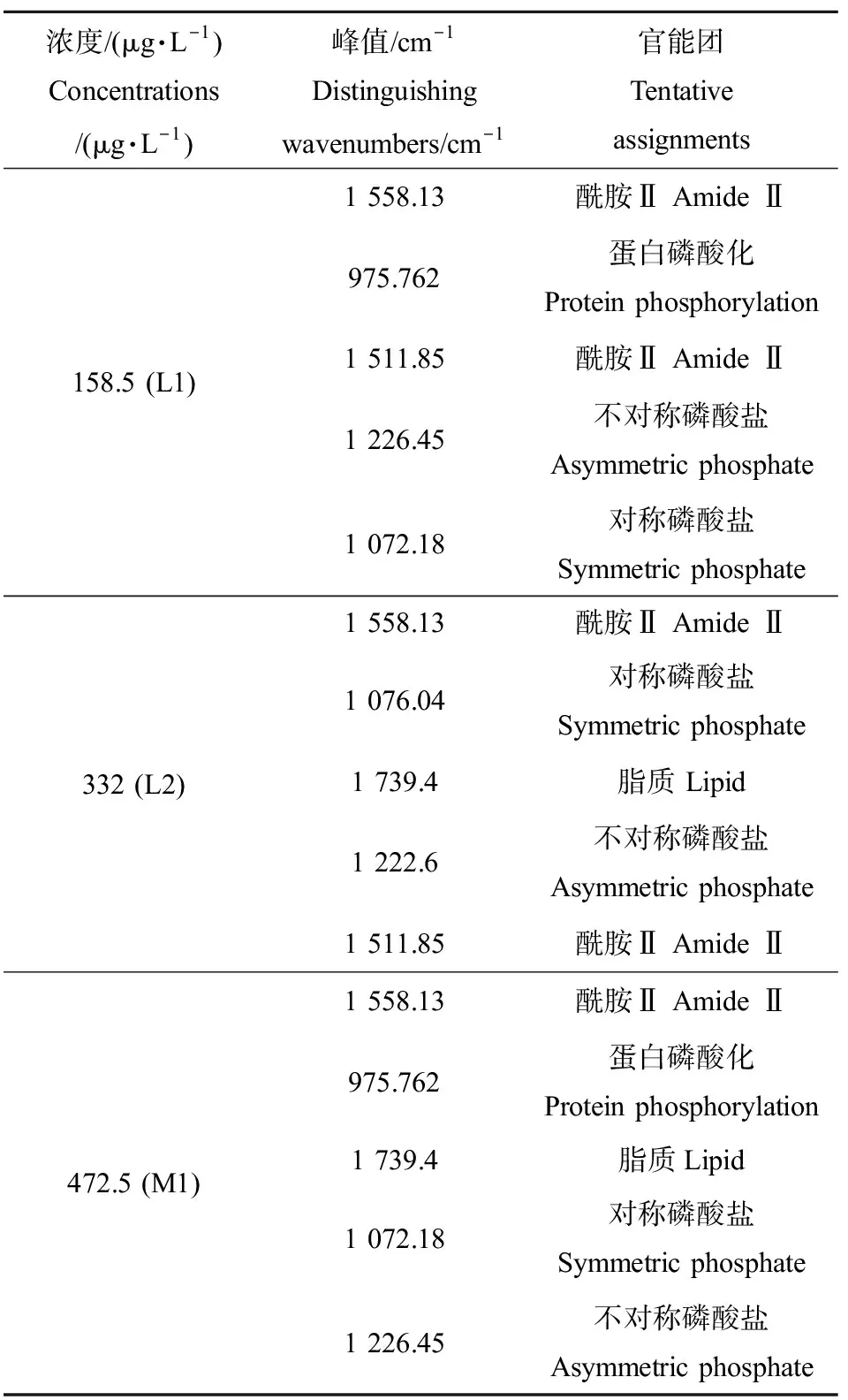
表3 4-NP暴露组中差别最显著的5个峰值及其代表的相关生物分子Table 3 Assignments of top 5 significant peaks in 4-NP treatments

表4 BPA暴露组中差别最显著的5个峰值及其代表的相关生物分子Table 4 Assignments of top 5 significant peaks in BPA treatments
上面结果均表明,4-NP和BPA影响了斑马鱼胚胎脂质代谢相关的波数。脂质对于生物正常的生理功能至关重要,例如人体的新陈代谢能量和激素合成[46]。4-NP和BPA是典型的环境雌激素,可以导致鱼类产生雌激素效应。4-NP和BPA结构类似,均与内源性雌激素雌二醇(estradiol, E2)具有相同的酚羟基结构,能够模拟E2与斑马鱼雌激素受体(estrogen receptor, ER)活性位点结合,从而导致雌激素效应[47-48]。其中,BPA和4-NP分别有2个和1个官能团酚羟基;分子对接结果显示,BPA和4-NP均可与ER中Leu79、Met83、Phe99和Ile119等氨基酸形成的疏水腔结合[48]。有研究通过体外重组酵母方法分析发现,BPA和4-NP均对ER有显著的亲和力[49]。因此,BPA和4-NP对斑马鱼胚胎具有类似的毒性,这与本研究中胚胎发育毒性和生理生化变化相吻合。比如,4-NP和BPA可以影响鱼类类固醇以及胆固醇代谢。类固醇激素和胆固醇是典型的脂质类物质,这可以解释脂质相关的波数在4-NP和BPA处理组中聚集。此外,4-NP和BPA导致了斑马鱼胚胎死亡,前期研究表明4-NP和BPA可以导致细胞凋亡和DNA损伤,这可作为支撑本文中的核酸波数变化的依据。
综上所述,从生理生化和胚胎发育等角度,4-NP和BPA对斑马鱼具有胚胎毒性,同时显著影响了脂质和核酸相关的波数变化。
通讯作者简介:史文俊(1987—),男,博士,副教授,主要研究方向生态毒理学。

