急性髓系白血病患者外周血CD8+T淋巴细胞中MagT1水平监测的临床价值
王晶 向健 胡淑芳 朱艳坤 钟玉钗
武汉市汉口医院1检验科,3内分泌科(武汉 430012);2天门市第一人民医院输血科(湖北天门 431700);4南方医科大学附属东莞医院检验科(广东东莞 523039)
急性髓系白血病(acute myeloid leukemia,AML)是最常见的成人急性白血病,其特征是不成熟髓系前体细胞异常增殖和积聚,导致造血系统破坏[1]。如今,临床治疗AML 的手段有较大改善,包括化疗、造血干细胞移植、分子靶向治疗、输血支持等[2-4]。然而,AML 患者的无事件生存期(EFS)和总生存期(OS)仍难令人满意[5]。因此,发现能够预测AML 患者预后和有效指导AML 治疗的潜在生物标志物至关重要。Mg2+转运蛋白1(MagT1)是Mg2+选择性转运体,可调节细胞内游离Mg2+水平,并介导Mg2+作为第二信使在胞内进行信号传导。研究发现,MagT1 是Mg2+内流刺激T 细胞激活过程中所必须的,为此瞬时提高游离Mg2+浓度,能暂时调控T 细胞活化[6]。LI 等[7]研究显示MagT1可通过调控circ_0002755/miR⁃628⁃5p/MAGT1 轴介导七氟醚对脑胶质瘤细胞转移的抑制作用。另外,MagT1 基因功能缺失突变能引起X⁃连锁免疫缺陷和EB 病毒感染及肿瘤(XMEN)病,且容易发展为EB 病毒相关淋巴瘤[8-9]。以上研究表明,MagT1 可参与胶质瘤以及淋巴瘤等肿瘤的发生和发展。但MagT1 是否参与调控血液系统恶性肿瘤仍不清楚。CD8+T 细胞作为具有抗原特异性的杀伤效应细胞,对自身免疫和抗肿瘤免疫有重要作用。研究发现,MagT1 介导的Mg2+内流障碍能导致CD8+T细胞功能耗竭[10-11]。因此,本研究首次通过检测AML 患者外周血CD8+T 细胞中MagT1 的表达水平,探讨MagT1 诱导的CD8+T 细胞功能耗竭与AML 患者的风险分层及预后的相关性,为后续MagT1在血液系统恶性肿瘤的研究提供临床基础。
1 资料与方法
1.1 病例资料 回顾性分析2014年3月至2018年12月武汉市汉口医院和天门市第一人民医院收治的新发AML 患者。AML 患者的纳入标准:(1)根据形态学、细胞化学、免疫表型等诊断为AML 的患者[12];(2)18 岁以上且低于80 岁的患者;(3)无放化疗或干细胞移植等系统治疗史的患者;(4)定期随访且资料完整的患者。排除标准:(1)急性早幼粒细胞白血病;(2)合并其他血液系统疾病;(3)合并其他器官和系统严重疾病或恶性肿瘤者;(4)人类免疫缺陷病毒(HIV)阳性患者;(5)精神障碍者、怀孕或哺乳期妇女。最终纳入197 例AML 患者为AML 组,其中男108 例,女89 例,年龄23 ~ 76 岁。另选60 例同期在我院进行体检的健康者为健康体检组,男34 例,女26 例,年龄25 ~ 71 岁。两组的性别、年龄差异无统计学意义(P>0.05),具有可比性。本研究经武汉市汉口医院和天门市第一人民医院伦理委员会批准,所有参与者均签署知情同意书。
1.2 仪器与试剂 人淋巴细胞分离液购自北京索莱宝;PE⁃anti⁃human CD279(PD⁃1)、PE/CF594⁃Anti⁃Human Tim⁃3 均购自美国BD 公司;TRIzol 试剂购自美国Invitrogen 公司;兔抗人MagT1 多克隆抗体和兔抗人GAPDH 单克隆抗体均购自美国Abcam公司;全自动生化分析仪购自深圳迈瑞生物医疗电子股份有限公司。PrimeScriptTMRT Reagent Kit及TB Green®Premix Ex TaqTMⅡ购自日本TaKaRa公司;流式细胞仪购自美国BD 公司;凝胶成像仪购自美国Thermo Scientific 公司。
1.3 危险分层 根据美国国立综合癌症网络(Na⁃tional Comprehensive Cancer Network,NCCN)AML指南[13],通过细胞遗传学和分子异常两方面对风险分层进行评估。低风险分层:细胞遗传学[inv(16)或t(16;16),或t(8;21),t(15;17)];分子异常[正常细胞遗传学,缺乏FLT3⁃ITD 的NPM1 突变或分离的双等位基因CEBPA 突变]。中风险分层:细胞遗传学[正常细胞遗传学,仅+8,t(9;11)];分子异常[t(8;21),inv(16),t(16;16):伴有c⁃KIT突变]。高风险分层:细胞遗传学[≥3 克隆染色体异常,MK,-5,5q⁃,-7,7q⁃,11q23⁃非t(9;11)inv(3),t(3;3),t(6;9),t(9;22)];分子异常[正常细胞遗传学,伴有FLT3⁃ITD 突变]。
1.4 临床样本采集及细胞分离 AML 患者在开始治疗前收集血液样本。空腹抽血,取10 mL 外周血备用。将2 mL 外周血和2 mL PBS 加入10 mL 经肝素处理后的离心管中混匀,再将混合液加入含4 mL 人淋巴细胞分离液的离心管中,5 000 r/min离心10 min。吸取淋巴细胞层至10 mL 离心管中,5 000 r/min 离心10 min,弃去上清,PBS 洗涤3 次。加入1 mL RPMI⁃1640 完全培养基重悬,获得PBMCs,通过免疫磁珠法从PBMCs 中分离初始CD8+T 细胞。加入RPMI⁃1640 培养基重悬,调整细胞浓度达1 × 106/mL,加入激活抗体CD3 和CD28,将细胞置于37 ℃恒温培养箱中培养,用于后续实验。
1.5 外周血Mg2+浓度检测 取3 mL 外周血,室温2 000 r/min 离心10 min 分离血清,采用全自动生化分析仪检测血清中Mg2+浓度。
1.6 RT⁃qPCR 检测 使用TRIzol 试剂从PBMCs和CD8+T 细胞中提取总RNA,然后使用逆转录试剂盒PrimeScriptTMRT Reagent Kit 将RNA 逆转录为cDNA。使用荧光定量试剂盒进行qPCR 检测MagT1 mRNA 表达水平。扩增程序:94 ℃1 min;94 ℃1 min,60 ℃55 s,72 ℃1 min,进行40 个PCR循 环。以GAPDH 作为内参,采用2-ΔΔCt法计算mRNA 相对表达量。引物如下:MagT1 上游引物:5′⁃ACCTAGCCGGAGCAAAGTTTC⁃3′,下游引物:5′⁃CGTCGCAAACGATGAGC AG⁃3′;GAPDH 上游引物:5′⁃GAGTCACTGGCGTCTTCAC⁃3′,下游引物:5′⁃ATCT TGAGCTGTTCATCTCT⁃3′。
1.7 Western blot 检测 取备用的CD8+T 细胞,加入RIPA 裂解液提取细胞蛋白,采用BCA 法定量蛋白。将20 μg 蛋白质加入8% SDS⁃PAGE 凝胶孔中进行电泳,完成电泳后转移到PVDF 膜上。利用5 %BSA 封闭液室温封闭1 h,然后将膜与一级抗体MagT1(稀释1∶500)和GAPDH(稀释1∶2 500)于4 ℃孵育过夜。取出膜,用PBST 洗涤3 次,每次5 min。将膜与辣根过氧化物酶标记的二抗(稀释1∶1 000)置于37 ℃孵育60 min。使用ECL 超敏发光液均匀滴加至PVDF 膜上,使用凝胶成像仪曝光并保存目的蛋白条带图像。MagT1 蛋白表达量为目的蛋白条带灰度值与内参GAPDH 蛋白条带灰度值比值。
1.8 流式细胞术检测CD8+T细胞中PD⁃1和Tim⁃3表达水平 取备用的CD8+T 细胞,分别混合加入5 μL FITC⁃CD8、PE⁃PD⁃1、PE⁃Tim⁃3 等抗体。置于4 ℃冰箱避光孵育120 min,加入2 mL PBS 洗涤2 次后,1 000 r/min 离心5 min。加入300 μL PBS 重悬,流式细胞仪分析AML 患者外周血CD8+T 细胞的PD⁃1 和Tim⁃3 表达情况。目标细胞表面分子表达水平=该表面分子阳性细胞数/总细胞数×100%。
1.9 随访 随访期间,记录患者治疗失败、复发或死亡时间,最后一次随访日期为2021年8月20日。无事件生存期(EFS)定义为从开始治疗之日到治疗失败之日的持续时间,时间不详的患者截止到最后一次检查的时间。总生存期(OS)定义为从开始治疗之日到死亡之日的持续时间,死亡时间不详的患者截止到最后一次随访中知道患者生存之日的时间。无事件生存率是指从入组开始到发生任何事件的时间,包括死亡、疾病进展、改换化疗方案、改为化疗、加用其他治疗、发生致死性或不能耐受的副作用等种种事件。主要用于病程较长的恶性肿瘤或该实验方案危险性高等情况下。
1.10 统计学方法 所有统计分析均使用SPSS 22.0进行。采用Shaprio⁃Wilk 法对数据进行正态分布检验,若符合正态分布,则用均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用t 检验;若不符合正态分布,则用M(P25,P75)表示,多组间比较采用非参数独立样本Kruskal⁃Wallis H 检验,两两比较采用Sidaks multiple(SM)检验。采用Spearman 相关性分析比较MagT1 与PD⁃1 和Tim⁃3的相关性。通过受试者工作特征(ROC)曲线分析MagT1 蛋白表达水平对AML 患者风险分层及预后的预测价值。采用Kaplan⁃Meier 曲线分析MagT1表达水平与AML 患者EFS 和OS 的关系。P <0.05为差异具有统计学意义。
2 结果
2.1 各组外周血Mg2+浓度及PBMCs 中MagT1 mRNA 水平比较 与健康体检组比较,AML 组患者外周血中Mg2+浓度显著降低,同时PBMCs 中MagT1 mRNA 相对表达水平也显著下调(均P <0.001)。见表1。

表1 各组外周血Mg2+浓度和PBMCs 中MagT1 mRNA 表达水平比较Tab.1 Comparison of Mg2+concentration in peripheral blood and expression level of MagT1 mRNA in PBMCs in each group
2.2 不同风险分层AML患者CD8+T细胞中MagT1 mRNA 和蛋白表达水平比较 不同风险分层AML患者中低风险患者CD8+T 细胞中MagT1 mRNA 和蛋白表达水平最高,其次是中风险患者,最后是高风险患者,组间差异有统计学意义(P <0.001)。与低风险组比较,中、高风险组患者CD8+T 细胞中MagT1 mRNA和蛋白表达水平显著降低(P <0.01)。与中风险组比较,高风险组患者CD8+T 细胞中MagT1 mRNA和蛋白表达水平也显著降低(P<0.01)。提示,外周血CD8+T 细胞中MagT1 表达水平的高低可能与AML 患者风险分层有关。见表2。

表2 不同风险分层AML 患者CD8+T 细胞MagT1 mRNA和蛋白表达水平比较Tab.2 Comparison of MagT1 mRNA and protein expression of CD8+T cells in AML patients with different risk stratification M(P25,P75)
2.3 不同风险分层AML 患者CD8+T 细胞中PD⁃1和Tim⁃3 表达水平比较 不同风险分层AML 患者CD8+T 细胞中PD⁃1 和Tim⁃3 表达水平差异有统计学意义(P<0.001)。与低风险组比较,中、高风险组患者CD8+T 细胞中PD⁃1 和Tim⁃3 表达水平显著升高(P<0.01)。与中风险组比较,高风险组患者CD8+T 细胞中PD⁃1 和Tim⁃3 表达水平也显著升高(P<0.01)。见表3。

表3 AML 患者CD8+T 细胞PD⁃1 和Tim⁃3 表达水平比较Tab.3 Comparison of PD⁃1 and Tim⁃3 expression levels of CD8+T cells in patients with AML M(P25,P75)
2.4 AML 患者CD8+T 细胞中MagT1 蛋白表达水平与PD⁃1 和Tim⁃3 表达水平的相关性分析 根据AML 患者外周血CD8+T 细胞中MagT1 蛋白质相对表达量的中值,将高于中值的分为高表达组,且将高表达组赋值为1,低于中值的分为低表达组,且将低表达组赋值为2。采用Spearman 相关性分析方法分析MagT1 蛋白表达量与PD⁃1 和Tim⁃3 表达水平的相关性。结果发现,AML 患者外周血CD8+T 细胞中MagT1 蛋白表达水平与PD⁃1 和Tim⁃3 表达水平呈负相关(均P<0.05)。见表4。

表4 AML 患者CD8+T 细胞中MagT1 蛋白表达水平与PD⁃1和Tim⁃3 表达水平的相关性分析Tab.4 Correlation between MagT1 protein expression on CD8+T cells and PD⁃1 and Tim⁃3 levels in patients with AML
2.5 外周血CD8+T细胞中MagT1表达水平与AML患者EFS 和OS 的关系 根据AML 患者外周血CD8+T 细胞中MagT1 蛋白质相对表达量的中值,将高于中值的AML 患者分为MagT1 高表达组,低于中值的AML 患者分为MagT1 低表达组。通过Kaplan⁃Meier 曲线分析,结果发现MagT1 蛋白高表达的AML 患者EFS 和OS 较MagT1 蛋白低表达患者升高(均P<0.05),说明MagT1 蛋白高表达的AML 患者预后更佳。见图1。

图1 MagT1 高表达和低表达AML 患者EFS 和OS 的比较Fig.1 Comparison of EFS and OS in AML patients with high and low expression of MagT1
2.6 外周血CD8+T 细胞中MagT1 蛋白表达水平对AML 患者风险分层及预后的评估价值 ROC曲线分析结果(表5)显示,外周血CD8+T 细胞中MagT1 表达水平对AML 患者风险分层的AUC 为0.724,95%CI为0.642 ~ 0.806,敏感度为0.523,特异度为0.804,最佳阈值为0.683;预后评估的AUC为0.866,95%CI为0.817 ~ 0.915,敏感度为0.973,特异度为0.605,最佳阈值为0.459,说明MagT1 表达水平对AML 患者风险分层及预后均具有一定的评估价值。
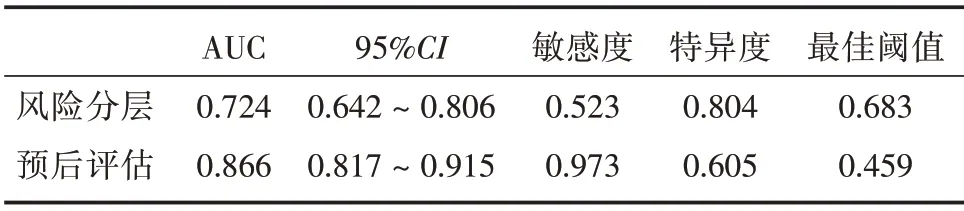
表5 ROC 曲线分析MagT1 蛋白表达水平对AML 患者风险分层及预后评估的价值Tab.5 The appraisal value of MagT1 protein expression level for risk stratification and prognosis in patients with AML was analyzed by ROC curve
3 讨论
Mg2+作为二价金属阳离子,在细胞发生生物行为过程中起着重要作用。在真核细胞中,95%的细胞内Mg2+被结合,剩下的未结合的游离Mg2+受到机体的严格调控[14-16],但其特定的分子功能尚不清楚。MagT1 能选择性地通过质膜传导Mg2+,且MagT1 基因缺失突变能引起原发性免疫缺陷。基于MagT1 介导的病理特征,本研究探讨了MagT1异常表达与AML 疾病发展的关系。结果发现,AML 患者外周血中Mg2+浓度降低,同时,PBMCs 中MagT1 mRNA 相对表达量下调。提示MagT1 介导的胞内Mg2+传导同样参与血液相关恶性肿瘤的发生和发展。本研究进一步发现,MagT1 mRNA 和蛋白相对表达量在AML 低风险患者中最高,其次是中风险患者,而高风险患者的MagT1 mRNA 和蛋白表达量最低,且ROC 曲线分析结果提示外周血CD8+T 细胞中MagT1 表达水平对AML 患者风险分层有一定的评估价值。进一步通过随访观察AML患者的EFS 和OS,发现MagT1 蛋白表达水平对AML 患者预后评估有良好的诊断价值,即MagT1蛋白低表达的AML 患者预后不良。说明外周血CD8+T 细胞中MagT1 表达水平不仅对AML 患者风险分层有预测价值,对其预后评估也具有一定价值。关于MagT1 与预后的相关性,有研究报道,MAGT1 在肝细胞癌中的表达水平可能是该癌诊断和预后的潜在生物标志物[17]。这些结果说明,外周血CD8+T 细胞中MagT1 的表达水平与AML 的发展,乃至治疗效果以及预后情况密切相关,但相关的作用机制尚不清楚。
PD⁃1 是一种重要的免疫抑制分子,以PD⁃1 为靶点的免疫调节对抗肿瘤、抗感染、抗自身免疫性疾病及器官移植存活等均有重要的意义。Tim⁃3是一类T 细胞表面抑制性分子,能够引起癌症与慢性病毒感染过程中T 细胞的衰竭。研究[18-19]显示,PD⁃1、Tim⁃3 等抑制分子的高表达可导致T 细胞功能耗竭。因此,本研究通过检测AML 患者CD8+T 细胞中PD⁃1 和Tim⁃3 的表达,探讨其与AML患者危险分层和MagT1 表达水平的关系,以阐述MagT1 表达水平、T 淋巴细胞功能耗竭及AML 患者风险分层之间的关系。研究[20]发现,初诊AML患者CD4+和CD8+T 细胞PD⁃1 和TIM⁃3 表达水平明显高于对照组,首次诱导化疗后高危患者T 细胞PD⁃1和Tim⁃3 表达水平显著升高。本研究发现,PD⁃1和Tim⁃3 在高风险分层的AML 患者中高表达,且MagT1 与PD⁃1 和Tim⁃3 均呈负相关。结合上述其他研究报道结果,说明AML 患者外周血CD8+T 细胞存在功能耗竭,而这种功能耗竭可能与AML 外周血CD8+T 细胞中MagT1 表达下调有关。
综上所述,AML 患者外周血CD8+T 细胞中MagT1 表达下调与患者风险分层、CD8+T 淋巴细胞耗竭和不利的生存状况相关,据此判断标准对患者进行风险分层及预测预后评估效果,改善AML 患者生存质量。但本研究仍然存在一些局限性:(1)健康献血者的样本量相对较小,这可能导致统计显著性相对较低。(2)尽管研究表明MagT1可能通过调节抗肿瘤基因来影响细胞活性、凋亡及转移,但MagT1 在AML 中的潜在机制仍需要进一步的细胞实验来探索。(3)本研究具有区域选择性,因此需要来自更多其他区域的患者进行验证。后续将从分子机制方面深入探讨哪些信号通路参与MagT1 异常表达对AML 危险分层、T 淋巴细胞功能耗竭以及预后评估的作用。总之,MagT1高表达可能对指导AML 的治疗具有重要意义,有效改善AML 患者生存质量。

