苦水玫瑰组培快繁技术研究
鲁 艺,史文君,黄淑丹,肖 明
(1.青海大学,青海 西宁 810016; 2.青海大学农林科学院,青海 西宁 810016;3.青海高原林木遗传育种实验室,青海 西宁 810016)
苦水玫瑰(RosaSetate×RosaRugosa)是蔷薇科(Rosaceae)蔷薇属(Rosa)落叶灌木,是钝齿蔷薇与中国玫瑰的自然杂交种,是中国的四大玫瑰品系之一[1-2]。苦水玫瑰作为栽培品种已有两百多年的历史,主产地位于甘肃省永登县苦水镇。此外,在甘肃省兰州市、四川省眉山市、山东省平阴县等地也有少量栽培[2]。苦水玫瑰为国内外出名的加工型玫瑰品种,是药食同源的经济类灌木树种,具有极高的经济、营养、药用等价值,市场需求较大。生产中多采用无性繁殖方式进行苦水玫瑰种苗繁育[3]。目前,大马士革玫瑰[4-5]、保加利亚玫瑰[6]、紫枝玫瑰[7]、野生玫瑰[8-10]、平阴玫瑰[11]的组织培养及其影响因素的研究已经取得了一些进展,一般选用玫瑰茎段为外植体,以MS或WPM培养基作为基本培养基,研究植物生长调节剂浓度和组合对不定芽诱导的影响,建立成熟的组培快繁体系。不同玫瑰品种组培方法差异较大,而对于苦水玫瑰的组织培养技术研究较少。传统苦水玫瑰多采用扦插繁殖,后嫁接培养,但苗木繁育周期长、工序繁杂。当前仅有张武等[12]初步研究了苦水玫瑰苗的诱导、增殖、继代和生根等技术,但仍存在诱导率低、生根困难、生根率低等问题,且未涉及消毒方案的比较试验,因此,对于苦水玫瑰组培快繁体系的建立仍需进一步研究。为进一步完善苦水玫瑰组培快繁体系,提高组培的诱导率、增殖率、生根率,本试验对苦水玫瑰的外植体消毒、不定芽增殖、生根诱导等过程中的各种影响因素进行了研究,旨在为苦水玫瑰育苗提供一定的技术支持。
1 材料与方法
1.1 试验材料
苦水玫瑰采自于青海省海东市互助土族自治县威远镇秀美农林科技有限公司种植基地北郊山坡旱地(101°55′E,36°50′N),海拔2 620 m,属大陆寒温带气候。剪取生长健壮、无病虫害的当年生半木质化枝条作为供试材料。
1.2 试验方法
1.2.1 培养基与培养条件 启动培养、增殖培养、生根培养分别以MS、WPM和1/2MS为基本培养基,添加蔗糖3%、琼脂0.7%,用NaOH或HCl将培养基pH调至5.8~6.0,121 ℃高压灭菌20 min。待培养基冷却至60 ℃左右时,添加植物生长调节剂。培养温度为(25±2)℃,光照强度为2 000 lx,每天光照时间为16 h。
1.2.2 外植体处理 2020年5月下旬采集露地栽培的苦水玫瑰植株上半木质化枝条,清除枝条表面的污物后,用流水冲洗1.5~3 h。将其剪成4~5 cm长的带芽茎段,首先用70%乙醇消毒30 s,接着倒入消毒剂消毒,并不断摇动振荡,再用无菌水清洗5~6次,洗去残留的消毒剂。最后用无菌滤纸吸干外植体表面水分,将其剪成长度约 1 cm的带芽茎段,接种于启动培养基中。
试验设置消毒剂和消毒时间2个因素,A1、A2、A3处理分别为选用1%次氯酸钠(NaClO)消毒10、14、18 min,A4、A5、A6处理分别为选用0.1%升汞(HgCl2)溶液处理4、6、8 min,共计6个处理。
1.2.3 启动培养 以MS为基本培养基,添加1.0 mg/L 6-苄基腺嘌呤(6-benzylaminopurine,6-BA)、0.1 mg/L萘乙酸(naphthalene acid,NAA)、3%蔗糖、0.7%琼脂粉,作为苦水玫瑰启动培养的培养基。外植体接种于启动培养基中,然后将培养瓶置于培养室进行培养,15 d后统计不同处理下的污染率、褐化率、萌芽率:
污染率=污染外植体数/接种外植体数×100%
(1)
褐化率=褐化数/接种外植体数×100%
(2)
萌芽率=萌芽外植体数/接种外植体数×100%
(3)
1.2.4 增殖培养 增殖诱导培养基以WPM为基本培养基,分别添加不同浓度的6-BA(0.25、0.5、0.75、1.0和1.25 mg/L)和0.2 mg/L NAA,共设置5个处理(B1、B2、B3、B4和B5)。每瓶接种3~4株试管苗,每个处理接种15株,3次重复,培养条件同上,60 d后观察生长增殖情况,统计不同培养基下的平均株高、增殖系数:
增殖系数=接种后所得芽数/接种总数
(4)
1.2.5 生根培养 以1/2MS为基本培养基,设置不同浓度的NAA(0、0.1、0.2、0.3、0.4 mg/L),共5个处理(CK、C1、C2、C3和C4)。每瓶接种3~4株试管苗,每个处理接种15株,3次重复,培养条件同上,60 d后观察生根情况,统计各处理的生根率、平均生根条数和平均根长:
生根率=生根数/接种数×100%
(5)
平均生根条数=生根条数之和/接种总数
(6)
平均根长=根长之和/生根条数
(7)
1.2.6 炼苗与移栽 将生根苗的封口膜解开放置1 w,使生根苗逐渐适应外界环境后,取出生根苗,除去根部残余培养基。选取根系生长健壮的生根苗共计100株,移入装有灭菌基质(珍珠岩∶蛭石∶草炭=1∶2∶1)的5×10孔穴盘中,每孔移入1株生根苗,置于温室,并加盖透光塑料罩,温度(25±2)℃,相对湿度 70%~90%,定期浇水,移栽 14 d后统计移栽成活率。
1.3 数据分析
使用Excel 2007进行数据统计分析,用SPSS 26.0进行方差分析。
2 结果与分析
2.1 消毒方法对苦水玫瑰外植体消毒效果的影响
启动培养(图1a)前对外植体进行消毒。由表1可知,随着1%NaClO消毒时间的延长,褐化率逐渐提高,萌芽率呈现先升高后降低的趋势,经0.1%HgCl2消毒的外植体的褐化率显著高于1%NaClO处理的褐化率。A2~A6处理的外植体均有不同程度的褐化和污染现象,其中A2处理(70%酒精消毒30 s,1%NaClO消毒14 min)外植体的褐化率和污染率最低,而萌芽率最高,可达90.91%。

表1 消毒方法对苦水玫瑰外植体消毒效果的影响

图1 苦水玫瑰启动培养、增殖培养和生根培养
2.2 植物生长调节剂种类及其配比对苦水玫瑰增殖的影响
以WPM为培养基,添加不同浓度和配比的植物生长调节剂进行增殖培养,苦水玫瑰的增殖系数和苗高生长情况有显著性差异(表2)。苦水玫瑰平均株高随着6-BA浓度的升高而逐渐下降,增殖系数随着6-BA浓度的升高先增加再降低。当6-BA浓度为0.50 mg/L和0.75 mg/L时,增殖系数分别可达4.10和4.07,两者之间无显著差异,且显著高于其他处理组。但B3处理下,试管苗的平均株高较低,植株长势较差,而B2处理丛生芽生长健壮(图1b),因此B2处理为最适6-BA浓度。可见适宜苦水玫瑰组织培养继代增殖的培养基为WPM+0.5 mg/L 6-BA + 0.2mg/L NAA 。
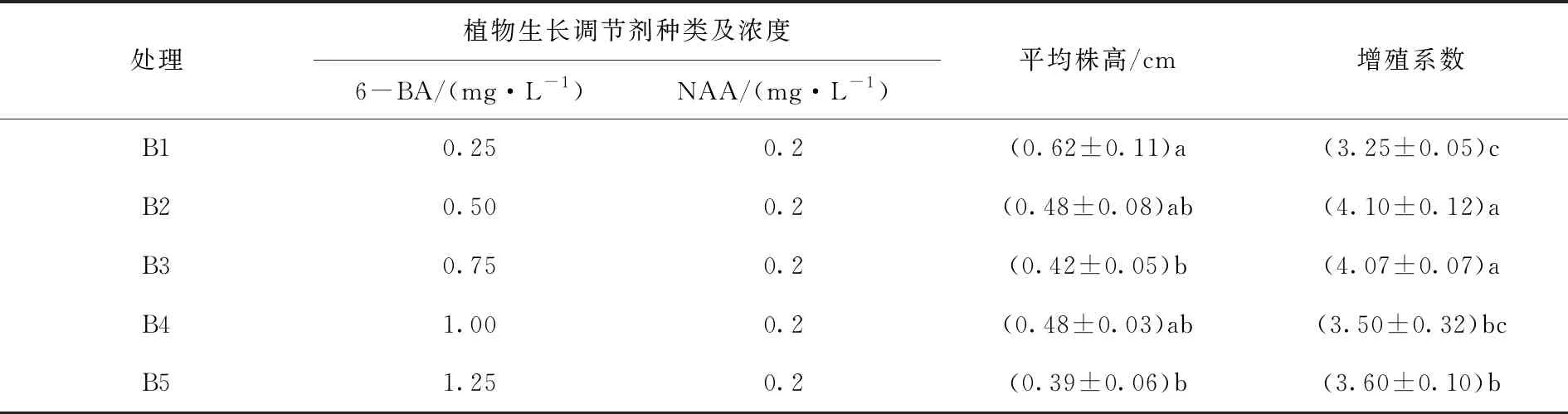
表2 生长调节剂种类及其配比对苦水玫瑰增殖培养的影响
2.3 NAA浓度对苦水玫瑰生根的影响
以1/2 MS为基本培养基,添加不同浓度的NAA进行生根培养。由表3可知,添加NAA处理的生根率均显著高于CK处理,NAA能显著促进苦水玫瑰组培苗生根。在NAA浓度为0~0.4 mg/L的范围内,随着NAA浓度的升高,生根率和平均生根条数呈现逐渐上升的趋势,C4处理组培苗生根率最高,平均生根条数最多,且该处理的组培苗平均株高和根长与CK处理无显著差异。因此,对组培苗平均株高、生根率、平均生根数和平均根长综合考虑,适宜苦水玫瑰组培苗的生根培养基为1/2MS+0.4 mg/L NAA(图1c、图1d)。
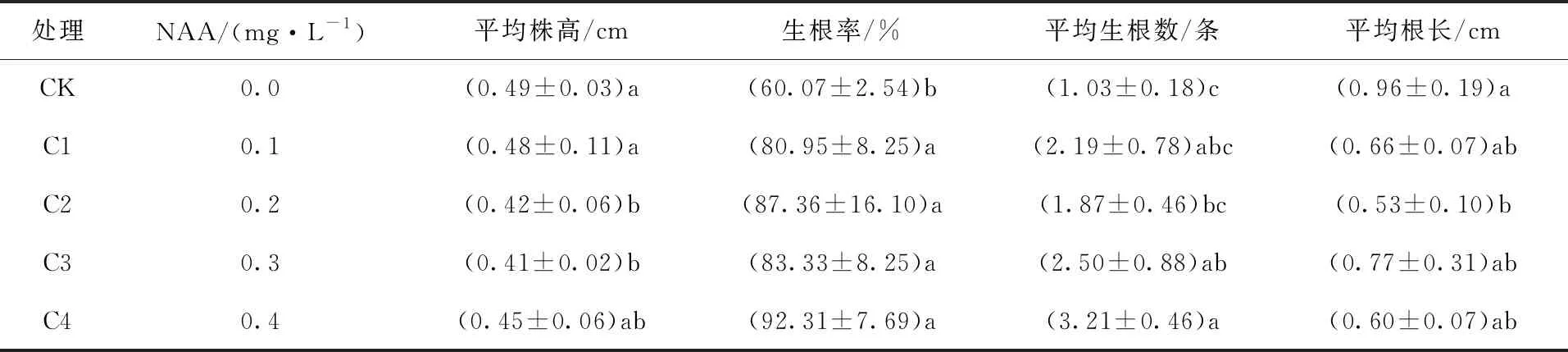
表3 NAA浓度对苦水玫瑰生根的影响
2.4 炼苗与移栽
炼苗后将植株生长健壮、根系生长良好的苦水玫瑰苗移栽至混合基质(珍珠岩∶蛭石∶草炭=1∶2∶1)中,正常日常管理,14 d后苦水玫瑰生根苗的存活率为67%,生根苗长势良好,叶呈绿色。
3 讨论与结论
(1)外植体消毒灭菌是植物组织培养技术中的关键一步,不仅要求对外植体进行彻底灭菌,还要尽可能减少对外植体的损害,保证外植体仍具有旺盛的生长分化能力,因此选择合适的消毒方法对外植体灭菌至关重要[13]。余志杰等[10]研究指出野生玫瑰茎段的最适消毒方案为75%乙醇0.5 min+0.1%升汞(添加吐温-20)12 min。赵映洁等[14]研究得出红拂玫瑰茎段的最适消毒方案为75%乙醇30 s+10%NaClO 10 min。而本研究用苦水玫瑰茎段做外植体,得出先用70%乙醇消毒30 s,再用1%NaClO消毒14 min灭菌效果最佳。消毒方案不同可能是由玫瑰品种、外植体的生长状态、外植体的生长环境等的差异造成的。消毒剂的选择和消毒时间应依据外植体的类型、大小、木质化程度等决定[15],裂叶垂枝桦木质化茎段的最佳消毒时间为0.1%HgCl210 min,幼嫩茎段的最佳消毒时间为3 min[16],不同木质化程度茎段的最适消毒时间不同。消毒时间过短会导致外植体表面灭菌不彻底,出现污染现象;而消毒时间过长,外植体易受灭菌剂的毒害,导致褐化或死亡。
(2)增殖培养是利用组织培养实现快繁技术必不可少的重要环节,细胞分裂素与生长素的合理使用可促进芽苗增殖。目前,已知较高的苦水玫瑰增殖系数为3.56,使用的培养基为WPM+1.5mg/L 6-BA[12],与本研究结果略有差异。本研究中的增殖培养是在多次继代基础上进行的,具有更高的增殖系数,增殖系数随着6-BA浓度的增加呈现先上升后下降的趋势,在0.5 mg/L 时有最大增殖系数(4.10),获得较高质量的不定芽。苦水玫瑰组培快繁增殖系数的提高,为苦水玫瑰快繁奠定了一定基础。适宜浓度的6-BA能显著促进不定芽的产生,这可能是通过影响酶(细胞壁酶、过氧化物酶、SOD等)的活性促进培养物的细胞分裂和分化[17]。很多玫瑰品种在芽增殖过程中都对6-BA表现出了良好的反应。徐立军等[5]用3.0 mg/L 6-BA配合0.1mg/L NAA对大马士革玫瑰进行增殖培养,增殖系数达5.1,且苗木生长良好。黄颖等[4]用1.0 mg/L 6-BA配合0.05 mg/L NAA取得较好的增殖效果。6-BA浓度过高或过低都不利于玫瑰的增殖培养:浓度低时,组培苗的增殖系数不高;而浓度过高时,不定芽数逐渐减少,生长势逐渐减弱,对玫瑰的茎芽伸长生长有抑制作用[18]。
(3)生根培养阶段,无机离子减半有利于生根[19],用于玫瑰试管苗生根的3种生长素中,NAA的生根效果较好,而IBA和IAA诱导出的根系较为细弱,长势较差[6],且ABA激素与IAA、IBA、NAA等多种激素配合使用不能促进玫瑰生根[20]。因此,本试验以1/2 MS为基本培养基,添加不同浓度的NAA展开试验,发现NAA能显著促进苦水玫瑰组培苗生根,赵钢等[8]研究表明,以1/2 MS+0.1 mg/L NAA培养基诱导野生玫瑰生根的效果最好。此外,本试验还发现在0~0.4 mg/L浓度范围内,随着NAA浓度的增加,生根率和生根数呈现上升趋势,其最适激素配比相比已有的苦水玫瑰生根培养报道,进一步提高了生根率,更加完善了快繁体系。但生长素具有两重性,高浓度NAA会抑制根系的生长,李晓亮等[21]的研究表明,随着NAA浓度的逐步增大,玫瑰茎段基部愈伤组织逐渐增多,但茎段成株率和生根率却逐渐降低,NAA浓度过高致使茎段大量愈伤化而不能分化形成植株,需合理控制NAA浓度,以促进组培苗生根。
本试验对外植体消毒方法及增殖培养、生根培养的最适培养基进行了研究,初步建立了苦水玫瑰的组培快繁体系。结果表明,苦水玫瑰半木质化枝条最适的消毒方案为先用70%乙醇消毒 30 s,然后使用1%NaClO消毒14 min,萌芽率为90.91%;增殖诱导培养基以WPM+0.5 mg/L 6-BA+0.2 mg/L NAA为佳,增殖系数可达4.10;生根培养基以1/2 MS+0.4 mg/L NAA为佳,生根率高达92.31%,平均生根条数为3.21,平均根长为0.60 cm。后期可进一步对其抗褐化处理和生根苗移栽后的管理开展研究,以提高成活率。
——苦水“二月二”社火组照

