50例Gitelman综合征患者临床特征和药物治疗分析
赵 喆,唐 彦,周婧雅,陈晓光,张 磊,陈丽萌,袁 涛
中国医学科学院北京协和医院 1药剂科 3病案科 5肾内科 6内分泌科 国家卫生健康委员会内分泌重点实验室, 北京 100730 2中国医学科学院 北京协和医学院药物研究所天然药物活性物质与功能国家重点实验室,北京 100050 4世界卫生组织疾病分类家族中国合作中心,北京 100730
Gitelman综合征(Gitelman syndrome, GS)是一种较为罕见的常染色体隐性遗传病[1],其发病是编码噻嗪类利尿剂敏感的Na+/Cl-共同转运体SLC12A3基因突变所致。该病起病隐匿,患者主要临床表现为低血钾、低血镁、低尿钙、肾素-血管紧张素-醛固酮系统(renal-angiotensin-aldosterone system, RAAS)激活、代谢性碱中毒[2],但不同患者间具有较大的异质性,易被漏、误诊。目前尚无根治GS的方法,临床主要采用药物治疗以控制临床症状,但药物治疗仅见于个案报道[3- 8],缺乏系统分析。本研究对2007—2019年北京协和医院临床确诊为GS的患者临床特征及药物治疗情况进行总结,以加深临床医师对该病的认知。
1 资料与方法
1.1 研究对象
回顾性纳入2007年1月至2019年12月在北京协和医院接受住院治疗的全部GS患者。GS临床诊断主要依据患者家族史(常染色体隐性遗传)、肢体乏力等相关临床表现以及实验室检查结果进行综合判断。其中实验室检查包括:慢性低钾血症(<3.5 mmol/L)、代谢性碱中毒、低镁血症(<0.7 mmol/L)、低尿钙症(尿钙/尿肌酐<0.2)、RAAS激活。排除长期服用利尿剂、缓泻剂、药物成瘾史的患者。
本研究已通过北京协和医院伦理审查委员会审批(审批号:ZS- 2513)。
1.2 方法
对患者的临床资料、实验室检查以及药物治疗情况进行总结和分析,主要包括性别,年龄,起病年龄,病程,临床症状,血压,尿常规,血肌酐,血电解质,尿电解质,血气分析,卧立位血浆肾素活性、血管紧张素Ⅱ、醛固酮,治疗方案等。
1.3 偏倚控制
本研究在数据收集及分析过程中采取以下方法控制偏倚:(1)纳入的GS患者均经过严格的诊断和鉴别诊断,确保无误诊;(2)收集数据以客观的实验室检查结果为主。
1.4 统计学处理
采用SPSS 20.0软件进行统计分析。符合正态分布的计量资料(如血钾)以均数±标准差表示,组间比较采用独立样本t检验;非正态分布计量资料(如pH)以中位数(四分位数)表示。计数资料以频数(百分数)表示。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共纳入50例临床诊断为GS的患者。其中男性30例,女性20例;年龄(30.78±13.99)岁(4~65岁);体质量指数(body mass index,BMI)为(22.10±4.00)kg/m2;病程20 d~36年。
2.2 临床表现
50例患者均以“低钾血症待查”入院,49例未明确诊断,1例在外院被误诊为Bartter综合征。11例(22.0%)有低钾血症家族史。生长发育基本正常,最常见的临床表现为乏力(54.0%,27/50),其他常见临床表现包括四肢无力(40.0%,20/50)、肢体麻木(26.0%,13/50)、软瘫(26.0%,13/50)、心悸(16.0%,8/50)、夜尿增多(14.0%,7/50),此外7例(14.0%)出现手足抽搐,3例(6.0%)出现痉挛及行走困难,2例(4.0%)出现肌肉疼痛。部分患者伴甲状腺疾病及血脂异常等代谢性疾病,详细临床资料见表1。
2.3 实验室检查
50例患者均存在不同程度的低钾血症,初诊时血钾为1.60~3.40 mmol/L,平均(2.55±0.45)mmol/L,其中22例(44.0%)≤2.5 mmoL/L,21例(42.0%)为2.51~2.99 mmoL/L,7例(14.0%)≥3.0 mmoL/L。血镁为0.33~1.40 mmol/L,平均(0.64±0.20)mmol/L,其中33例(66.0%)<0.70 mmol/L(低血镁)。24 h尿钾为23.30~185.90 mmol,平均(92.25±41.33)mmol,其中46例(92.0%)>25 mmol。24 h尿镁为0.60~9.46 mmol,平均(3.75±2.14)mmol。24 h尿钙为0.68(0.38, 1.32)mmol,其中41例(82.0%)<2.5 mmol。血气分析结果显示,pH为7.46(7.45,7.48),碱剩余4.75(3.33,6.15)mmol/L,HCO3-28.70 (26.78,29.93)mmol/L,29例(58.0%)存在代谢性碱中毒(表2)。31例(62.0%)进行卧立位醛固酮试验,其中21例(67.7%)存在RAAS激活(表3)。
2.4 肾活检
7例患者行肾穿刺活检术,1例结果示肾小球系膜增生,5例肾小球旁器明显增生,另1例未见明显肾小球旁器增生。
2.5 药物治疗
50例患者均接受口服补钾治疗,平均补钾量为(1.62±1.25)mmol/(kg·d)。其中,46例(92.0%,46/50)口服氯化钾缓释片(1.5~12 g/d);19例(38.0%,19/50)口服20%枸橼酸钾口服溶液(40~200 mL/d,分2~4次服用),其中联合氯化钾缓释片17例,联合门冬氨酸钾镁片1例,单独使用枸橼酸钾口服溶液1例;37例(74.0%,37/50)接受门冬氨酸钾镁片治疗,剂量为2~15片/d;32例(64.0%,32/50)使用醛固酮受体拮抗剂螺内酯片(20~240 mg/d);2例(4.0%,2/50)使用钙镁片根据是否使用螺内酯,50例患者分为单纯补钾组(n=18)和联合螺内酯组(n=32)。单纯补钾组中,2例(11.1%,2/18)仅口服氯化钾缓释片补钾,1例(5.6%,1/18)联合使用氯化钾缓释片和钙镁片,1例(5.6%,1/18)单独使用门冬氨酸钾镁片,3例(16.7%,3/18)联用氯化钾缓释片和枸橼酸钾口服溶液,9例(50.0%,9/18)联合口服氯化钾缓释片和门冬氨酸钾镁片,余2例(11.1%,2/18)联合使用口服氯化钾缓释片、门冬氨酸钾镁片及枸橼酸钾口服溶液。联合螺内酯组患者在各种补钾方案的基础上联合使用螺内酯。单纯补钾组患者治疗后血钾为(3.33±0.29)mmol/L,较治疗前升高(0.73±0.59)mmol/L;联合螺内酯组患者治疗后血钾为(3.58±0.49)mmol/L,较治疗前升高(1.07±0.61)mmol/L。联合螺内酯组治疗后血钾升高量高于单纯补钾组(P<0.05)。50例患者出院时平均血钾为(3.49±0.44)mmol/L,平均血镁为(0.67±0.16)mmol/L。具体补钾量及治疗前后血钾、血镁的变化情况见表4。

表 1 50例Gitelman综合征患者临床特征(按入院时间排序)
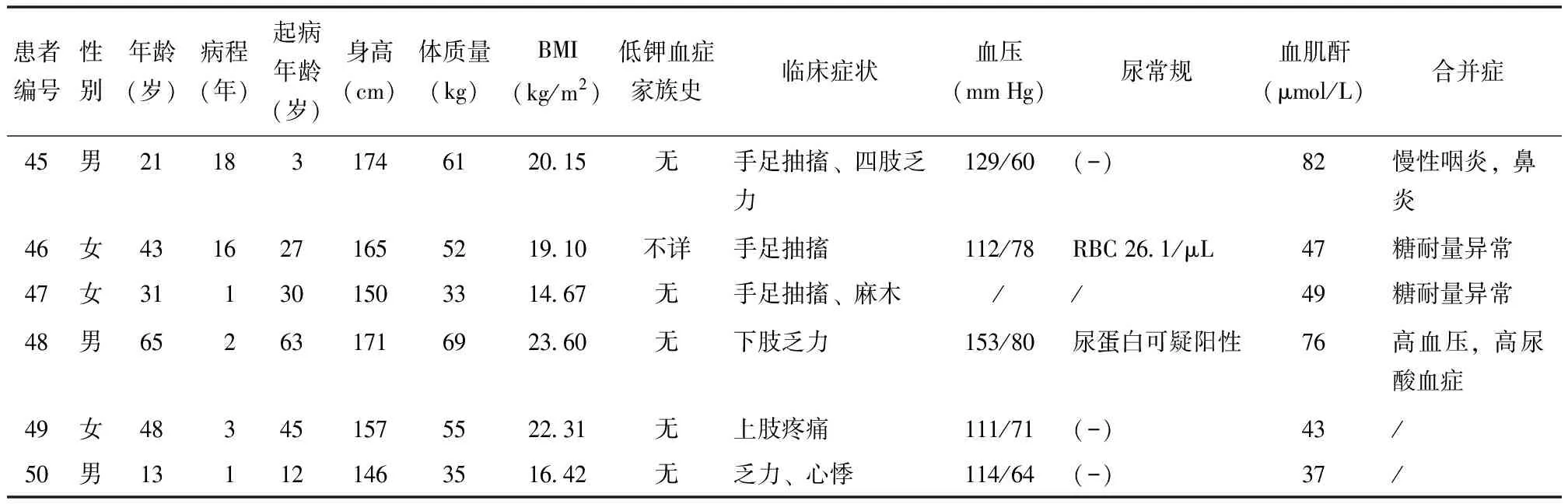
表 1 50例Gitelman综合征患者临床特征(按入院时间排序)

表 2 50例Gitelman综合征患者实验室检查结果
3 讨论
本研究回顾性分析了北京协和医院临床诊断为GS的50例患者的临床特征及药物治疗情况,为迄今国内关于GS药物治疗分析样本量最大的研究。结果显示,男女比例为1.5∶1,平均年龄(30.78±13.99)岁;最常见的临床表现为乏力(54.0%),其次为四肢无力(40.0%)、肢体麻木(26.0%)、软瘫(26.0%);实验室检查可见低钾血症、低镁血症、低尿钙、代谢性碱中毒、RAAS激活。治疗方案以对症治疗为主,包括补钾、补镁、补钙等,患者总体预后较好。
3.1 GS诊断标准
Gitelman于1966年首次报道了3例“低钾血症、低镁血症、低尿钙、代谢性碱中毒、RAAS激活”的病例,并将该疾病命名为Gitelman综合征[1]。GS是一种较为罕见的常染色体隐性遗传病,在欧洲人群中发病率约为1/40 000,尚缺乏其在我国人群中发病率的数据[9]。2018年,国家卫生健康委员会等五部门联合制定了《第一批罕见病目录》,GS被收录其中。本研究回顾性分析了北京协和医院临床诊断为GS的50例患者临床资料,其中1例在外院被误诊为Bartter综合征,其余均未确诊,提示临床医生对其尚缺乏充分认知,亟需提高GS诊治水平。虽然Bartter综合征和GS在临床表现上存在一定交叉性,但两者的病变部位和致病基因均不同[10]。Bartter综合征是由位于肾小管髓袢升支粗段的离子通道缺陷所引起,主要由编码该通道蛋白的CLCNKB基因突变所致[11]。该病可通过发病年龄、低尿钙及低血镁的发生与否、是否存在生长发育迟缓等与GS进行鉴别诊断[12]。GS主要累及肾脏远曲小管,病因为SLC12A3基因突变[13],SLC12A3基因检测是GS诊断的金标准,推荐有条件的机构进行该项检查。本研究纳入的GS患者部分行基因检测,均证实存在SLC12A3基因突变,其中,常见的突变位点包括T70M、R655H、D486N等[14- 16]。由于基因检测费用较高,难以广泛应用,GS的临床诊断主要依据临床表现、实验室检查结果等。SLC12A3基因突变可影响肾脏远曲小管对钠离子、氯离子的重吸收,水丢失过多导致血容量降低,激活RAAS,刺激钾离子在远曲小管和集合管过量分泌导致低钾血症;同时,醛固酮水平升高也可促进钾离子排泄,但血钾过低会启动负反馈机制来抑制RAAS活性,以致部分患者的肾素、血管紧张素水平未升高。基于上述病因,该病的实验室检查通常表现为“低血钾、低血镁、低尿钙以及代谢性碱中毒”,尽管各项指标均具有重要诊断价值,但并非所有患者各项指标均异常[12],且在疾病早期,患者可能仅表现为部分检测指标异常,故本研究中部分患者的一些实验室检查结果处于正常水平。综合考虑家族史、临床表现及实验室检查结果等相关临床资料,并经过严格鉴别诊断排除其他可能疾病后,本研究纳入的患者均确诊为GS。
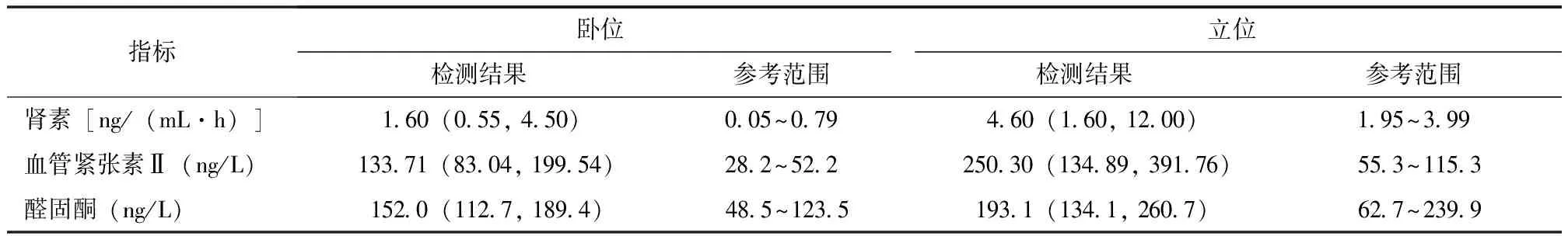
表 3 Gitelman综合征患者初诊卧立位醛固酮试验结果[M(P25, P75),n=31]

表 4 50例Gitelman综合征患者治疗前后血镁、血钾变化情况
3.2 GS临床特征
既往有关GS的研究多为个案报道,缺少对患者临床资料的系统总结。本研究对50例GS患者的临床资料总结后发现,男女比例为1.5∶1,此前其他研究报道的男女比例为1.14∶1[17]。患者就诊时平均年龄为(30.78±13.99)岁,这与既往GS通常于青少年和成年时期发病[18]相符。但儿童亦可发病,本研究确诊病例中,年龄最小者仅4岁。
患者血压和生长发育一般正常,最常见的临床表现为乏力(54.0%),且多作为首发症状出现,其他常见的临床表现包括四肢无力(40.0%)、肢体麻木(26.0%)、软瘫(26.0%)、心悸(16.0%)等。该病具有家族遗传特征,本研究11例患者存在低钾血症家族史,提示询问病史对疾病的诊断具有积极意义。多数GS患者具有合并症,包括高血压、高脂血症、糖耐量异常等代谢性疾病以及脂肪肝、肾小球疾病等。本研究9例合并甲状腺疾病。目前尚无报道证实甲状腺疾病与SLC12A3基因相关,但GS与甲状腺功能亢进均可能导致低钾血症,根据疾病特征有助于二者的鉴别诊断。
此外,肾穿刺活检术是一种有创的GS辅助鉴别诊断方法,多数患者无需行肾穿刺活检术,但若患者出现原因不明的肾功能损伤或大量蛋白尿,常需通过此项检查以判断肾脏疾病的性质。既往认为GS患者多伴肾小球旁器增生[9]。本研究7例GS患者行肾穿刺活检术,结果示5例肾小球旁器明显增生,验证了既往研究结果。1例肾小球系膜增生,另1例未见明显肾小球旁器增生,提示肾穿刺活检病理结果未见肾小球旁器增生亦不能排除GS。
3.3 GS药物治疗
目前国内外尚无根治GS的方法,需进行终身替代治疗,主要为对症治疗、纠正电解质紊乱,旨在提高患者生活质量、避免出现严重并发症[19- 20]。改善全球肾脏病预后组织(Kidney Disease Improving Global Outcomes,KDIGO)共识与指南建议将GS患者的血钾和血镁水平分别控制在3.0 mmol/L和0.6 mmol/L以上[21]。补钾通常遵循“食补+药补”的原则,鼓励患者多进食富含钾的食物,如香蕉、红薯、坚果等。药物补钾通常采用口服补钾的方式,可首选氯化钾缓释片。为减少其对胃肠道的刺激,应避免空腹服用,且由小剂量开始逐步增加至合适的剂量并维持,若疗效欠佳,可联合枸橼酸钾口服溶液进行补钾。无法进食或出现严重低血钾症状的急重症患者,需进行静脉补钾治疗。本研究92%(46/50)的患者口服氯化钾缓释片,38%(19/50)的患者治疗方案中包含枸橼酸钾口服溶液,补钾效果理想,患者血钾水平可稳定在3.0 mmol/L以上。
除上述直接补充电解质改善患者症状外,还可通过调节RAAS活性以升高血钾。醛固酮受体拮抗剂具有促进肾脏排钠和利尿的作用,同时通过拮抗醛固酮活性可减少钾排泄,起到升高血钾的作用,其主要代表药物为螺内酯和依普利酮[22]。有研究指出,作用于肾小管远端的保钾利尿剂阿米洛利(20 mg/d)和新型醛固酮受体拮抗剂依普利酮(150 mg/d)均可显著提升GS患者的血钾水平,但二者的作用强度低于环氧合酶2抑制剂吲哚美辛(75 mg/d)。虽然吲哚美辛可显著改善低血钾相关症状[23],但潜在的副作用较多,可引起严重肾功能损害。氨苯喋啶片可有效提高GS患者的血钾浓度,若患者口服补钾后血钾仍未达理想水平,可考虑联用氨苯喋啶片进行治疗[24]。由于GS有RAAS激活的临床表现,亦可选择抑制RAAS活性的药物,但需注意应从低剂量开始,警惕低血压等不良反应的发生[25- 26]。此外,此类药物可能存在致畸风险,妊娠期患者禁用[27]。
螺内酯是人工合成的利尿剂,兼具排钠保钾的作用。本研究比较了单纯补钾组和联合螺内酯组的血钾效果,结果显示联合螺内酯组患者的血钾改善程度显著优于单纯补钾组患者,提示口服氯化钾缓释片、枸橼酸钾口服溶液、门冬氨酸钾镁片补钾效果不满意时,可考虑联合螺内酯改善血钾。但联合螺内酯补钾时应注意补充钠盐,并警惕发生低血压。此外,螺内酯具有抗雄性激素的作用,25 mg/d即可引起女性月经紊乱及男性乳房发育等不良反应,且剂量越大,不良反应发生的风险越高[28- 29]。本研究联合螺内酯组2例男性患者,由于出现乳房发育等不良反应而停用螺内酯片。
多数GS患者伴发低血镁,补镁治疗不仅可纠正低血镁、酸碱平衡紊乱,且有助于预防抽搐症状的发生。有研究报道GS患者通过单纯补充镁离子,可有效减少尿钾排出,将血钾水平由2.6 mmol/L提升至3.4 mmol/L[30]。有研究显示,补充缓释乳酸镁制剂后,91%的GS患者血液生化指标得到明显改善,且血钾的改善更为显著[31],提示血镁正常的GS患者也可适当补镁。补充血镁可采用多种制剂,国外通常使用氯化镁,其可同时补充镁离子和氯离子[32]。我院多推荐口服门冬氨酸钾镁片进行补镁治疗,其在补镁的同时对低钾情况亦有所改善。由于补镁制剂易引起胃肠道等不良反应,故推荐餐中口服,并根据胃肠道耐受情况进行调整。若患者出现严重不耐受症状,可予以静脉注射氯化镁或者硫酸镁。质子泵抑制剂可影响镁的生物活性,故在补镁的同时应尽量避免联合使用质子泵抑制剂[33]。本研究38例患者接受了补镁治疗,其中36例仅口服门冬氨酸钾镁片,1例仅口服钙镁片,1例联合使用门冬氨酸钾镁片和钙镁片,补镁效果均良好且未出现胃肠道不良反应。
GS可能伴发甲状腺疾病、慢性肾病、代谢综合征以及心血管疾病等,应由多科医生联合制订诊疗计划,并根据病情改善情况及时调整用药方案。部分GS患者在儿童期甚至新生儿期出现临床症状,可能会导致生长发育迟缓,此类患者进行药物治疗时需综合考虑、严格评估,若发现生长激素缺乏则需适量补充。
本研究局限性:为单中心回顾性研究,未来需进行多中心、大样本研究对GS的临床特征和药物治疗效果进行深入探索。但对GS这种罕见病进行系统总结和分析十分必要,可为提升该病的诊疗水平提供重要理论依据。
综上,GS多见于青少年或成年人,但儿童亦可发病,乏力是最常见的临床症状,实验室检查结果为低血钾、低血镁、低尿钙、代谢性碱中毒等表现,临床医师及药师应提高对GS的认识,以减少漏诊、误诊。该病目前尚无根治方法,总体药物治疗原则是对患者进行个体化管理,单纯补钾进行替代治疗效果欠佳,常需联合应用醛固酮拮抗剂等药物进行治疗,血镁低者多联用门冬氨酸钾镁片。患者总体预后较好。建议患者应至少每6~12个月进行1次门诊随访,并根据病程及治疗效果及时调整治疗方案。本研究部分患者未遵医嘱随诊,治疗依从性较差,增加了药物治疗管理的难度。建议开展多种形式的健康宣教,使GS患者充分了解病程进展及发生紧急情况时的应对措施,并逐步提高患者的治疗依从性。此外,在随访中发现,随病程延长,部分患者的疾病相关临床症状减轻甚至缓解,提示定期监测GS患者药物治疗疗效具有重要意义,以防止过度治疗。随着研究的不断深入,针对GS临床治疗和发病机制的研究已取得重大进展,该病未来治疗可期根治。
作者贡献:赵喆、周婧雅负责数据收集、论文撰写;唐彦、陈晓光、袁涛负责研究设计;张磊、陈丽萌、袁涛负责数据质控和审核;所有作者均参与论文审阅及修订。
利益冲突:所有作者均声明不存在利益冲突

