不同鱼体大小、暂养温度、麻醉方式对黄颡鱼麻醉的影响
周 文,廖 涛,朱子健,白 婵,王炬光,熊光权,柴 毅
(1 长江大学动物科学学院,湖北 荆州 434023;2 湖北省农业科学院农产品加工与核农技术研究所,农业农村部农产品冷链物流技术重点实验室,湖北 武汉 430064)
在各种水产养殖过程中,麻醉已被广泛证明是减少各种水产养殖过程中应激或物理损伤的有效方法[1-3]。麻醉通常由化学药剂或物理方法诱导,首先引起镇静效果,其次是产生麻醉效果(失去活动能力、平衡能力和意识)[4]。
目前,已有多种化学或者物理的方法可用于鱼类麻醉,然而,不同方法对不同鱼类的麻醉效果不同,其通常受到药剂种类、浓度,动物的大小以及环境因素(温度、pH)影响[15-16]。恰当的麻醉可以将应激对鱼类的有害影响降到最低[17]。因此,每个物种都需要选择合适的麻醉方式,制定合适的麻醉方案以减少运输过程中的有害影响[18]。
黄颡鱼(Tachysurusfulvidraco)是中国重要的经济淡水鱼类之一,由于“全雄1号”和杂交黄颡鱼“黄油1号”两个审定新品种的推广,显著促进了水产生产和消费的增加,黄颡鱼被认为是未来20年水产养殖产量将超过100万t的仅有的两种特殊鱼类之一(另一种是大嘴鲈鱼)[19-20]。此外,黄颡鱼鲜美的肉质和较高的市场价值,使其在日本、韩国、东南亚有广阔的市场前景[21]。遗憾的是,目前没有看到相关文献评价多种麻醉方式对黄颡鱼的麻醉效果以及达到麻醉状态后持续麻醉所造成的应激相关研究。
本研究评估了茶树精油、低温麻醉、电麻醉对经过不同温度暂养以及不同体质量黄颡鱼的麻醉效果,同时还研究了麻醉时长对黄颡鱼应激的影响。
1 材料与方法
1.1 试验鱼和驯养
本研究使用的黄颡鱼(Pelteobagrusfulvidraco)来自中国湖北省洪湖市水产养殖场(气温约30℃)。包括两种大小:体质量100.58±3.13 g 、体长20.5±0.32 cm;体质量157.35 g±7.16、体长25.33±0.51 cm。试验前,鱼被放在室内循环系统中(气温22℃)饲喂7 d以适应试验条件(黄颡鱼专用饲料购买至通威)。每个养殖桶都有相同数量的鱼,分别在两种水温下暂养:17℃和24℃,其他生活条件一致。养殖水质如下:溶氧、pH分别为6.80±0.14 mg/L和7.15±0.07。光暗周期为12 h:12 h(08:00—20:00)。试验期间没有鱼死亡,并且在实验进行前24 h暂停饲喂,以清空鱼消化道。
1.2 试剂和仪器
茶树精油(Tea oilMelaleucaalternifolia,药用级)、无水乙醇购买至阿拉丁试剂网(上海阿拉丁生化科技股份有限公司);皮质醇、葡萄糖测定都采用商业试剂盒(南京建成生物工程研究所,中国);A-BF高精度线性电源,东莞市不凡电子有限公司;3K15离心机,美国Sigma-Aldric公司;酶标仪SPARK,瑞士Tecan 公司;ISO 900电子分析天平,德国Sartorius 公司;hq40 哈希HACH便携式双路输入多参数数字化分析仪,哈希水质分析仪器(上海)有限公司。
1.3 暂养温度优化
总共25条黄颡鱼(157.35±7.16 g;25.33±0.51 cm)被平均分到5个温度的循环系统中(7.7、12.5、17.2、20.3、24.1℃,实际温度)。暂养7 d后,黄颡鱼经过低温被诱导深度麻醉,紧接着被采集血液进行皮质醇和葡萄糖测定。小循环系统如图1a所示。

图1 低温麻醉系统(a)以及电麻醉系统(b)
1.4 3种麻醉方式的麻醉效果
总共408条黄颡鱼被用于麻醉效果测试,它们被分为4组,包括2种大小(100.58±3.13 g 、20.5±0.32 cm;157.35±7.16 g、25.33±0.51 cm)和2种暂养温度(17℃、24℃)。4组(不同大小×不同温度暂养)黄颡鱼都被用于3种麻醉方式测试(茶树精油、电麻醉、低温麻醉)。每一条黄颡鱼被完全浸没在含有40 L溶液的塑料箱(体积100 L)中观察15 min,整个暴露过程持续充气,15 min后鱼被取出放到80 L的清水中复苏,并记录麻醉时间、恢复时间。所有经过麻醉实验的黄颡鱼都被保留到原来的暂养水箱中,观测3 d内的存活情况。黄颡鱼麻醉分期判断标准如表1所示,改编自Mirghaed 等[22]。麻醉试验水质条件如表2所示,麻醉的水温和暂养温度保持一致,暂养水温来源于1.3节的结果。
其中244条黄颡鱼被用于茶树精油测试,黄颡鱼(n=6)暴露于含有16个不同质量浓度的茶树精油的溶液中(40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190 mg/L)。茶树精油溶液由准确称重的茶树精油母液(茶树精油:无水乙醇为1∶9)均匀混合到40 L水中配置而成。
144条黄颡鱼被用于电麻醉测试,黄颡鱼(n=6)暴露于不同电流强度的自制麻醉系统中(0.18、0.2、0.24、0.26、0.28、0.30 A,30 V)。电麻醉装置如图1b所示。
20条黄颡鱼被用于低温麻醉测试,所有的黄颡鱼都经过同样的降温程序:当水温>10℃时,降温速率为5℃/h;当水温<10℃时,降温速率为1℃/h。每5条黄颡鱼被用于每个麻醉状态测试(4个状态,从轻度镇静到深度麻醉),每条黄颡鱼的诱导水温被记录,随后被取出放入暂养水缸中复苏并记录复苏时间。
1.5 3种麻醉方式持续麻醉过程中应激变化
总共85条在24℃暂养7 d后的黄颡鱼(157.35±7.16 g;25.33±0.51 cm)被用于应激测试。其中75条黄颡鱼被诱导深度麻醉,并在达到麻醉后(3 min)第0、2、4、6、8 分钟被采集血液进行皮质醇和葡萄糖分析。3种麻醉方式条件分别如下:茶树精油的质量浓度为190 mg/L;电麻醉的电流和电压为0.30A和30V;低温麻醉的温度为8℃。
此外,提供一个非应激组(基线组)和过应激组的血糖和血浆皮质醇水平,作为麻醉期间应激水平的比较。5条未处理的黄颡鱼被杀死作为基线组;5条遭受巨大应激的黄颡鱼作为过应激组黄颡鱼被暴露在高速流动的水流中,直到对尾部按压不会爆发游泳并且在取样前保持30 min[13]。
1.6 样品处理和分析
用非肝素化注射器采集血样,血样在25℃静置1 h后经过离心(4℃,4 000 r/min,15 min,离心半径13.5 cm)后取上清液,在-80℃冰箱中保存直到测定应激指标。选取皮质醇和葡萄糖作为应激指标,用酶联免疫吸附法(ELISA)测定血清皮质醇水平。采用葡萄糖氧化酶法测定血清葡萄糖质量浓度。
1.7 数据处理和分析
使用 Microsoft Excel 2019 和用 Graphpad Prism9软件对试验结果进行统计分析和作图。对所有结果进行双因素方差分析(Two-Way ANOVA),并作Tukey多重比较检验,以P<0.05作为差异显著性判断标准。所有结果以箱线图表示,箱线图上限为最高值,下限为最低值,中间线为中位数。

表1 黄颡鱼麻醉分期
2 结果
2.1 黄颡鱼麻醉过程中水质
表2所示的水质结果显示,茶树精油、电麻醉、低温麻醉不会造成水质的剧烈变化,并且3种麻醉方式不会使鱼死亡。
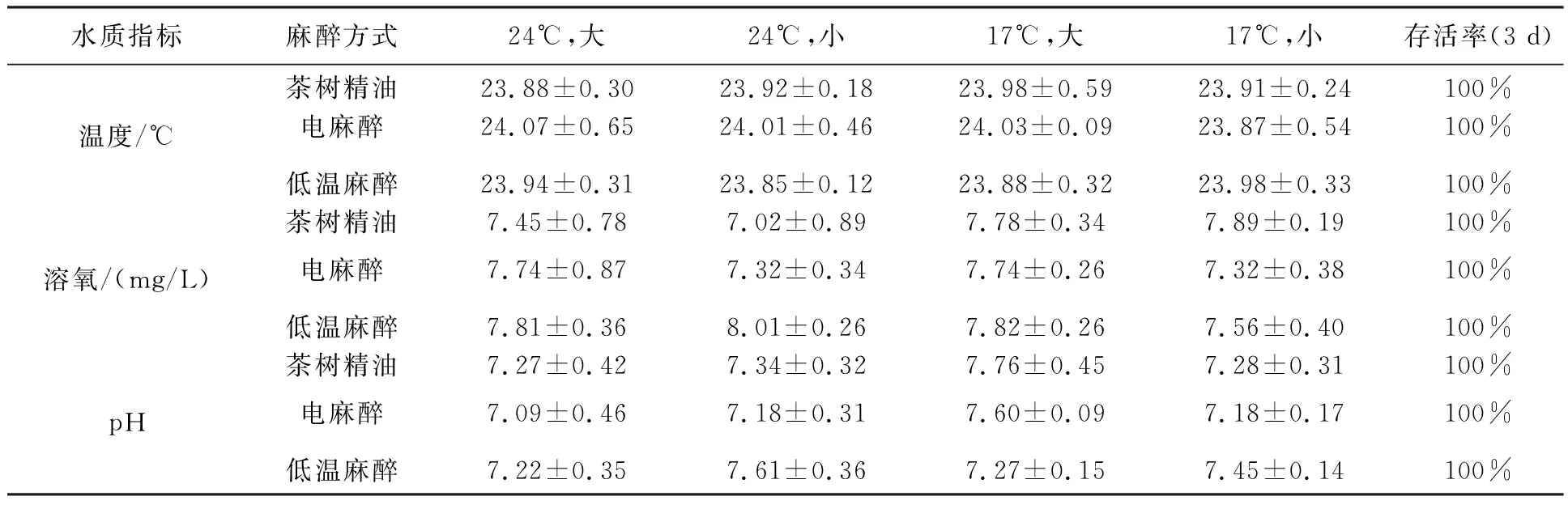
表2 麻醉过程中水质情况以及存活率
2.2 黄颡鱼经过不同温度暂养后皮质醇和葡萄糖水平
如图2所示,暂养温度影响黄颡鱼麻醉后的皮质醇和葡萄糖水平。经过17.2℃暂养的黄颡鱼皮质醇水平最低,而葡萄糖水平最高,意味着17.2℃是最佳的暂养温度。此外,黄颡鱼在7.7℃被麻醉,因此没有暂养7 d后的数值。
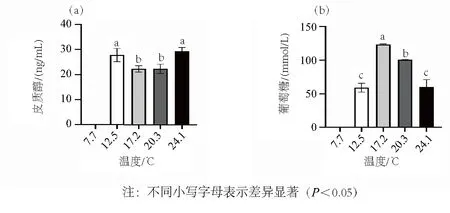
图2 不同温度暂养7 d后经低温麻醉后黄颡鱼的皮质醇(a)和葡萄糖(b)含量
2.3 茶树精油对不同大小和温度暂养黄颡鱼的麻醉效果
如图3所示,茶树精油的质量浓度和不同的组别对黄颡鱼的麻醉以及恢复时间有显著影响(P<0.05)。随着茶树精油质量浓度升高,黄颡鱼的麻醉程度加深,诱导时间变短,恢复时间增加。在17℃时,小个体的黄颡鱼深度麻醉最佳质量浓度为130 mg/L而大的黄颡鱼为190 mg/L;在24℃时,小个体黄颡鱼深度麻醉最佳质量浓度为120 mg/L,大个体最佳为130 mg/L;它们对应的恢复时间分别为:193.25±36.99 s、140.25±29.94 s、174.25±8.44 s、211.75±10.89 s。在面对茶树精油时,黄颡鱼个体越大所需质量浓度以及时间更长,相反,暂养温度越高,黄颡鱼所需质量浓度以及时间更短。此外,研究发现较高温度暂养能够减少不同体质量黄颡鱼所需的茶树精油质量浓度差(从60 mg/L下降到10 mg/L),这可能使不同体质量的黄颡鱼在较短的时间内同时达到所需的麻醉状态。
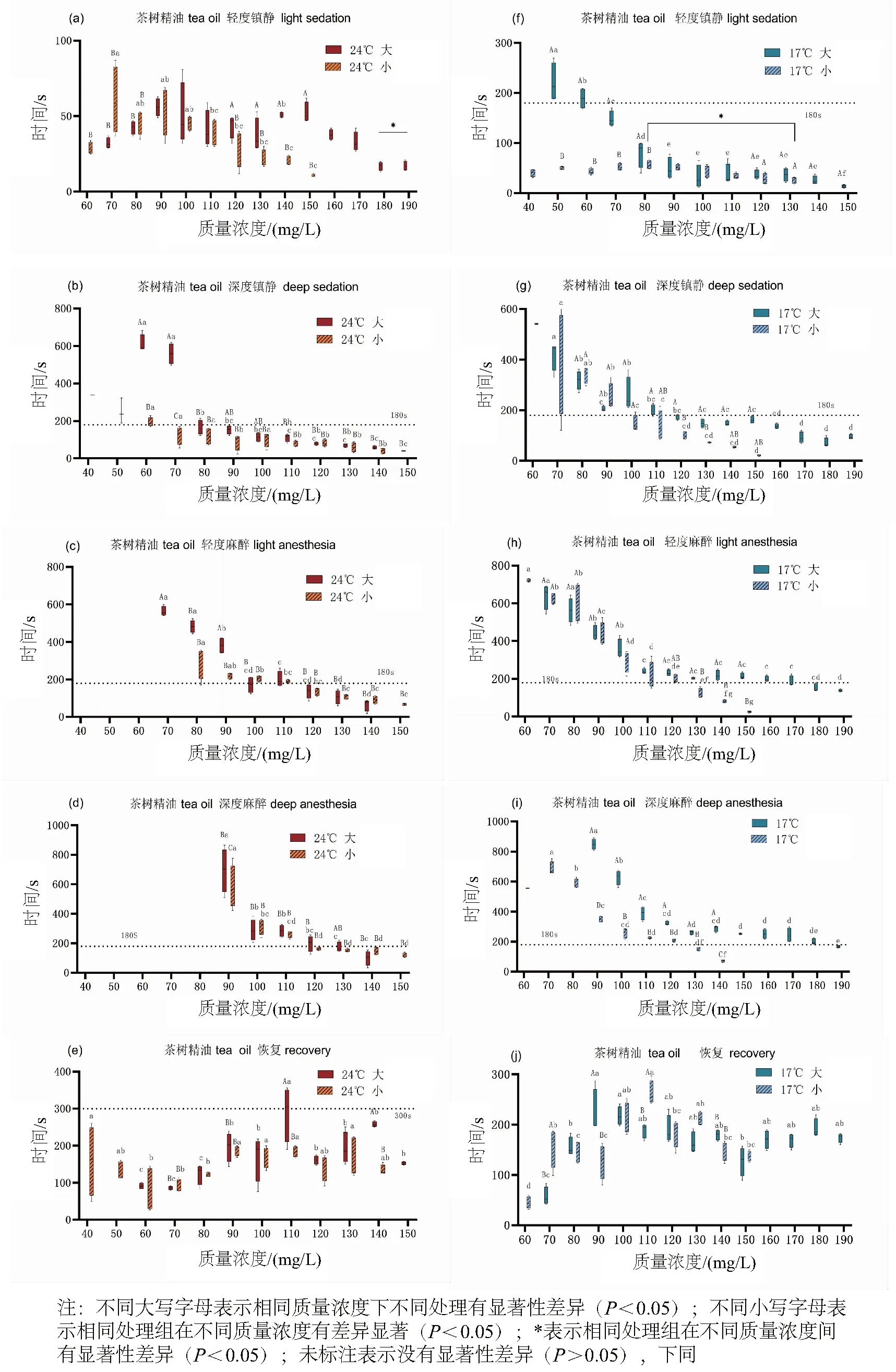
图3 不同大小和不同暂养温度的黄颡鱼在接触不同质量浓度的茶树精油时的麻醉和恢复时间
2.4 电麻醉对不同大小和暂养驯化黄颡鱼的麻醉效果
如图4所示,电流大小和不同的组别对黄颡鱼的麻醉时间有显著影响(P<0.05),而恢复时间没有明显差异(P>0.05)。随着电流大小升高,黄颡鱼的麻醉程度加深,诱导时间变短。在17℃时,小规格的黄颡鱼深度麻醉最佳电流为0.30 A,而大规格的黄颡鱼所需电流>0.30 A;在24℃时,两种个体的黄颡鱼深度麻醉最佳电流为0.30 A;黄颡鱼在0.30 A的恢复时间分别为:173.50±17.10 s、177.25±5.40 s、171.75±8.93 s、165.5±11.01 s。在面对电麻醉时,黄颡鱼个体越大、暂养温度越低所需电流更大,但是他们的恢复时间没有显著性差异(P>0.05)。水中电击需要调整电流强度、持续时间和频率,以达到预期效果。表3列举了最近有关电麻醉的研究,由于电麻醉条件不同,这些结果很难进行比较,但是大部分研究都显示了一个短暂的麻醉时间。
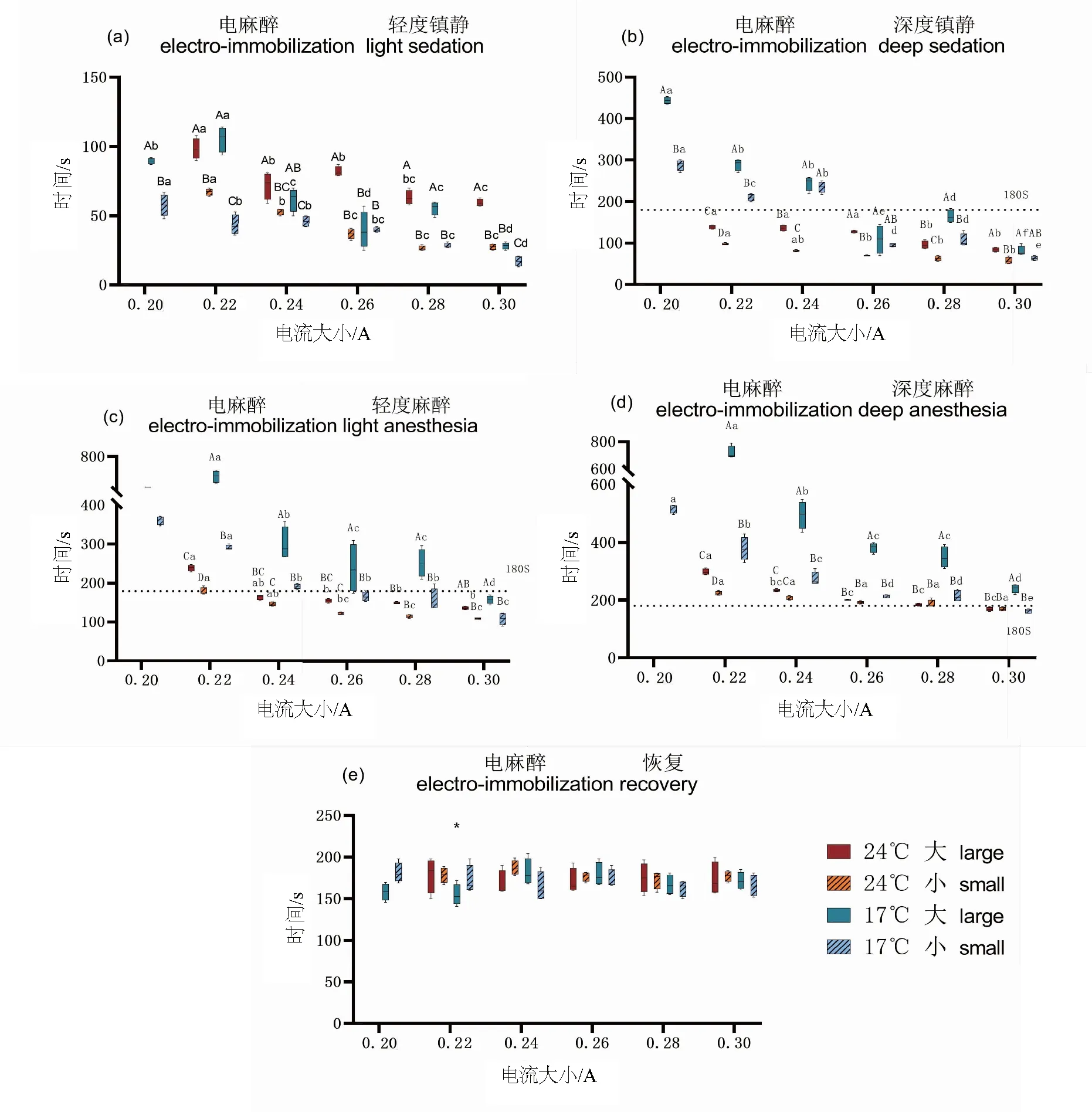
图4 不同大小和不同温度暂养黄颡鱼在接触不同电流后的麻醉(a-d)和恢复时间(e)

表3 本研究和先前的研究在电麻醉效果之间的比较
2.5 低温麻醉对不同大小和暂养驯化黄颡鱼的麻醉效果
如表4所示,不同的组别对黄颡鱼的低温麻醉麻醉温度和恢复时间有显著影响(P<0.05)。不同处理黄颡鱼的低温麻醉区间在6~10℃,并且,随着暂养温度降低以及个体增大,黄颡鱼的低温麻醉区间更低。24℃暂养大个体、24℃暂养小个体、17℃暂养大个体、17℃暂养小个体深度麻醉温度分别为:8.22、8.83、6.26、7.23℃;它们对应的恢复时间分别为:254.50±5.02 s、216.5±7.23 s、278.25±13.16 s、254.25±5.07 s。
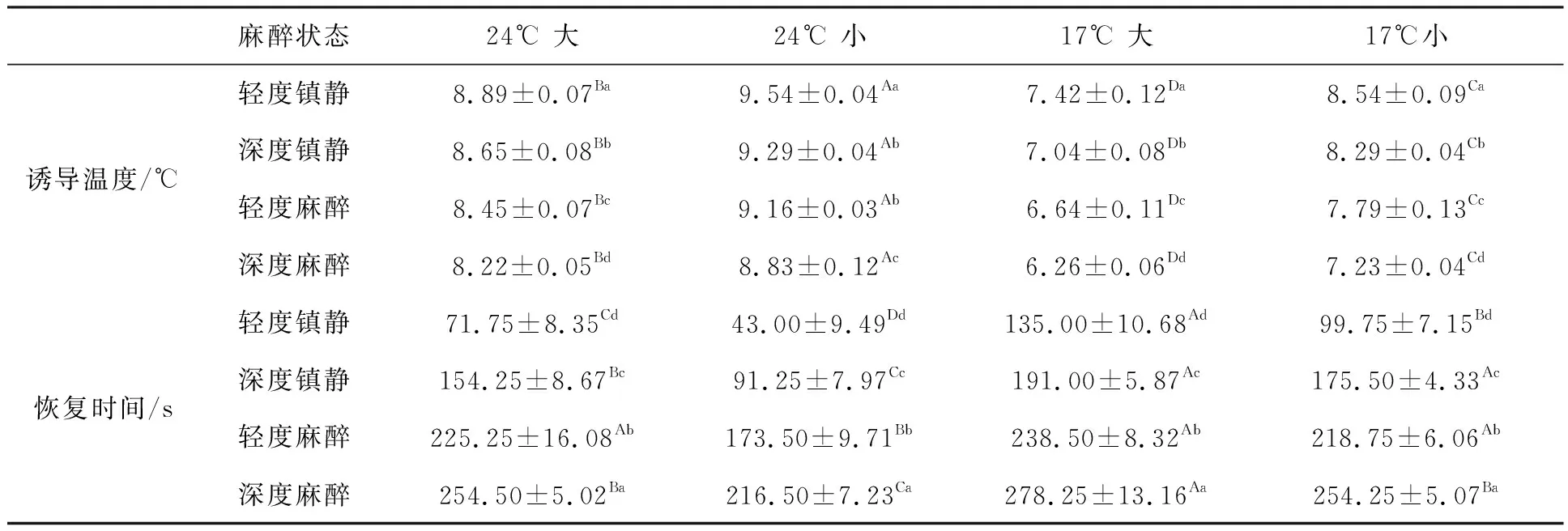
表4 低温麻醉对不同大小和不同暂养温度黄颡鱼的麻醉诱导温度以及对应的恢复时间
2.6 3种麻醉方式持续麻醉过程中应激变化
如图5所示,不同的麻醉方式对皮质醇水平有显著性差异(P<0.05),而对葡萄糖水平没有显著性差异(P>0.05),麻醉的时间对皮质醇和葡萄糖水平都没有显著性差异(P>0.05),但是,不同的麻醉方式和麻醉时间的相互作用对皮质醇水平有显著性差异(P<0.05)。在本研究中,3种麻醉方式的皮质醇和葡萄糖水平随着麻醉时间增加有一个略微增加的趋势,但是低温麻醉一直保持最低的皮质醇和葡萄糖水平。电麻醉的皮质醇质量浓度在9 min时显著升高(P<0.05),茶树精油则变化不大,而低温麻醉在麻醉11 min时显著降低(P<0.05)。此外,电麻醉的葡萄糖水平在11 min时显著高于低温麻醉(P<0.05)。
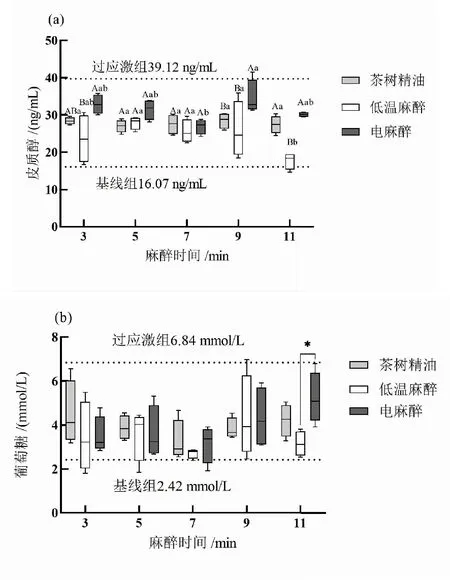
图5 3种麻醉方式持续麻醉过程中皮质醇和葡萄糖水平变化
3 讨论
3.1 3种麻醉方式的麻醉效果
3种麻醉方式都能用于黄颡鱼的麻醉,并且所有麻醉后的鱼都能正常生存。鉴于不同目的需要不同深度的麻醉(例如:有水运输通常使鱼镇静,而手术、无水运输通常使鱼麻醉),本试验记录了轻度镇静、深度镇静、轻度麻醉、深度麻醉所需的诱导时间和恢复时间,这些结果将作为黄颡鱼麻醉条件优化的参考。
最佳浓度是活鱼运输研究中的最主要参数,大多数研究都根据3 mim麻醉、5 min恢复的公认标准来选择最佳的麻醉剂浓度、电流强度从而获得最佳的麻醉效果[28]。麻醉时间以及恢复时间通常受到生物因素(物种、大小等)以及非生物(麻醉剂浓度、温度、pH等)因素的影响。和大多数研究类似,本研究中黄颡鱼的麻醉诱导时间和茶树精油的质量浓度以及电流的大小呈负相关,而恢复时间则呈正相关[29-31]。
在生物因素中,物种和大小在选择最佳质量浓度时被广泛考虑[32-33]。Correia等[34]发现深度麻醉1.03 g的黄尾小丑鱼(Amphiprionclarkii)所需茶树精油质量浓度为200 μ/L,而深度麻醉6.60 g的银鲶[35](Rhamdiaquelen)需要茶树精油质量浓度为300 μ/L,类似地,本研究茶树精油麻醉结果显示,两种温度下100.58 g的黄颡鱼所需茶树精油最佳质量浓度都小于157.35 g的黄颡鱼。以上结果似乎表明体质量越大的鱼所需的茶树精油质量浓度越大。与此相似,本研究电麻醉结果显示,0.30 A的电流能够在3 min内麻醉100.58 g的黄颡鱼却不能麻醉157.35 g的黄颡鱼。此外,Venturini等[36]研究发现深度麻醉498.9 g的罗非鱼(Oreochromisniloticus) 需要10.8 A(205 V)的电流。电麻醉受到体质量大小影响的变化趋势似乎和茶树精油一致。然而,朱挺兵[27]等报道深度麻醉359.10 g的圆口铜鱼(Coreiusguichenoti)仅需要200~225 mA(30 V)的电流。电麻醉的电流大小似乎更受物种影响,因此,关于电麻醉还需要进一步的研究才能做出准确判断。
在非生物因素中,温度是影响麻醉剂最佳质量浓度选取最重要的环境因素之一。先前研究表明,尽管不同物种对麻醉药的反应差异很大,但在较高温度下麻醉,麻醉剂最佳质量浓度有变小的趋势,这可能与鱼类在较高的温度下保持较高的新陈代谢和通气率有关[37-38]。本研究发现相同大小黄颡鱼在17℃所需茶树精油的最佳质量浓度更大,而电麻醉和低温麻醉在17℃所需电流更大,温度更低,这可能和低温时黄颡鱼的抗应激能力以及麻醉机制有关。和先前的研究方法(直接放在不同的水温中麻醉)相比,本研究发现提高暂养温度不仅能降低麻醉剂最佳浓度,提升麻醉的整齐程度,而且还能消除由于温度剧烈变化造成的应激。目前,还没有关于暂养温度对于麻醉效果的研究,这可能是以后的一个研究方向,特别是在使用各种麻醉剂时,因为减少麻醉剂的质量浓度意味着更短的麻醉剂代谢时间。
总之,制定合适的麻醉方案时要充分考虑鱼的种类、大小、以及温度,简单地复制不同物种的麻醉剂使用剂量会导致鱼类死亡或无法达到足够高的麻醉水平。
3.2 3种麻醉方式持续麻醉过程中应激变化
麻醉效率在文献中被广泛报道,然而,很少有研究考虑暴露期间鱼类福利[39]。尽管使用麻醉药被认为可以减少应激,但不受限制的使用可能会引起更大的应激,因为麻醉通过抑制中枢神经系统降低代谢率、影响心肺动力学和降低呼吸频率[4,40]。
在无水保活运输过程中,鱼从接触麻醉到完成打包通常需要一个不确定的时间,鱼麻醉后在麻醉液中继续保留的时间仍然充满争议。然而,很少研究探究鱼类在接触麻醉过程中应激的变化。Wosnick等[41]在对小锯盖鱼 (Centropomusparallelus)的麻醉研究中发现,小锯盖鱼在接触苯佐卡因7 min后皮质醇和葡萄糖水平显著增加,因此推荐麻醉时间为3~6 min。同样的,本结果显示:黄颡鱼在电麻醉9 min后皮质醇水平显著提高,而葡萄糖水平升高显示在11 min,这表明长时间面对电流刺激会增加黄颡鱼应激,因此,本推荐黄颡鱼的电麻醉时间为3~7 min。与电麻醉相反,低温麻醉诱导深度麻醉的黄颡鱼在11 min时皮质醇和葡萄糖水平降低,而茶树精油基本保持不变,这说明在11 min内低温麻醉和茶树精油没有使黄颡鱼的应激变大。同时,低温麻醉在3种麻醉方式中对黄颡鱼造成的应激最小,暗示低温麻醉更加适合黄颡鱼的麻醉。
4 结论
3种麻醉方式都能很好地麻醉黄颡鱼,但是鱼体大小、暂养温度、麻醉方式将影响黄颡鱼麻醉方案的制定;推荐电麻醉的持续时间为3~6 min,而低温麻醉和茶树精油为3~11 min;鉴于低温麻醉造成的应激最小,对规格统一性要求低,推荐低温麻醉作为黄颡鱼的麻醉方式。
□

