林下环境中栽培黑木耳对土壤微生物的影响
曹 君,曾 辉,郭日光,王 红,刘岩岩,李 红,杜 杨,王韦舒,刘俊杰
(1.辽宁省农业科学院食用菌研究所,沈阳 110161;2.辽宁省食用菌优质栽培重点实验室,沈阳 110161;3.辽宁省林业发展服务中心 党政群工作部,沈阳 110031;4.本溪星耳健康科技有限公司,辽宁本溪 117000;5.辽宁省国家新型原材料基地建设工程中心,沈阳 110031;6.辽宁省林业调查规划监测院,沈阳 110031)
黑木耳(Auricularia heimuer
)是我国传统的食用菌应用和栽培品种,随“北耳南扩”生产体系的发展,其栽培区域遍及全国大部分省市,产量占世界的95%以上。赵春艳等统计数据表明,2015~2018年,黑木耳仍然保持在我国食用菌年度总产量的第二位,且在四年间呈持续增长趋势。近年来,随着黑木耳轻简化栽培技术的发展,栽培生产减少了对于棚室等设施的依赖,黑木耳的栽培形式和场地选择趋于多元化发展,其中利用林区优渥小气候环境和林下闲置土地进行黑木耳栽培,发展林-菌模式的林下经济,具有节水、节地,增产、提质等优势,成为现代黑木耳栽培生产模式重要的组成部分。但是,在辽宁地区林下黑木耳实际生产过程中发现,在进行多年的持续生产过程中,经常会出现同一栽培场地病害发生率、杂菌侵染率连年上升,而产量持续下降的现象,这已经影响到林下黑木耳产业的持续和稳定发展。农民在生产中借鉴植物种植业的理论,称之为食用菌的连作障碍。与植物相比,食用菌栽培的“连作障碍”系统性研究较少。一般认为,场地或设施的消毒不彻底或杂菌孢子等病原物经年积累导致的栽培环境恶化所致。余维良等研究发现,旱地连作方式生产黑木耳菌包,一、二、三潮耳采收后,菌包的烂棒流耳率分别为0.9%、2.1%、8%,且在连续生产应用两年以上的栽培场地取样发现,黑木耳烂棒和流耳的情况要高于新场地,产量也相应下降。邢修明等认为,连作性栽培是导致秀珍菇病虫害高发的重要原因。而冀北的平泉、遵化等地区传统的地栽香菇因连作障碍,产量降幅在20%左右,严重的超过25%。蒋时察等观察发现,重茬栽培将提高食用菌生产中粘液病的发病率,通过轮作和套种可一定程度上降低病害发生率。在生产中为缓解或避免食用菌连作障碍对产品质量和产量带来的负面影响,一般采用轮作倒茬、套种等农艺学方法,此外还有化学消杀、阳光曝晒和高温处理等方式方法,如连作平菇通过与葱、蒜等蔬菜套种可以有效提高防病效果,降低粘菌发病率60%。李峰等通过连作、清除污染源及物化消毒等方式净化栽培场地,缓解平菇连作障碍。牛贞福等认为食用菌连作障碍源于环境中有害微生物及其孢子的残留,需要通过对栽培环境、土壤及设施进行充分消毒杀菌处理。杨光等通过利用复合菌群型酵素改良剂净化改良土壤,提高产量香菇6.8%,且高于化学药剂作用效果一个数量级。而在林下黑木耳栽培中通常需要每年更换出耳生产场地以保证出耳质量和产量,潘丕克认为,林下黑木耳应采用闲置老旧栽培场地的方式缓解连作障碍,栽培场地的再次利用应间隔6年。但是与其他食用菌栽培研究相似,林下黑木耳栽培生产的过程与土壤微生物的相互关系和动态变化过程研究尚处于起步阶段,对于连作障碍的解决方式也缺乏足够的针对性。
林地等开放性环境中的微生物由于其营养类型或所处生活史不同阶段的特殊需求,大部分微生物难以进行相对准确的分离和培养、鉴定。近年来,随着高通量测序技术(high-throughput sequencing)的发展,其在土壤微生物多样性,尤其是在羊肚菌、大球盖菇以及竹荪等土壤栽培食用菌与土壤微生态相互作用研究方面的广泛应用得到了快速发展,能够快速、直接、准确地反映环境微生物的丰度及差异。因此,本研究从林下黑木耳生产场地的土壤微生态角度出发,利用高通量测序技术研究黑木耳栽培对于土壤微生物群落结构的影响,并探寻土壤微生态环境的变化与黑木耳连作障碍的关系,以期为有效避免或缓解林下黑木耳连作障碍提供理论基础。
1 材料与方法
1.1 材料与场地
黑木耳试验菌种为“瀚元8 号”,来源于本溪星耳健康科技有限公司。林下栽培场地位于本溪县东营坊乡红土甸村进行。植被主要为以红松、落叶松为主的次生林,郁闭度0.8左右,腐殖层厚度在5~8cm。试验时间为2019~2020年。
1.2 试验设计
试验设计3 个处理:2019 年地摆栽培场地2020 年空闲(L19),连续两年地摆栽培(L20),空白对照(CK)。地摆栽培平整地面后铺设黑白地膜,每平米摆放菌包15 个,吊袋栽培底端菌包距地面50cm,每平方米悬挂菌包50个。每个处理3次重复,共9个小区,每个小区面积667m,田间小区随机排列。出耳管理技术措施按林下黑木耳栽培技术规范进行。
1.3 样品采集和处理
在出耳生产进入中后期的7月中旬雨季后进行土样采集,每个处理组随机选择3个采样点。采样时,去除地表腐殖质和表层浮土1cm,采集深度为10cm,筛除动植物性杂质和碎石块,将每个处理组3 个采样点的样品充分混合后,采用干冰保存后送交上海派森诺生物科技有限公司进行高通量测学和微生物群落多样性组成谱分析。样品测序所用引物为:ITS 引物序列:ITS5F(5’-GGAAGTAAAAGTCGTAACAAGG-3’)和ITS1R(5’-GCTGCGTTCTTCATCGATGC-3’);16S_V3V4 引物序列:338F(5’-ACTCCTACGGGAGGCAGCA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)。
1.4 数据统计与分析
高通量测序结果经质量初筛后按照index和Barcode信息,进行文库和样本划分,并去除barcode序列,进行序列去噪和聚类。对不同处理组在不同物种分类学水平的具体组成进行展示,使用Krona 软件进行群落分类学组成的交互展示。
利用QIIME2(2019.4)软件,使用未抽平的ASV表计算不同处理组土壤微生物Chao1指数表征群落物种丰富度,以Shannon 指数和Simpson指数表征群落物种的多样性。
2 结果与分析
2.1 黑木耳生产对林下土壤细菌群落结构的影响
2.1.1 不同处理对于林下土壤细菌Alpha多样性指数的影响 绘制稀疏曲线(rarefaction curve)确定数据抽平分析过程中样本alpha 多样性变化趋势。由图1 可知,3 组样品的稀疏曲线最终在抽平深度达到25000 后均趋于平坦,表明alpha多样性接近饱和。鉴于alpha多样性指数的大小是与使用的ASV表的抽平深度有关,证明测序结果已足够反映当前样本所包含的多样性,测序深度基本可以包含样品里的所有种类,继续增加已无法检测到大量的尚未发现的新ASV。同时通过该曲线也证明对照组ASV数量远少于L19和L20两个处理组,L19略高于L20。

图1 不同栽培模式条件下林下土壤中细菌Alpha多样性的稀疏曲线Figure1 Rarefaction curve of Alpha diversity of bacteria in forest soil under different
由图2 可知,土壤中细菌的物种丰富度(Chao1 指数)栽培1 年处理组(L19)高于连作2 年组(L20),远高于CK 组,而物种多样性(Shannon 指数、Simpson 指数)L19 与L20 组相近,均远高于CK 组。证明通过1 年或2 年连续的林下黑木耳栽培,土壤中细菌的种类和各种细菌数量的均匀程度均有明显的增加。

图2 不同栽培模式条件下林下土壤中细菌的Alpha多样性指数Figure2 Alpha diversity index of bacteria in forest soil under different cultivation modes
2.1.2 不同处理组中细菌的物种差异与标志物种分析 选择L19、L20、CK 3组样品,在获得序列100%相似水平上聚类获得的细菌ASV丰度数据进行群落分析,根据其在各样本(组)间的有无情况分别统计各个集合的成员数,采用经典韦恩图确定不同组间共有物种和独有物种(图3),也就是各个分组独有的,以及组间共有的ASV的个数。结果表明,L19组和L20组所含有的共有ASV数为2941,不仅明显高于L19/CK组共有ASV数372和L20/CK 组共有ASV 数336,也高于3 组共有ASV 数1044,而L19、L20、CK 3 组独有ASV 数分别为7735、7974、7789。说明3组共有ASV数和任意两组共有ASV数均明显低于3组分别独有ASV数,表明3组样品相似性较低。

图3 基于ASV水平的韦恩图Figure3 Venndiagram based on ASV
2.1.3 不同处理组林下土壤中细菌分类学组份分析 由图4可知,在总组分占比中,栽培黑木耳后,L19和L20两组林下土壤中的Proteobacteria(变形菌门)细菌占比约下降6%;L19 组Actinobacteria
(放线菌)类比CK 下降3.3%,L20 组上升2%;L19 组Verrucomicrobia
(疣微菌门)类比L20 和CK 均提高7%;L19 组和L20 组的Rokubacte⁃ria
和Nitrospirae
(硝化螺旋菌门)与CK相比有明显增加。
图4 不同栽培模式条件下林下土壤中细菌分类学组份分析Figure4 Analysis of bacterial taxonomic components in forest soil under different cultivation modes
由图5~图7 可知,CK 组中优势菌种为Proteobacteria
(变形菌门)中Alphaproteobacteria
(α
-变形菌纲)占比29%,其中Rhizobiales
(根瘤菌目)占比16%,其余种类中,Acidobacteriia
(酸杆菌门/嗜酸杆菌纲)占比17%,Gammaproteobacteria
(变形菌门/γ
-变形菌纲)占比10%,Actinobacteria
(放线菌门/放线菌纲)占比6%,Verrucomicrobiae
(疣微菌门/疣微菌纲)占比6%,Deltaproteobacteria
(变形菌门/δ
-变形菌纲)占比5%;L19组中,优势菌种为Proteobacteria
(变形菌门)中Alphaproteobacteria
(α
-变形菌纲)占比25%,其中Rhizobiales
(根瘤菌目)占比19%,其余种类中,Verrucomicrobiae
(疣微菌门/疣微菌纲)占比14%,Gammaproteobacteria
(变形菌门/γ
-变形菌纲)占比9%,Acidobacteriia
(酸杆菌门/嗜酸杆菌纲)占比8%,Deltaproteobacteria
(变形菌门/δ
-变形菌纲)占比5%;L19组中,优势菌种为Proteobacteria
(变形菌门)中Alphaproteobacteria
(α
-变形菌纲)占比23%,其中Rhizobiales
(根瘤菌目)占比17%,Gammaproteobacteria
(变形菌门/γ
-变形菌纲)占比10%,Verrucomicrobiae
(疣微菌门/疣微菌纲)占比7%,Acidobacteriia
(酸杆菌门/嗜酸杆菌纲)占比7%,Thermoleophilia
(酸杆菌门/Thermoleophilia
)占比5%,Deltaproteobacteria
(形菌门/δ
-变形菌纲)占比5%。表明黑木耳栽培导致林下土壤中细菌的组成存在一定变化,但优势细菌的种类并没有明显的改变,不同的菌种在总量中的占比存在一定的变化。
图5 CK组土壤细菌Krona物种组成图Figure5 Krona species composition map of soil bacteria in CK group

图6 L19组土壤细菌Krona物种组成图Figure6 Krona species composition map of soil bacteria in L19 group

图7 L20组土壤细菌Krona物种组成图Figure7 Krona species composition map of soil bacteria in L20 group
2.2 黑木耳生产对林下土壤真菌群落结构的影响
2.2.1 不同处理对于林下土壤真菌Alpha多样性指数的影响 由图8 可知,3 组样品的稀疏曲线最终在抽平深度达到20000 后即趋于平坦,表明Alpha 多样性接近饱和,证明测序结果已足够反映当前样本所包含的多样性,测序深度基本可以包含样品里的所有种类,继续增加已无法检测到大量的尚未发现的新ASV。同时通过该曲线也证明在真菌多样性方面ASV数量CK>L19和L20。

图8 不同栽培模式条件下林下土壤中真菌Alpha多样性的稀疏曲线Figure8 Rarefaction Curve of Alpha diversity of fungi in forest soil under different cultivation modes
由图9 可知,土壤中真菌Chao1 指数CK>L19>L20,而Shannon 指数和Simpson 指数变化规律相同,均为L19>CK>L20。说明黑木耳生产显著降低了土壤中真菌物种丰富度,且连续栽培会进一步减低物种多样性,但是一年栽培后空闲土壤中(L19)不同种类真菌的数量均衡度要略高于空白对照组(CK),而远高于持续连作组(L20),表明在栽培过程中,优势真菌(黑木耳)对其余真菌种类的持续抑制作用消失后,土壤中空余大量生态位,可以满足残存真菌充分增殖。
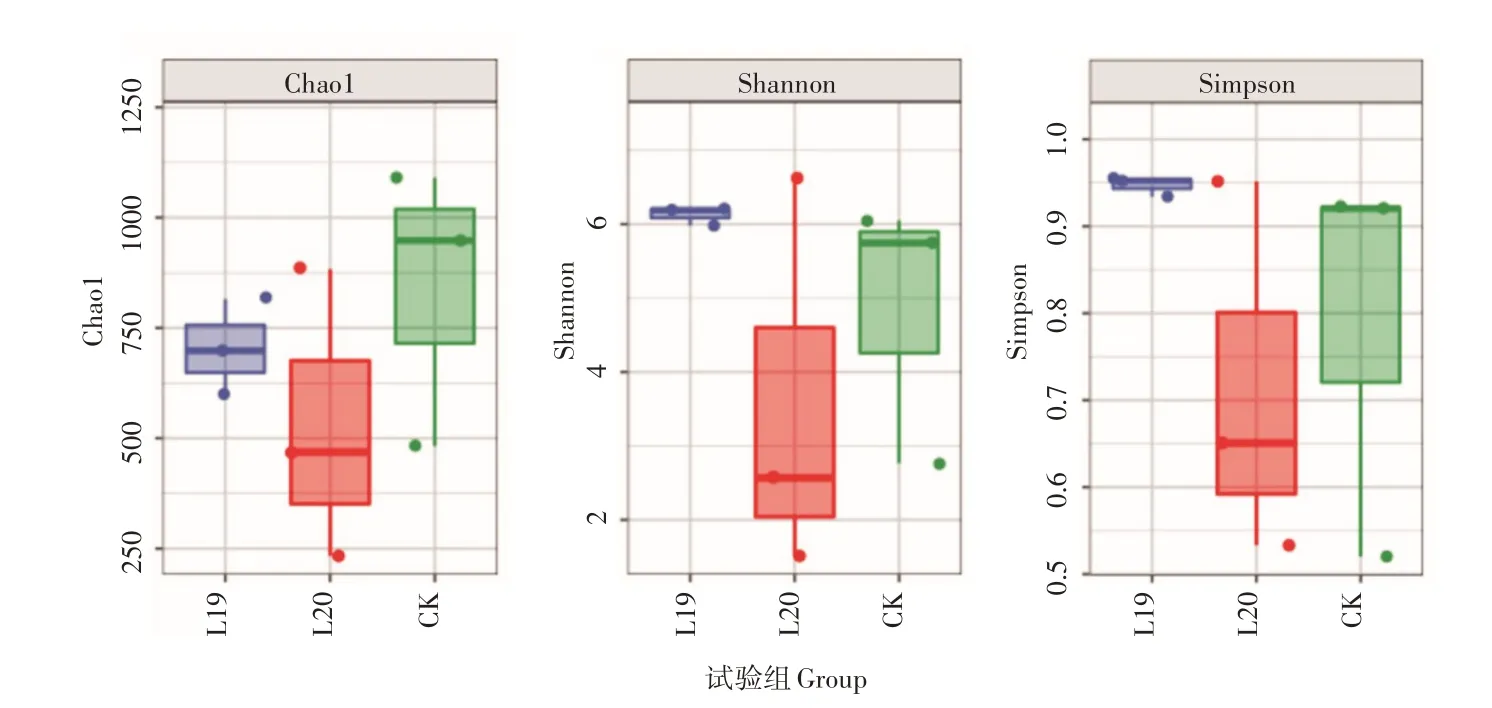
图9 不同栽培模式条件下林下土壤中真菌的Alpha多样性指数Figure9 Alpha diversity index of fungi in forest soil under different cultivation patterns
2.2.2 不同处理组中真菌的物种差异与标志物种分析 选择L19、L20、CK 3 组样品,在获得序列100%相似水平上聚类获得的真菌ASV 丰度数据进行群落分析。根据经典韦恩图(图10),L19、L20、CK 3 组独有ASV 数分别为1215,809,1690,其中,L19组和L20所含有的共有ASV数为247,高于L19、L20分别与CK组的共有ASV数144 和93,而3 组共有ASV 数为166。结果表明,3 组样品相似性较低,差异性较大,但L19 和L20 之间的相似性要高于它们与CK相似性。

图10 基于ASV水平的韦恩图Figure10 Venndiagram based on ASV
2.2.3 不同处理组林下土壤中真菌分类学组份分析 由图11可知,在总组分占比中,Basidiomycota
(担子菌)在L20 组和CK 组均为绝对优势种类,在组内中分别占75.02%和61.39%。而L19 组中Ascomycota
(子囊菌门)和Mortierellomycota
(被孢霉门)类真菌大量增加,分别占总量的31.56%和35.21%;而Basidiomycota
占比下降至18.8%,仅为CK 和L20 组数值的25%~30%。表明黑木耳栽培对于土壤中真菌的种类影响十分剧烈,且即使在停止栽培后,也会产生持续的变化。
图11 不同栽培模式条件下林下土壤中真菌分类学组份分析Figure11 Analysis of fungal taxonomic components in forest soil under different cultivation modes
2.2.4 不同处理组林下土壤中真菌物种组成分析 由图12~图14 可知,在CK 组担子菌99%以上为Agaricomycetes
(伞菌纲),其中Atheliaceae
(阿太菌科)占担子菌的55%,Thelephorales
(革菌目)占20%,Agaricales
(伞菌目)占10%,Sebacinales
(蜡壳耳科)占8%;子囊菌中41%为Pezizales
(盘菌纲),36%为Sordariomycetes
(粪壳菌纲);L19 组担子菌90%中为Agaricomycetes
(伞菌纲),9%为Tremellomycetes
(银耳纲)。其中伞菌纲40%为Atheliaceae
,34%为Auriculariales
(木耳目),且所有检出种类均为Auricularia heimuer
(黑木耳);L20 组中99%为Agaricomycetes
(伞菌纲),其中93%为Auriculariales
(木耳目)且检出种类均为Auricularia heimuer
(黑木耳)。仅以真菌总检出量计算,正在黑木耳栽培进行中的L20组Auricularia heimue
(黑木耳属)真菌处于绝对的优势地位,占真菌总数的69%,占担子菌总数的92%。而栽培一年闲置后的L19组中Auricularia heimue
的数量迅速下降,仅占真菌总数的6%,担子菌总数的31%,而受此影响,L19组中担子菌总数也仅占真菌总数的18.8%,远低于CK 组中担子菌占比的61.39%。而作为典型木腐菌的Auricularia heimue
并未在CK 组中出现,又证明了L20组中大量存在的Auricularia heimue
均为进行黑木耳栽培对林下土壤自然微生态环境所造成的人工干预结果,并在一定程度上压缩了子囊菌的数量,且这种干预随栽培活动的停止而发生进一步改变,即如图5 和图6 所显示的一样,可能由于黑木耳栽培过程中,人工引入的Auricularia heimue
挤占大量担子菌生态位,而黑木耳栽培等人工干预结束后,随Auricularia heimue
因营养条件不适合而自然消退时,子囊菌和球囊菌比原有担子菌更容易占据空闲出来的生态位,导致L19组子囊菌和球囊菌大量增加。
图12 CK组土壤真菌Krona物种组成图Figure12 Species composition of soil fungi Krona in CK group

图13 L19组真壤细菌Krona物种组成图Figure13 Species composition of soil fungi Krona in L19 group

图14 L20组土壤真菌Krona物种组成图Figure14 Species composition of soil fungi Krona in L20 group
此外,在CK组中,Trichoderma
(木霉属)占真菌总检出量的0.7%,L19组中为2%,而L20组中为0.9%,表明黑木耳的主要病害“绿霉病”的病原菌Trichoderma
在黑木耳林下栽培过程中存在增加的现象。若排除栽培直接引入的Auricularia heimue
的影响,则L19组Trichoderma
占比达到2.13%,而在L20中占比则提高到2.9%,分别为CK组的3倍和4倍,表明持续的黑木耳栽培及其过程中人为造成的高湿环境会提高“绿霉病”病原菌的总量。3 讨论与结论
食用菌栽培作为农业生产的一部分,和其他植物类作物栽培相同,其生长和繁殖过程中同样与自然生态环境存在着不可分割的相互依赖和相互作用的密切关系。羊肚菌生长过程中,通过对生境土壤微生物的检测,可以发现恶臭假单胞菌属Pseudomonas putida
、假单胞菌属Pseudomonas
等微生物的存在与其菌核形成、原基分化和子实体形成等生育周期相关,且这些微生物会在羊肚菌的栽培过程中存在相当程度的增加,而羊肚菌栽培生产也会在一定程度上降低其生境土壤中的真菌多样性。龚赛研究表明,林下环境中大球盖菇的栽培生产将显著增加土壤中好氧细菌、丝状真菌、放线菌的数量,且隔年栽培两年土壤样本中这些微生物的增加量要显著高于当年“生地”栽培的土壤样本数据。史静龙研究证明,棘托竹荪栽培土壤中的细菌多样性指数明显高于对照组,其菌群结构及物种组成也有明显变化。但是研究发现即使是同种食用菌栽培对于土壤微生物的影响也会因生境不同也产生很大的变化,如众多研究都表明羊肚菌根际土壤微生物的真菌生物多样性在不同的生长环境条件下存在明显的差异性,而野生羊肚菌土壤真菌多样性也明显高于人工栽培羊肚菌,这种情况可能与其生境条件的原有复杂程度有关。出于栽培技术和模式的差异性,林下环境中黑木耳栽培与栽培环境的这种相互关系与羊肚菌和竹荪等土壤栽培食用菌相比存在明显差异,没有通过直接“根系”于土壤及其中的微生物进行直接的相互作用,但在栽培过程中,菌丝的“逃逸”生长、分生孢子、出耳时弹射扩散的孢子以及人为创造的高湿条件和菌包本身产生的生物热能,均会在一定程度上不可避免的改变土壤的微生物环境及物种多样性,这将是导致黑木耳栽培“连作障碍”现象产生的一个非常重要的因素。在传统黑木耳生产所采用的大田露地栽培模式中,通过间歇期的自然日光曝晒即可实现杀菌消毒的目的,降低病原菌的积累,但林下环境在光照、通风等方面的特殊性和植被的复杂性,导致其自我修复能力与大田相比存在很大不足,本研究即证明林下环境中黑木耳栽培对于土壤微生物的影响也会更为明显,在细菌的物种丰富度和多样性方面均有明显的上升,但在门一级的生物分类系统中,对于林下土壤中优势细菌的种类并没有明显的改变,这与史静龙对于棘托竹荪的研究结果相近;在真菌方面,则由于黑木耳生产导致相关菌丝、孢子在土壤中存在挤占原生真菌生态位的现象,对于真菌物种丰富度的影响更为明显,而正处于黑木耳栽培周期内土壤中由于黑木耳孢子和菌丝的大量而持续的存在,真菌的物种多样性相应的呈现出明显的降低态势,这与VUORINEN 等和陈诚等对于羊肚菌的研究结果相似。但生产后处于闲置状态的区域,由于土壤中黑木耳菌丝的快速消退,直接促进了球囊菌和子囊菌的快速和大量增殖,导致真菌多样性快速恢复至相对较高的水平,甚至高于对照组。即在对照、连作和栽培后闲置区域内,根据黑木耳栽培这种人为干预的存在与否,土壤的真菌多样性出现相应的直接和间接变化。
此外,在实际生产中,黑木耳主要病害类型包括生理性病害、真菌性病害、细菌性病害和虫害,且各种病害相互交叉依存,在菌包的直观表现中主要以真菌性病害较为明显。崔红丽从污染的黑木耳菌包中分离获得15属24种真菌,主要为木霉属、青霉属、曲霉属和镰孢菌属,但在出耳阶段主要是以“绿霉病”为主,这与本研究不同处理组中木霉属真菌的含量变化相吻合,也与实际生产中连作黑木耳菌包绿霉感染率上升相吻合。
综上所述,本研究表明林下环境中黑木耳栽培对于土壤微生物的影响存在持续性和动态变化的特点,至于这种变化会持续多久以及对于后续生产的影响,换言之经黑木耳栽培这种人工干预后,林下环境土壤微生态需要多久才会恢复至干预前相似水平,还需进一步的研究。

