蒙古栎QmMYC基因家族鉴定及其干旱胁迫下表达分析
王天宠,艾万峰,刘汉嶂,刘 琳,马素娟,陆秀君
(沈阳农业大学林学院,沈阳 110161)
bHLH蛋白是植物中最大的转录调控家族之一。髓细胞组织增生蛋白(myelocytomatosis proteins,MYCs)亚家族属于bHLH 蛋白的IIIe 亚组。MYCs 参与多种过程,包括花青素、色氨酸等次生代谢产物的合成;调控种子萌发、花的发育、气孔分化、植物表皮细胞和根毛发育;参与茉莉酸、脱落酸、光敏色素介导的信号通路;也在调节病原、高盐、干旱和低温等非生物胁迫耐受性方面发挥关键作用。
近来,越来越多的MYC
基因在多种植物中被鉴定并验证。MYC2
最早是从拟南芥(Arabidopsis thaliana
)中被鉴定到的,到目前为止已经得到了较为全面的研究,其中MdMYC2
参与苹果(Malus pumila
Mill.)花青素的生物合成,CrMYC2
可以调控长春花(Catharanthus roseus
L.)生物碱的合成,PuMYC2
促进大青杨(Populus ussuriensis
Kom)不定根生长并抑制主根形成,BcMYC2
转录因子在北柴胡(Bupleurum chinense
DC.)中可响应茉莉酸信号,与拟南芥AtMYC2
同源性较高的GhMYC4
基因可以提高陆地棉(Gossypium hirsutum
Linn.)对高盐和干旱的耐受性。此外,拟南芥中AtMYC1
是毛状体和根毛发育的重要调节因子,AtMYC3
和AtMYC4
共同发挥作用来调节创伤诱导的茉莉酸积累,AtMYC2
和AtMYC4
在蓝光下正向调节次生细胞壁增厚,与At-MYC2
高度相似的MYC
家族转录因子AtJAM1~3
,是在茉莉酸信号中对AtMYC2
起拮抗作用的因子,在拟南芥中调节多种代谢途径。蒙古栎(Quercus mongolica
Fisch.ex Ledeb.),又称柞树,是壳斗科(Fagaceae)栎属(Quercus
)高大乔木,广泛分布于俄罗斯远东、日本群岛、朝鲜半岛、中国东北和华北等地,是我国东北次生落叶阔叶林的主要建群树种。蒙古栎是一种旱生植物,对干旱表现出很强的耐受性,但其在干旱胁迫条件下的分子响应机制还鲜有报道。MYC
基因可以参与植物的干旱胁迫响应,鉴定和保存这些干旱响应基因对于丰富基因库和未来在干旱研究中的应用具有重要意义。本研究基于蒙古栎基因组数据,利用生物信息学方法鉴定了QmMYC
基因家族成员,并对其理化性质、系统进化、结构特点、染色体位点、启动子顺式作用元件、组织表达性及蒙古栎叶片在模拟干旱胁迫下的基因表达规律进行分析,为深入探究蒙古栎QmMYC
基因家族的生物学功能及其响应干旱胁迫的分子机制提供参考。1 材料与方法
1.1 材料
于2020 年秋在辽宁省抚顺市清原县蒙古栎天然林分采集蒙古栎(Quercus mongolica
Fisch.ex Ledeb.)种子,经敌敌畏密闭杀虫24h 后,播种于盛有基质为V∶V∶V=3∶1∶1 的无纺布容器(高19.0cm,宽12.0cm)中,置于温室内培养,苗期每隔一周浇1L 1/2Hoagland 营养液,至基质完全润湿。出苗后约40d,挑选长势一致的健壮幼苗(苗高20~25cm),洗净根部泥土,移入装有1/2Hoagland营养液的塑料桶中适应2d。1.2 方法
1.2.1 苗木处理 将适应2d 的蒙古栎幼苗取出,用纱布吸干根部水分,分别转入装有300mL 对照组(1/2Hoa⁃gland 营养液)和处理组(含有10%PEG6000 的营养液)的塑料小桶(高17.0cm,直径6.0cm)中,分别于水培0,6,12,24,48,72h后取蒙古栎叶片作为样品,每份样品取自3株。所采新鲜叶片液氮速冻后于−80℃超低温冰箱保存。分别用多糖多酚植物RNA 提取试剂盒M5 Hiper Plant RNeasy Complex Mini Kit(聚合美)和TransScript One−Step gDNA Removal and cDNA Synthesis SuperMix(全式金)试剂盒提取蒙古栎叶片RNA,进行反转录。
1.2.2QmMYC
基因家族成员的鉴定 基于蒙古栎基因组数据,以拟南芥AtBHLH
家族中的AtMYC
亚家族序列为查询序列,运行TBtools的本地检索程序,筛选阈值设为1×10,初步获得候选QmMYC
基因家族成员。用NC⁃BI 的blastp 比对候选蛋白序列,根据注释信息筛选出QmMYC
家族相关基因,再使用Pfam 数据库(http://pfam.xfam.org/)的隐马尔可夫模型(HMM)配置文件确认MYC 典型蛋白结构域序列号(PF00010、PF14215),由HMM SEARCH 使用默认参数(E
≤1.2×10) 手动筛选进一步验证并确定最终的候选QmMYC 蛋白。用NCBI CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蒙古栎MYCs 保守结构域,并用DNAMAN 软件进行多序列比对。1.2.3 系统发育分析 基于BLASTP(E
<1e−5)结果,利用MEGA7.0软件通过邻接法(NJ)构建MYC蛋白系统发育进化树,设置bootstrap值为1000。1.2.4 蛋白质的理化性质及亚细胞定位分析 用ExPaSy 网站(https://web.expasy.org/protparam)分析蒙古栎QmMYC
家族分子量、等电点等理化性质和二级结构。用Plant−mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant−multi)在线软件预测蒙古栎QmMYC蛋白的亚细胞定位。1.2.5 基因结构预测和保守基序分析 运用Tbtools 软件分析蒙古栎QmMYC
基因家族成员内含子外显子结构;用SWISS−MODEL 网站(https://swissmodel.expasy.org/interactive)预测蒙古栎QmMYC
基因家族蛋白三级结构;蛋白保守结构域由MEME(https://meme−suite.org/meme/tools/meme)预测,最大基序数为10。1.2.6 染色体定位分析 利用HMM 3.0软件从蒙古栎的基因组注释信息中获取QmMYC
基因在染色体上的起始位置信息,通过每2 个QmMYC
基因之间的BLASTP 比对结果获取基因同源复制事件,最后利用TBtools 将染色体定位和比对结果可视化。1.2.7 启动子顺式作用元件分析 利用TBtools工具提取蒙古栎MYC
基因转录起始点上游启动子序列,提取长度为2000 bp,通过PlantCARE 网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)得到蒙古栎MYC
基因家族顺式作用元件分析结果,并利用TBtools工具将结果可视化。1.2.8QmMYC
基因家族的表达分析 基于转录组(RNA−seq)数据,利用BLAST 比对获取蒙古栎QmMYC
基因同源转录组序列,进而获取QmMYCs
在蒙古栎根、茎、叶中的表达量,热图利用TBtools 绘制。参照天根Super⁃Real 荧光定量试剂盒说明书,采用qRT−PCR 分析QmMYCs
在蒙古栎叶中的表达模式。使用软件Primer5 设计定量引物(序列见表1),扩增片段在100~250bp,选用蒙古栎EF1β
基因为内参基因,采用2法计算各基因的相对表达量。3次生物学重复。表1 引物列表
Table1 The list of primer sequences
2 结果与分析
2.1 QmMYC基因家族成员的鉴定
通过Pfam和NCBI CDD分析,11个预测的QmMYC
基因从蒙古栎基因组中被鉴定出来,并分别命名为Qm-MYC1
~11
。由图1可知,所有鉴定到的QmMYC
基因均含有bHLH–MYC_N和HLH两个保守结构域。
图1 QmMYC基因家族保守结构域Figure1 Conserved domain of QmMYC gene family
2.2 QmMYC基因家族蛋白理化性质、二级结构和亚细胞定位预测
由表2 可知,该家族成员的CDS 长度在1293 bp(QmMYC9
)~2139 bp(QmMYC1
)之间,氨基酸数在430aa(QmMYC9)~712aa(QmMYC1)之间;相对分子质量在48~79KDa之间,与氨基酸数呈正相关;理论等电点(pI)介于4.96(QmMYC7)~8.33(QmMYC3)之间,除QmMYC3 以外,均为酸性蛋白;该家族成员不稳定指数均大于40,且平均疏水指数为−0.734~−0.32,说明其均为不稳定蛋白和亲水性蛋白。二级结构分析显示,蒙古栎MYC
转录因子家族蛋白均由α−螺旋,延伸链和扩展链无规则卷曲3 种形式组成,且除QmMYC1/2 蛋白的二级结构中无规则卷曲占比最大外,其余蛋白均是延伸链占比最大,α−螺旋次之,而无规则卷曲占比最小。亚细胞定位预测表明,蒙古栎QmMYC
基因家族成员均定位在细胞核。表2 蒙古栎基因家族成员信息
Table2 Information on members of gene family in
2.3 QmMYC基因家族系统进化分析
根据11 个QmMYC 蛋白的同源比对分析,得到欧洲栓皮栎(Quercus suber
Linn)、加州白栎(Quercus lobata
Nee)、胡桃(Juglans regia
L.)等共27个物种的71个MYC 蛋白氨基酸序列,构建系统发育树。由图2可知,所有MYC蛋白共分为4个组。其中,组Ⅰ中包含QmMYC9/11,与拟南芥AtAMS聚在一起;组Ⅱ中包含QmMYC1/5/7/8,与拟南芥AtTT8、AtMYC1、AtEGL3聚在一起;组Ⅲ包括QmMYC3/4/6,与拟南芥AtNIG1和AtMYC2/3/4处于同一组;组Ⅳ包括QmMYC9/11,与AtJAM1/2/3 处于同一组。此外,QmMYC4 与欧洲栓皮栎亲缘关系最近;除Qm⁃MYC4外,其余QmMYC蛋白均与加州白栎亲缘关系最近。
图2 MYC基因家族系统进化树Figure2 Phylogenetic tree analysis of MYC gene family
2.4 QmMYC基因家族蛋白三级结构预测
由图3可知,QmMYC3/6、QmMYC2/10有高度相似的蛋白质三级结构,且QmMYC3/6与QmMYC4也有较为相似的蛋白质三级结构,其余成员的蛋白三级结构各不相同,可能是因为蛋白二级结构中α-螺旋、延伸链、不规则卷曲的不同导致空间折叠的不同。

图3 蒙古栎QmMYC蛋白的三级结构预测Figure3 Tertiary structures prediction of QmMYC protein in Q.mongolica
2.5 QmMYC基因家族基因结构分析
不同QmMYC
成员之间内含子和外显子的长度、位置和数目都有一定差异,说明在进化过程中,蒙古栎QmMYC
家族存在一定分化。QmMYC11
的外显子和内含子数量最多,分别为8 个和7 个;QmMYC5
/8
/9
均含有6 个外显子和5 个内含子;QmMYC1
/7
存在7 个外显子,6 个内含子;QmMYC3
存在3 个外显子和2 个内含子;QmMYC4
/6
/10
均含有2个外显子,1个内含子;而QmMYC2
只有外显子,没有内含子。
图4 QmMYC家族基因结构分析Figure4 Gene structure analysis of QmMYC family
2.6 QmMYC基因家族保守基序分析
由图5A 可知,亲缘关系越近的蛋白,Motif 分布的种类、数量和位置越相似。只有QmMYC5 和QmMYC8 蛋白含有全部10 个Motif,QmMYC7 含有除Motif8 以外的其他Motif,QmMYC1/4 含有7 个Motif,QmMYC3/6/10/11含有6 个Motif,QmMYC2 和QmMYC9 分别仅含有5 个和4 个Motif。N 端全部为Motif5,该氨基酸保守结构可能与顺式作用元件结合;C端全部为Motif3,且Motif1在所有成员中均存在,具有高度保守性。

图5 QmMYC基因家族各保守基序特征Figure5 Characteristics of conserved motifs of QmMYC gene family
2.7 QmMYC基因家族染色体定位分析
由图6 可知,该家族的11 个成员不均匀地分布在蒙古栎的6 条染色体上,其中QmMYC3
、QmMYC9
和Qm-MYC10
分别位于2,3,4号染色体上,QmMYC6
/7
位于8号染色体上,QmMYC11
位于11号染色体上,QmMYC4
/1
/5
/8
/2
位于12号染色体上。此外,QmMYC2
和QmMYC5
来自散在重复,其他基因均来自于全基因组复制事件。
图6 QmMYC基因家族的染色体定位Figure6 Chromosome location of QmMYC gene family
2.8 QmMYC基因家族启动子顺式作用元件分析
由图7 可知,所有QmMYCs
均含有多个光响应元件和厌氧响应元件;QmMYC2
/3/6
/7
中含有防御和逆境响应元件;在QmMYC1
/3
/11
中检测到了低温响应元件;54.5%的家族成员中含有干旱响应元件;除了QmMYC5
外,各家族成员均含有激素作用元件,包括生长素、水杨酸、脱落酸、茉莉酸甲酯、赤霉素作用元件及玉米素代谢调节元件;QmMYC3~9
中含有分生组织表达元件;QmMYC4
/6
/7
中存在胚乳表达响应元件;只有QmMYC10
/11
中分别含有细胞周期调控元件和种子特异性调控元件。QmMYCs
启动子区域预测到了与干旱、激素、防御和逆境调控等相关的顺式作用元件,因此可以推测QmMYCs
在植物的生长发育、信号转导等过程中起着重要的作用,可以通过相关的顺式作用元件调控下游效应基因。
图7 QmMYC基因家族启动子顺式作用元件分析Figure7 Cis-elements analysis of QmMYC gene family promoters
2.9 QmMYC基因家族组织特异性表达分析
由图8 可知,QmMYC1
/2
/4
/10
在蒙古栎3 个组织中表达量均较高,其中QmMYC4
各组织表达量最高,而QmMYC3/5/8/9/11
在初始状态下各个组织中均有较低的表达丰度。QmMYC6
在茎中表达最多,其余QmMYC
均是在根中表达最多。QmMYC
基因家族成员在不同组织表达均存在差异性,暗示其基因功能存在分化。
图8 QmMYC基因家族在蒙古栎根、茎、叶中的表达分析Figure8 Expression analysis of QmMYC gene family in root,stems and leaves of Q.mongolica
2.10 干旱胁迫下QmMYCs的表达模式
由图9 可知,除QmMYC11
外,其他QmMYCs
均受到干旱胁迫的显著影响。10%PEG6000 处理6h 时,蒙古栎叶片中QmMYC5
/8
/9
表达量达到最高,说明其在胁迫6 h时共同发挥作用抵抗干旱,其中QmMYC8
增加最多,为对照的6.08 倍;处理12h 时,蒙古栎叶片中Qm-MYC1/3/4
/6
/7
表达量达到最高,其中QmMYC4
增加最多,为对照的11.99倍,说明其是10%PEG6000模拟干旱胁迫最主要的响应基因;24h 时,QmMYC2
/10
表达最多,分别为对照的4.83 倍和2.66 倍,同时,其他基因(除了QmMYC6
在48h 有显著回升外)于12h 后均开始显著下降,且在12~24h间降幅最大,说明这些基因对干旱胁迫信号响应的逐渐终止;因此,QmMYCs
主要在蒙古栎叶片应对模拟干旱胁迫的6~24h间起作用,且响应的具体时间和程度不同。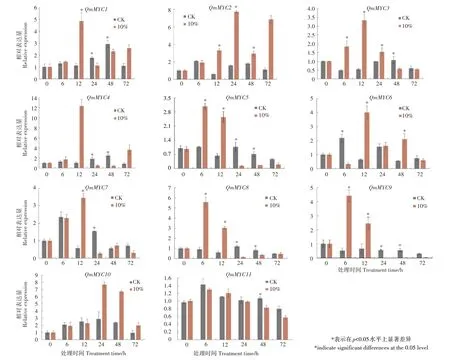
图9 模拟干旱胁迫下QmMYC基因家族的表达分析Figure9 Expression analysis of QmMYC gene family under simulated drought stress
3 讨论与结论
MYC
基因是COI1/JAZ/MYC2
复合体的重要组成部分,可以介导茉莉酸(JA)和各种激素信号通路,而茉莉酸信号通路参与植物的生长发育、调节植物的育性、花青素积累和叶片衰老等生物进程。然而,MYC
基因家族在木本植物中的功能报道较少。本研究基于蒙古栎基因组,鉴定了11个QmMYC
基因,根据系统发育分析,QmMYCs
分为4 个组,其CDS 长度和编码氨基酸长度分别介于在1293~2139bp 和430~712aa 之间,均为不稳定亲水蛋白并被定位到细胞核上,且除QmMYC3 外,全为酸性蛋白,这与玉米(Zea mays
L.)、茶树(Camellia sinensis
(L.)O.Ktze.)等研究结果较为一致。QmMYCs 二级结构均由α−螺旋、延伸链和扩展链无规则卷曲3 种形式组成,这与南方红豆杉(Taxus mairei
SY Hu)的MYC 蛋白研究结果一致,且在系统发育树中处于同一组的基因有着较为相似的蛋白三级结构、内含子外显子结构、保守基序。QmMYCs
分别定位在蒙古栎的2,3,4,8,11,12号染色体上,QmMYC2
和QmMYC5
来自散在重复,其余QmMYCs
多来自于全基因组复制事件。顺式作用元件可以作为重要的开关,参与调控基因在外界刺激下的转录。本研究中,11个QmMYC 家族基因在每个启动子区域具有不同类型和数量的顺式调控元件,表明这些基因对不同的胁迫和激素处理具有不同的调控功能。仅有4 个QmMYC
家族成员(QmMYC3
/6
/10
/11
)含有茉莉酸甲酯响应元件,导致这一结果的原因是茉莉酸甲酯响应元件的存在或缺失与一些MYC
基因的诱导或缺失。有54.5%的QmMYCs
启动子区域含有响应干旱胁迫的顺式作用元件,然而,干旱胁迫条件下QmMYCs
在幼苗叶片中的表达分析(图9)表明:除了含有干旱胁迫响应元件的QmMYC
基因外,其他基因对干旱胁迫也有一定的响应,这说明不同处理时间下的基因表达水平取决于相关顺式调控元件的存在,同时也受到其他生理途径的调控。蒙古栎幼苗叶片中,除QmMYC11
外,其余QmMYCs
均受到干旱胁迫信号的激活,在干旱胁迫的不同时期以不同的方式和程度起作用,这与小麦(Triticum aestivum
L.)、水稻(Oryza sativa
L.)和二穗短柄草[Brachypodium distachyon
(L.)Beauv.]的MYC
基因研究结果一致。QmMYC5/8/9
和QmMYC1/3/4
/6
/7
/分别是模拟干旱胁迫6 h和12 h的主要响应因子,其中QmMYC4
响应最显著,12 h后多数QmMYCs
表达水平开始下降,说明QmMYC
基因对干旱胁迫信号是一种短期的响应。同时,QmMYC2/10是
模拟干旱胁迫24 h的主要响应因子,与其他基因相比表达具有一定滞后性。MYC
转录因子激活对于植物防御十分重要,但由于过度的生长抑制、早衰或细胞死亡,过度激活是有害的。已有研究表明:在拟南芥叶片中,AtMYC2
激活茉莉酸信号通路,正向调控基因AtJAM1/2/3
的表达,JAM
对茉莉酸信号具有负调节作用,从而形成负反馈机制以防止植物过度防御。在本试验中,QmMYC4
与拟南芥AtMYC2~4
处于同一组,QmMYC2
/10
与拟南芥JAM3
/2
同源性较高,可能发挥着相似的功能。在模拟干旱胁迫过程中,QmMYC4
是主要的响应基因,且于12 h 增加,24 h 时降至最低下降,而Qm-MYC2
/10
表达量于24 h达到最高,因此可以推测:蒙古栎幼苗遭遇干旱胁迫时,可能也存在这样一条信号通路:干旱胁迫促使QmMYC4
表达量增加,但是到一定程度QmMYC2/10
相对表达量升高,反过来抑制了QmMYC4
的表达,以防止蒙古栎过度防御,这与番茄(Solanum lycopersicum
)中的JA信号通路较为一致。综上,通过对蒙古栎中QmMYCs
家族成员进行鉴定,发现其基因家族共有11 个成员,通过对QmMYCs
家族进行系统发育进化树的构建、蛋白质的理化性质、亚细胞定位、基因和蛋白结构、保守基序、染色体定位和启动子顺势作用元件的预测分析,表明QmMYCs
对不同的胁迫和激素处理具有不同的调控功能。对QmMYC
家族进行了分布表达分析,在模拟干旱胁迫下对QmMYCs
的表达模式进行阐述,发现其中除QmMYC11
外,其余QmMYCs
均受到干旱胁迫信号的激活,在干旱胁迫的不同时期以不同的方式和程度起作用。为进一步探索蒙古栎QmMYC
基因家族的生物学功能提供了理论研究基础。
