miR-620通过靶向ING4调控乳腺癌MCF-7细胞放射敏感性
谢文蕊,邓程伟,符正奇,张志东,吴进盛(1.海南省儋州市人民医院a.肿瘤内科,b.放疗科,c.肿瘤外科海南 儋州 571700;.海南医学院第一附属医院 肿瘤康复与姑息治疗科,海南 海口 570100)
乳腺癌是全球女性最常见的恶性肿瘤,是女性癌症相关死亡的第二大原因。尽管乳腺癌的综合诊疗技术不断提高,但全世界每年仍有50 万人死于乳腺癌[1]。目前,放射治疗(简称放疗)作为乳腺癌治疗的主要辅助手段,对降低乳腺癌复发风险、提高患者生存(OS)率具有重要意义[2-3]。然而,乳腺癌细胞放疗抗性的出现严重影响了放疗的效果[4]。因此,了解乳腺癌细胞放疗抗性的潜在机制,提高其放射敏感性是临床乳腺癌放疗亟待解决的重大课题。有研究[5]结果指出,miR-620 表达上调可能与乳腺癌的发生与发展有关。miR-620 通过调控靶基因表达可促进肿瘤细胞增殖,并增加肿瘤细胞的放疗抗性[6]。此外,在乳腺癌组织中生长抑制因子4(inhibitor of growth 4,ING4)表达下调,上调ING4 可抑制乳腺癌细胞增殖并诱导细胞凋亡[7-8],但其在乳腺癌放疗中的作用并不清楚。生物信息学预测发现,miR-620对ING4具有潜在的靶向调控作用,然而,目前miR-620调控ING4 表达介导乳腺癌细胞放射敏感性的作用机制尚未见报道。本研究通过检测miR-620和ING4在人乳腺癌组织和细胞中的表达水平,探讨miR-620/ING4 轴调控乳腺癌细胞放射敏感性的分子机制,旨在为提高临床乳腺癌患者的放疗效果提供实验依据。
1 材料与方法
1.1 组织标本、细胞和主要试剂
收集2017 年3 月至2018 年3 月在海南省儋州市人民医院确诊并手术切除的21例乳腺癌患者的癌组织及对应癌旁组织(距离肿瘤边缘大于5 cm)标本。所有乳腺癌患者术前均未接受放疗或化疗。患者均为女性,年龄28~65岁之间,中位年龄47岁。本研究开展前已征得患者或其家属同意并签署知情同意书,研究方案获得所在医院医学伦理委员批准。
人乳腺癌细胞MCF-7 和BCaP-37 以及乳腺上皮细胞HBL-100 购于中国科学院上海细胞库;DMEM培养基和胎牛血清为美国Gibco 公司产品,LipofectamineTM2000、BCA 蛋白定量试剂盒、逆转录试剂盒和qPCR 试剂盒均购于TaKaRa 公司,TRIzol试剂、MTT试剂、Annexin V-FITC/PI细胞凋亡检测试剂盒和WB 相关试剂购于上海碧云天生物科技有限公司,Cyclin D1、P21 和ING4抗体均为Abcam 公司产品,BAX、Bcl-2 和GAPDH 抗体及二抗均为Santa Cruz 公司产品,实验所用引物、anti-miR-NC、anti-miR-620、si-NC、si-ING4、miR-NC、miR-620 mimics由北京华大基因公司提供。
1.2 细胞转染
将MCF-7 细胞按照细胞密度2×105个/孔接种于6 孔板,利用LipofectamineTM2000 在细胞汇合度为60%时按照操作步骤进行转染。MCF-7细胞分组如下:miR-NC 组(转染miR-NC)和miR-620 组(转染miR-620 mimic)、anti-miR-NC 组(转染anti-miR-NC)和anti-miR-620组(转染anti-miR-620)、anti-miR-620+si-NC组(anti-miR-620和si-NC共转染)和anti-miR-620+si-ING4 组(anti-miR-620 和si-ING4 共转染)。转染24 h后,利用qPCR法检测miR-620或ING4 mRNA表达验证转染效果,转染成功的细胞方可用于后续实验。
1.3 qPCR 法检测乳腺癌组织和细胞中miR-620 和ING4 mRNA的表达水平
利用TRIzol试剂分别提取乳腺癌组织和细胞中总RNA,进行RNA定量。依照逆转录试剂盒说明书合成cDNA,按照qPCR 试剂盒说明测定miR-620 和ING4 mRNA 水平。引物序列:miR-620 上游为5′-GCCGAGATGGAGATAGATAT-3′,下游为5′-CTC AACTGGTGTCGTGGA-3′;U6上游为5′-CTCGCT TCGGCAGCACA-3′,下游为5′-AACGCTTCACGA ATTTGCGT-3′ ;ING4上游为5′-CACAAGTCCTG AGTATGGGAT-3′,下游为5′-AGGGGATGTGGA AGAAACTGT-3′;GAPDH 上游为5′-GAAATCCCAT CACCATCTTCCAGG-3′,下游为5′-GAGCCCCAGC CTTCTCCATG-3′。qPCR 反应条件:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共35 个循环。分别以U6 和GAPDH 作为内参对照,按照2-△△Ct法计算目的基因mRNA的相对表达量。
1.4 双荧光素酶报告基因实验验证miR-620与ING4的靶向关系
用StarBase 网站预测miR-620 与ING4 之间是否存在特异性结合位点。将含有miR-620 结合位点的ING4-3′UTR 的野生型(WT)序列、ING4 的突变型(MUT)序列克隆到pmirGLO 载体,构建双荧光素酶报告基因质粒WT-ING4、MUT-ING4。按照LipofectamineTM2000转染试剂说明书方法将WT-ING4与miR-620 mimic 或miR-NC、MUT-ING4 与miR-620 mimic 或miR-NC 共转染至MCF-7 细胞,培养48 h后,收集各组细胞用双荧光素酶报告基因检测试剂盒测定各组细胞的荧光素酶活性。
1.5 克隆形成实验检测乳腺癌细胞克隆形成能力
将anti-miR-NC组、anti-miR-620组、anti-miR-620+si-NC 组和anti-miR-620+si-ING4 组MCF-7 细胞分别以不同剂量(0、2、4、6、8 Gy)的X 线照射2 h,继续培养48 h,更换新鲜培养液后继续培养,当肉眼可见克隆形成时,吸除培养液,PBS 洗涤后用甲醇固定20 min,再用0.2%结晶紫染色10 min,显微镜下计算≥50 个细胞的克隆数,计算克隆形成率(克隆数/接种细胞数×100%)。利用GraphPadPrism 7 软件,单击多靶模型公式存活分数(survival fraction,SF)=1-(1-e-D/D0)N,拟合细胞存活曲线曲线,D为照射剂量,D0为平均致死剂量。计算准域剂量(Dq)和放射增敏比(sensitization enhancement ratio,SER),Dq=ln N×D0,SER=Do对照组/D0实验组。照射剂量为2 Gy 时对应的细胞存活分数记为SF2。
1.6 MTT法检测乳腺癌细胞增殖活力
将anti-miR-NC组、anti-miR-620组、anti-miR-620+si-NC 组和anti-miR-620+si-ING4 组MCF-7 细胞消化为单细胞悬液,按照每孔200 μl接种到96孔板(5×103个细胞/孔),当细胞贴壁后用4 Gy X 线照射2 h,依次记 为IR+anti-miR-NC 组、IR+anti-miR-620 组、IR+anti-miR-620+si-NC组和IR+anti-miR-620+si-ING4组,置于细胞培养箱中继续培养,分别于24、48、72 h后,上酶标仪在490 nm 波长处测定每孔细胞的光密度(D)值。
1.7 FCM检测乳腺癌细胞凋亡和周期
细胞凋亡检测:取转染后4 Gy X线照射2 h并继续培养48 h的各组MCF-7细胞,PBS液洗涤并重悬细胞,每孔加入Annexin V-FITC和PI溶液各5 μL,混合均匀后,避光处理10 min,上FCM检测细胞的凋亡情况。
细胞周期检测:43×g离心5 min收集各组细胞沉淀,弃上清,用预冷PBS洗涤2次后,加入预冷75%乙醇,4 ℃固定4 h以上。以805×g离心5 min,弃上清,PBS洗涤后,加入400 μL PI(50 μg/mL)、100 μL RNase A(100 μg/mL),4 ℃避光处理30 min,上FCM检测细胞周期分布情况。
1.8 WB 法检测乳腺癌细胞中ING4、BAX、P21、Bcl-2和Cyclin D1蛋白表达
利用RIPA裂解液提取各组MCF-7细胞总蛋白,BCA法蛋白定量后,沸水浴3 min变性细胞蛋白。随后按照试剂盒说明书的实验步骤上样、进行SDSPAGE,将蛋白质转移至PVDF 膜上,在5%脱脂奶粉中封闭2 h。然后加入ING4(1∶1 000)、BAX(1∶500)、P21(1∶1 000)、Bcl-2(1∶500)、Cyclin D1(1∶1 000)和GAPDH(1∶1 000)一抗中,4 ℃处理12 h,洗膜后,加入山羊抗兔二抗(1∶2 000)中37 ℃处理2 h。利用ELC 发光试剂盒进行显影,凝胶成像系统拍照。以GADPH为内参,采用ImageJ软件分析目的蛋白条带的灰度值。
1.9 统计学处理
qPCR法、克隆形成、MTT法、FCM和WB法等实验均重复3次。所有数据均用SPSS 17.0 统计软件进行数据处理,符合正态分布的计量数据以表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05或P<0.01表示差异有统计学意义。
2 结果
2.1 乳腺癌组织和细胞中miR-620 高表达、ING4 mRNA低表达
qPCR法检测结果(图1)显示,与癌旁组织比较,乳腺癌组织中miR-620 表达显著升高、ING4 mRNA表达水平显著降低(均P<0.01,图1A);与乳腺上皮细胞HBL-100 比较,乳腺癌MCF-7 和BCaP-37 细胞中miR-620 表达水平均显著升高、ING4 mRNA 表达水平均显著降低(均P<0.01,图1B)。由于miR-620 在MCF-7 细胞中的表达水平较高,选用该细胞进行后续实验。
2.2 成功转染anti-miR-620和si-ING4
qPCR 法检测结果显示,anti-miR-620 组MCF-7细胞中miR-620 表达水平显著低于anti-miR-NC 组(0.31±0.03vs1.00±0.00,P<0.01),说明anti-miR-620转染成功;anti-miR-620+si-ING4 组ING4 mRNA 表达水平显著低于anti-miR-620+si-NC 组(0.37±0.05vs1.00±0.09,P<0.01)。结果表明,anti-miR-620 和si-ING4转染成功。
2.3 敲减miR-620 或同时敲减ING4 对MCF-7 细胞的放射敏感性的影响
以0、2、4、6、8 Gy X线照射各转染组MCF-7细胞后,克隆形成实验结果(图2)显示,anti-miR-620 组细胞存活分数显著低于anti-miR-NC 组(P<0.01),anti-miR-620+si-ING4 组细胞存活分数显著高于anti-miR-620+si-NC 组(P<0.01)。结果表明,敲减miR-620降低放射线照射的MCF-7细胞活性,而同时敲减ING4 则逆转敲减miR-620 对放射线照射的MCF-7细胞活性的影响。
当照射剂量为4 Gy 时,敲减miR-620 的MCF-7细胞活性抑制率约为50%,因此比较照射剂量为4 Gy时细胞克隆形成率和增敏比,结果(图3,表1)显示,IR+anti-miR-620 组细胞克隆形成率显著低于IR+anti-miR-NC 组(P<0.01),增敏比为1.891;IR+anti-miR-620+si-ING4 组细胞克隆形成率显著高于IR+anti-miR-620+si-NC 组(P<0.01),增敏比为0.628。结果表明,敲减miR-620 提高MCF-7 细胞放射敏感性,而同时敲减ING4 则逆转敲减miR-620 对MCF-7细胞放射敏感性的作用。
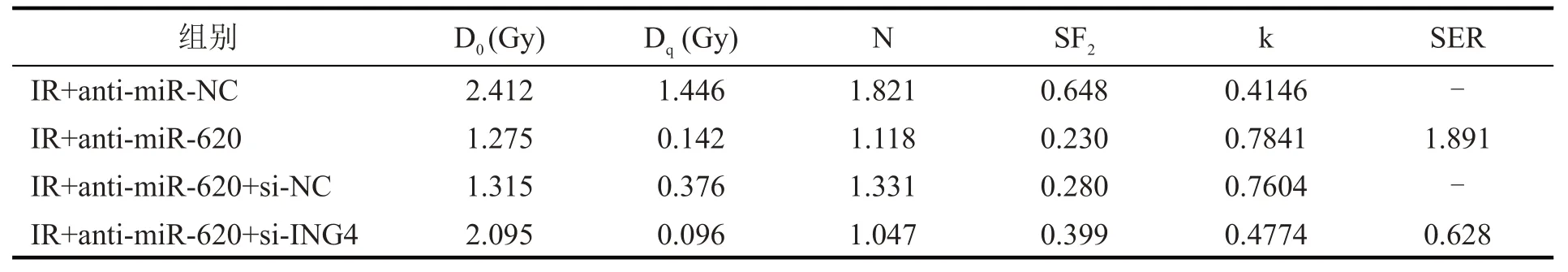
表1 单击多靶模型参数
2.4 敲减miR-620 或同时敲减ING4 对MCF-7 细胞增殖和凋亡的影响
4 Gy 照射MCF-7 细胞后,MTT 法和FCM 检测结果(表2,图4)显示,与IR+anti-miR-NC 组比较,IR+anti-miR-620 组MCF-7 细胞增殖活力、S 期细胞比例均显著降低(均P<0.01),细胞凋亡率、G0-G1期细胞比例显著升高(均P<0.01);与IR+anti-miR-620+si-NC 组比较,IR+anti-miR-620+si-ING4 组MCF-7 细胞增殖活力、S期细胞比例均显著升高(均P<0.01),细胞凋亡率、G0-G1 期细胞比例均显著降低(均P<0.01)。结果表明,敲减miR-620 抑制放射线照射的MCF-7细胞增殖和细胞周期进程,并促进细胞凋亡;同时敲减ING4可逆转敲减miR-620对放射线照射的MCF-7细胞增殖、细胞周期进程及凋亡的作用。

表2 敲减miR-620或同时敲减ING4对MCF-7的细胞周期、增殖和凋亡的影响
2.5 miR-620靶向负性调控ING4的表达
靶基因测序工具StarBase 预测结果(图5A)显示,ING4 的3'UTR 存在于miR-620 特异性结合的核苷酸序列。双荧光素酶报告基因实验结果(图5B)显示,与共转染WT-ING4 与miR-NC 的细胞相比,共转染WT-ING4 与miR-620 mimic 的细胞荧光素酶活性显著降低(P<0.01);而与共转染MUT-ING4 与miR-NC的细胞相比,共转染MUT-ING4 与miR-620 mimic 的细胞荧光素酶活性无变化(P=0.851>0.05)。qPCR法和WB 法检测结果(图5C)显示,与miR-NC 组比较,miR-620 组MCF-7 细胞中miR-620 表达水平显著升高(4.15±0.12vs1.00±0.00,P<0.01)、ING4 蛋白表达显著降低(P<0.01);anti-miR-620 组MCF-7 细胞miR-620 表达低于miR-NC 组(0.31±0.03vs1.00±0.00,P<0.01)、ING4 蛋白表达显著高于anti-miR-NC组(P<0.01)。结果表明,miR-620 靶向负性调控ING4的表达。
2.6 敲减miR-620 或同时敲减ING4 对MCF-7 细胞中ING4、细胞周期和凋亡相关蛋白表达的影响
4 Gy照射MCF-7细胞后,WB法检测结果(图6)显示,与IR+anti-miR-NC 组比较,IR+anti-miR-620组细胞中BAX、P21 和ING4 蛋白表达均显著升高(均P<0.01),Bcl-2和Cyclin D1 蛋白表达均显著降低(均P<0.01);与IR+anti-miR-620+si-NC 组比较,IR+anti-miR-620+si-ING4 组细胞中BAX、P21 和ING4 蛋白表达均显著降低(均P<0.01)、Bcl-2 和Cyclin D1 蛋白表达显著升高(均P<0.01)。结果表明,敲减miR-620可能通过靶向下调ING4 调控BAX、P21、Bcl-2和Cyclin D1的表达,进而抑制放射线照射的MCF-7细胞增殖并促进细胞凋亡。
3 讨论
目前,放疗是局部晚期乳腺癌患者的主要治疗方式之一,但由于肿瘤细胞放射抗性的产生,使肿瘤细胞增殖能力增强,进而诱导肿瘤的复发和转移,导致乳腺癌患者预后不良。因此,探究调控乳腺癌细胞放射敏感性的基因和分子机制,对解决临床乳腺癌细胞放射抗性难题具有重要意义。miRNA是一类短链非编码RNA,其通过与靶mRNA 的3′非编码区结合,导致转录本降解或抑制蛋白质翻译。miRNA的异常表达与肿瘤细胞的增殖、凋亡、侵袭转移等过程密切相关,影响着恶性肿瘤的发生和发展[9-10]。近年来,有研究[11-13]结果证实,miRNA 与肿瘤细胞的放射抗性密切相关,多种miRNA 通过调控其靶基因参与对肿瘤细胞放射敏感性的调控。例如,miR-139-5p通过抑制DNA 修复和ROS 防御的多基因网络调控乳腺癌的放疗耐药[12],miR-22通过靶向SIRT1抑制肿瘤发生,提高乳腺癌细胞的放射敏感性[13]。此外,HUANG等[6]研究发现,miR-620通过靶向下调HPGD表达,促进癌细胞增殖,减少G2/M阻滞,从而增强癌细胞的放疗抗性。本研究结果发现,与乳腺上皮细胞HBL-100 相比,miR-620 在乳腺癌细胞中呈高表达。选取表达量最高的MCF-7 细胞进行实验,发现敲减miR-620 表达可降低促增殖蛋白Cyclin D1、抗凋亡蛋白Bcl-2表达,提高抗增殖蛋白P21、促凋亡蛋白BAX 表达水平,抑制乳腺癌MCF-7 细胞增殖,促进细胞凋亡,进而上调MCF-7细胞的放射敏感性。这与HUANG等[6]miR-620增强乳腺癌细胞MDA-MB-231放疗抗性的结论相吻合。
ING4 是生长抑制蛋白家族的成员之一,该家族成员具有相似的结构特征,包括PHD指状结构域、典型的核定位信号和一个未知功能的特殊区域[14]。ING4是一种潜在的肿瘤抑制因子,在调控细胞周期、凋亡、DNA 修复、染色质修饰、抑制细胞迁移和血管生成等过程发挥重要作用,ING4 表达下调与肿瘤转移增加、TMN 分期进展及乳腺癌患者预后不良有关[15-16]。已有研究[17]证实,ING4在非小细胞肺癌组织中呈低表达,过表达ING4可增强非小细胞肺癌细胞SPC-A1 的放射敏感性。此外,有研究[18]结果发现,ING4 在乳腺癌组织中表达下调,ING4 和IL-24 两种抑癌基因的共表达可显著提乳腺癌MDA-MB-231细胞的放疗敏感性。生物信息学预测显示,ING4 可能是miR-620 的靶基因,但miR-620 能否通过调控ING4表达影响乳腺癌细胞的放射敏感性尚未可知。本研究通过双荧光素酶报告基因实验和WB 实验证实,miR-620 可靶向负性调控ING4 表达。研究结果[19]表明,ING4 可能通过引起G2/M 期阻滞,诱导细胞凋亡,进而抑制乳腺癌细胞增殖,这与本研究中敲减ING4逆转anti-miR-620对Cyclin D1蛋白表达抑制和P21蛋白表达促进作用的结果相吻合。此外,本研究结果发现,敲减ING4 能解除anti-miR-620 对MCF-7细胞增殖抑制和凋亡促进的作用,并降低细胞的放射敏感性。
综上所述,miR-620在乳腺癌MCF-7细胞中表达上调,敲减miR-620 可促进ING4 表达,抑制MCF-7细胞增殖,促进细胞凋亡,从而增加MCF-7细胞的放射敏感性,这为临床乳腺癌的放射治疗提供了新的靶点。