长链非编码RNA LUCAT1在恶性肿瘤中作用及机制的研究进展
白易 综述;李仲珉,张雅敏 审阅(.南开大学医学院附属医院 天津市第一中心医院 肝胆外科,天津 3009;.天津医科大学 一中心临床学院,天津 300070)
恶性肿瘤是一种威胁人类健康的严重疾病。多年来,对肿瘤生物学的研究集中在蛋白质编码基因的参与上,而长链非编码RNA(long non-coding RNA,lncRNA)是一种长度超过200个核苷酸且不具备蛋白质编码功能的RNA 分子,曾被认为是转录垃圾,近30 年才发现其在细胞活动中起到关键的调控作用[1-2]。目前认为,lncRNA 具有高度的组织和细胞特异性,其来源复杂、结构多样,可以在多个维度调控DNA、RNA 和蛋白质的功能[3-6]。位于5 号染色体q14.3 区的反义链的肺癌相关转录物1(lung cancerrelated transcript 1,LUCAT1)最早是在吸烟的肺癌患者中被发现的[7-8]。越来越多的研究结果[9]发现,LUCAT1 在多种类型恶性肿瘤中具有促进肿瘤发生和发展的作用,并与患者的肿瘤大小、组织学分级、TNM分期和生存期(OS)等多项临床特征显著相关。本文综述了LUCAT1 促进肿瘤发生和发展的作用机制、在不同类型恶性肿瘤(主要为消化系统和泌尿生殖系统)中的表达和功能、在预后评估中的研究进展,旨在为恶性肿瘤的早期诊断和治疗及预后评估提供参考资料。
1 LUCAT1促进肿瘤发生和发展的作用及机制
1.1 与DNA的相互作用
抑癌基因的启动子区甲基化会导致转录沉默和基因功能丧失,进而促进肿瘤的形成和发展。研究结果[10]表明,LUCAT1可以通过甲基化、磷酸化、乙酰化或泛素化等转录后机制增强DNA甲基转移酶1的表达,维持抑癌基因启动子区甲基化,并下调其表达,促进肿瘤的形成。多梳抑制复合物2 由EZH2、SUZ12 和EED 组成,能催化组蛋白3 上的第27 位赖氨酸的三甲基化(H3K27me3),继而调控下游基因表达。有研究结果[11-12]显示,LUCAT1 可以招募并结合EZH2,随后与抑癌基因p21 和p57 的启动子区相结合,下调其表达并促进肿瘤细胞增殖。
1.2 与miRNA的相互作用
miRNA可以与靶基因mRNA的3'UTR相互作用,使mRNA 去甲基化和失稳。作为竞争性内源RNA(competitive endogenous RNA,ceRNA),lncRNA可以像分子海绵一样在细胞质中吸附miRNA并降低其活性,间接上调其下游靶基因的表达。多项研究结果[13]表明,LUCAT1可以作为ceRNA调控不同的miRNA及其靶基因(表1)。在肝母细胞瘤中,LUCAT1通过与miR-301b竞争性结合,上调STAT3的表达,促进肝母细胞瘤细胞的增殖、迁移和侵袭。在乳腺癌中,LUCAT1通过吸附miR-5582-3p、miR-7-5p 和miR-181a-5p,上调SOX2、KLF6和KL15的表达,激活Wnt/β-catenin通路,提高乳腺癌干细胞的细胞干性,促进肿瘤生长[14-15]。此外,LUCAT1不仅可以与miR-375结合,间接上调YAP1来促进肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)细胞增殖、迁移和侵袭,在口腔鳞状细胞癌及胶质瘤中也同样具有致癌作用[16-18]。但也有研究结果[19]显示,LUCAT1在肝恶性肿瘤中可以通过吸附miR-181d-5p并降低其表达水平,降低肝恶性肿瘤的侵袭潜力,抑制其复发。
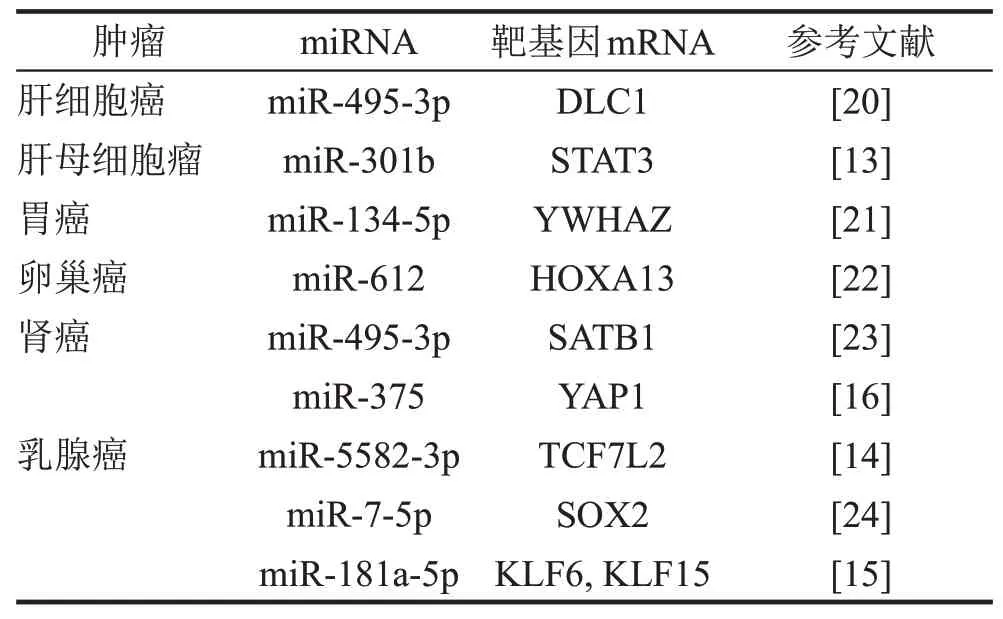
表1 LUCAT1与miRNA结合的不同类型肿瘤靶基因
1.3 与蛋白质的相互作用
由于lncRNA 较长,易于形成空间二级结构,因此也可以通过结合蛋白质参与分子调控,LUCAT1可以和多种蛋白质相互结合发挥作用。如:下调LUCAT1 后,CDK2、CDK4、cyclin D1、cyclin E1 和cyclin E2的表达显著降低,继而降低视网膜母细胞瘤蛋白(retinoblastoma protein,Rb)的磷酸化,增强p21蛋白表达,并诱导细胞周期停滞在G1 期[25-27]。LUCAT1也可以干扰核糖体的生物合成,下调rRNA、18S RNA 和pre-rRNA 的表达,促进结直肠癌(colorectal cancer,CRC)进展[28]。此外,LUCAT1也可以与核仁素直接结合,继而解除核仁素对MYC的抑制作用,促进CRC细胞增殖[29]。LUCAT1还可以与多聚嘧啶区结合蛋白1 相互作用,调控下游靶基因CD44、APP、CLSTN1、MBNL1 和ZNF207 的选择性剪接,阻碍这些靶基因参与的细胞增殖和DNA 损伤修复进程[30]。最后,LUCAT1 还可以抑制膜联蛋白A2 的磷酸化并影响其翻译后修饰,抑制膜联蛋白A2-S100A10 四聚体的降解,加速纤溶酶原向纤溶酶的转化,从而激活金属蛋白酶,促进肝细胞癌(hepatocellular carcinoma,HCC)的进展和转移[31]。
2 LUCAT1在消化系统恶性肿瘤中的作用
2.1 食管癌
有研究结果[10]发现,LUCAT1在食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)组织和细胞中表达均显著上调,LUCAT1 高表达的患者OS更短。下调LUCAT1 后,可以抑制癌细胞增殖、侵袭和迁移,并诱导细胞凋亡。进一步机制发现,LUCAT1 主要通过调控DNA 甲基转移酶1 下调抑癌基因的表达,促进ESCC 的进展。因此,LUCAT1 不仅可以作为ESCC的预后生物标志物,还可以作为潜在的治疗靶标。
2.2 胃癌
CHI 等[21]发现,LUCAT1 在胃癌组织中的表达水平显著高于癌旁组织,且高表达与患者的OS和无病生存期(DFS)缩短相关,敲降LUCAT1后可以显著抑制胃癌细胞增殖、迁移和侵袭。在胃癌组织和细胞中,LUCAT1和miR-134-5p的表达呈负相关。既往的研究结果[32-34]表明,miR-134-5p 可以通过抑制肿瘤细胞增殖、迁移和侵袭,在ESCC、HCC、肾癌和乳腺癌等多种肿瘤中发挥抑癌作用。进一步通过TargetScan 在线工具预测发现,miR-134-5p 与YWHAZ基因之间存在结合位点,且YWHAZ在胃癌中的表达与miR-134-5p呈负相关。经实验验证后发现,LUCAT1 可以通过ceRNA 机制竞争性结合miR-134-5p,继而上调YWHAZ mRNA 的表达,促进胃癌细胞的进展[21]。该研究结果提示,LUCAT1不仅具有诊断胃癌、评估其预后的潜质,也是胃癌潜在的治疗靶点。
2.3 HCC
LUCAT1在HCC组织中表达上调已经得到了多项研究[19,31,35]的证实。在HCC异种移植模型中,过表达LUCAT1 显著增强HCC 细胞的增殖、迁移和侵袭能力,并促进体内肿瘤的生长和转移[31]。JIAO等[19]通过回顾性分析371例HCC患者的测序数据和临床数据发现,LUCAT1 高表达与肿瘤分化差、病理分期晚相关,且高表达LUCAT1 患者的OS 更短,多因素分析也证实,LUCAT1 是HCC 预后不良的独立风险因素。因此,LUCAT1 可以作为HCC 治疗的靶点和预后相关的生物标志物。
2.4 胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)
PDAC 是最常见的胰腺癌病理亚型。研究结果[25,36]表明,LUCAT1 在PDAC 组织和细胞中表达均显著上调,LUCAT1高表达与PDAC肿瘤大小和淋巴结转移相关。体外实验结果[36]表明,下调LUCAT1表达可以抑制PDAC 细胞的增殖、迁移和侵袭,并诱导细胞周期停滞。基于肿瘤异种移植模型的体内实验[36]进一步证实,LUCAT1的下调可以显著减小肿瘤质量和体积。通过生物信息学分析和荧光素酶报告基因实验发现,LUCAT1可以作为miR-539的分子海绵发挥促癌作用。此外,LUCAT1 还可以通过诱导AKT和MAPK的磷酸化,促进PDAC细胞发育[25]。
2.5 CRC
据报道[29-30,37-38],CRC 组织和细胞中LUCAT1 的表达同样显著上调,且LUCAT1高表达降低了患者的OS。相关研究结果[28]表明,下调LUCAT1 表达不仅可以显著抑制CRC细胞的增殖、迁移和侵袭能力,诱导细胞凋亡,并增强CRC 细胞对化疗药物奥沙利铂和5-FU 的敏感性。机制研究结果[28]表明,LUCAT1主要通过与UBA52 结合而活化RPL40-MDM2-P53信号通路,促进CRC的发生和发展。
3 LUCAT1在泌尿生殖系统恶性肿瘤中的作用
3.1 肾癌
肾细胞癌(renal cell carcinoma,RCC)是泌尿系统最常见的恶性肿瘤之一,其中ccRCC 是最常见的RCC 亚型,约占所有RCC 的75%。多项研究[9,16,39]报道了LUCAT1同ccRCC患者的不良预后、分型、TNM分期和转移的相关性,但其主要作用机制尚存在争议。XIAO 等[11]研究发现,LUCAT1 的下调可显著抑制肾癌细胞的增殖、迁移和侵袭,并可使癌细胞停滞在G1 期;LUCAT1 在ccRCC 细胞核的表达明显高于细胞质。LUCAT1主要与PRC相互作用,抑制p57的表达,在ccRCC 中发挥癌基因的作用。而WANG等[23]的研究则发现,LUCAT1可作为ceRNA竞争性结合miR-495-3p,从而上调特异性核基质结合区结合蛋白1(special AT-rich sequence binding protein 1,SATB1)的表达[40],SATB1 在多种肿瘤的侵袭和转移中发挥重要作用。ZHENG 等[26]的研究结果则表明,敲降LUCAT1 可以抑制cyclin D1、CDK4 和p-Rb 的表达,诱导细胞周期阻滞于G1期;过表达LUCAT1也可以促进丝氨酸/苏氨酸激酶的磷酸化,抑制糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)的活性。趋化因子CXCL2 可以上调LUCAT1 在RCC 细胞中的表达,提示CXCL2/LUCAT1/AKT/GSK-3β轴在RCC的发生和发展过程中起关键作用。因此,LUCAT1 在RCC 中的亚细胞定位及具体分子调控机制仍有待进一步研究。
3.2 卵巢癌
多项研究结果[41-44]证明,HOXA13 同恶性肿瘤的进展密切相关。LUCAT1在卵巢癌组织中显著上调,并与晚期卵巢癌的分期、转移和不良预后呈正相关[22]。同时,发现LUCAT1 可以通过竞争性结合miR-612而上调HOXA13的表达,促进卵巢癌细胞增殖、迁移和侵袭。也有研究结果[45]发现,LUCAT1 的3'UTR含有高度保守的miR199a-5p结合位点。qPCR检测结果进一步证实,LUCAT1的上调可以显著降低miR-199a-5p 的表达,而miR-199a-5p 已被证明可以调控细胞的多种生物学过程,包括增殖、凋亡、迁移和侵袭[46-47]。总之,LUCAT1 是一个非常有前景的卵巢癌的治疗靶点。
3.3 宫颈癌
宫颈癌也是妇科最常见的恶性肿瘤之一,多项研究结果[48]表明,多种lncRNA 在宫颈癌组织和细胞中表达异常,参与多条信号通路的调控,影响宫颈癌细胞的增殖、凋亡、迁移和侵袭等过程。ZHANG等[49]研究发现,核转录因子SP1能上调LUCAT1在宫颈癌细胞中的表达。通过生物信息学工具预测发现,miR-181a 是LUCAT1 的潜在结合miRNA,而荧光素酶报告基因实验和RNA免疫沉淀实验也证实了这一点。值得注意的是,miR-181a 在包括宫颈癌在内的多种类型肿瘤中低表达,具有抑癌作用[50-53]。通过机制研究[49]发现,SP1 可以直接与LUCAT1 的启动子区域结合并激活其转录,然后通过竞争性结合miR-181a促进宫颈癌细胞的增殖、迁移和侵袭。
4 LUCAT1在其他恶性肿瘤中的作用
4.1 胶质瘤
胶质瘤是神经系统中最常见的恶性肿瘤。GAO等[18]研究结果发现,LUCAT1在胶质瘤组织和细胞中表达显著上调,且在肿瘤分期较晚的胶质瘤患者中表达更高,下调LUCAT1表达可显著抑制胶质瘤细胞的增殖和侵袭。利用生物信息学工具DIANA 对LUCAT1 的靶点进行预测发现,miR-375 与其存在潜在的结合位点。通过荧光素酶报告基因实验进一步证实了二者之间存在的结合位点。qPCR 实验结果也证实,miR-375 与LUCAT1 表达呈负相关关系,在胶质瘤组织中表达下调。功能实验证实,miR-375可以逆转LUCAT1 对胶质瘤细胞增殖和侵袭的促进作用。
4.2 肺癌
LUCAT1 在非小细胞肺癌(non-small cell lung cancer,NSCLC)组织中的表达水平显著高于癌旁组织,在肿瘤较大、TNM 分期较晚和预后差的NSCLC患者中其表达水平更高[12]。实验结果[12]证明,敲除LUCAT1基因后显著抑制NSCLC细胞在体外和体内的增殖能力;机制研究表明,LUCAT1 与多梳抑制复合物2 之间存在相互作用,通过形成复合物发挥对p21和p57的表观抑制作用。
4.3 乳腺癌
乳腺癌是全球范围内女性最常见的恶性肿瘤和肿瘤死亡的首要原因[54]。多项研究结果[14-15,24,55-56]发现,LUCAT1 在乳腺癌组织和细胞中表达均显著上调,且与肿瘤大小、淋巴结转移和临床分期密切相关。ZHENG 等[14]研究发现,LUCAT1 可作为miR-5582-3p的分子海绵影响其与转录因子7类似物2 的靶向结合,继而活化Wnt/β-catenin 通路,在体内和体外促进乳腺癌干细胞的自我更新和增殖。此外,LI 等[24]的研究结果发现,LUCAT1 也可以作为miR-7-5p 的分子海绵,间接上调转录因子SOX2,从而促进乳腺癌细胞的增殖、迁移和侵袭。
5 结语
lncRNA是肿瘤发生和发展的重要调控因子。随着研究的不断深入,lncRNA 在肿瘤发生和发展中的作用愈发值得深入探讨和总结。结合现有研究,lncRNA LUCAT1 在多种类型肿瘤中表达上调,并与肿瘤大小、组织学分级、TNM 分期和OS 等临床特征显著相关,是潜在的肿瘤诊断和预后评估生物标志物。值得一提的是,在体内和体外敲降LUCAT1后可显著抑制各种类型肿瘤细胞的增殖、迁移和侵袭能力,表明LUCAT1 是肿瘤免疫治疗的潜在靶点。LUCAT1发挥的分子调控机制与其亚细胞定位有关。在细胞核中,LUCAT1可调控DNA甲基化,并与核蛋白相互作用进行基因调控;在细胞质中,LUCAT1 则可作为基因调控的ceRNA,调控mRNA代谢。总之,本综述总结了LUCAT1 在各种类型肿瘤中的作用及其分子机制,拓宽了对肿瘤表观遗传学发病机制的理解,并为研发新的肿瘤诊断生物标志物和治疗靶点提供了新的思路。